Введение. Опухоли почки составляют 2–3% всех новообразований у взрослых, при этом около 40% всех лиц, страдающих данным заболеванием, имеют риск умереть от его прогрессирования. Заболеваемость различными формами опухолей почек характеризуется тенденцией к неуклонному росту.
В настоящее время в диагностике различных типов опухолей почек используется множество маркеров, но ни один из них не обладает достаточной специфичностью и чувствительностью, не всегда позволяет дифференцировать злокачественное новообразование от доброкачественного [1].
С целью раннего выявления, а значит, и более успешного лечения новообразований проводится поиск новых, более чувствительных и специфических маркеров.
Перспективным представляется использование с этой целью паранеопластических антигенов (ПНА) – белков, отсутствующих в нормальной ткани и появляющихся лишь после ее малигнизации. Большинство ПНА – нормальные белки организма, однако в результате злокачественной трансформации ПНА начинают продуцироваться и в клетках опухоли за пределами иммунотолерантной ткани организма [2].
Отдельная группа антигенов, которые могут аберрантно экспрессироваться в почечной ткани при ее злокачественной трансформации, включает белки, синтезируемые преимущественно в иммунотолерантных тканях (например, нервной или ткани сетчатки глаза). Такие антигены подразделяются на два подтипа: онконевральные и раково-сетчаточные антигены (cancer-retina antigen – CRA) в зависимости от их происхождения. Большинство CRA представляет собой фоторецепторные белки, участвующие в визуальной трансдукции. Их аберрантная экспрессия была отмечена в разных видах злокачественных новообразований, таких как рак желудка, рак легких, колоректальный рак и др. [3,4]. Чаще всего CRA обнаруживались в меланоме, которая экспрессирует такие фоторецепторные белки, как родопсин, трансдуцин, цГМФ-фосфодиэстераза-6, цГМФ-зависимые каналы, гуанилилциклаза, родопсинкиназа, рековерин (Rec) и зрительный аррестин (аррестин-1; Arr-1) [5]. Так как CRA происходят из иммунопривилегированной зоны, они чужды иммунной системе и могут проявлять высокую иммуногенность. Действительно, аберрантная экспрессия CRA в злокачественных опухолях, локализованных за пределами сетчатки, способна вызывать ответ иммунной системы, проявляющийся в выработке специфических антител и Т-клеток. Подобные изменения в функционировании иммунной системы могут приводить к развитию паранеопластических синдромов (ПНПС), отягчающих ход основного заболевания. Ретинальная дегенерация, как ПНПС, встречается примерно у 6% больных раком почки. Некоторые виды CRA были признаны опухолеспецифическими антигенами [5].
Целью исследования было оценить возможность использования Arr-1, Rec, AAA1и AAR в качестве биомаркеров опухоли почки.
Материалы и методы. В исследовании использован материал, полученный в ходе оперативных вмешательств, проведенных 62 пациентам с предварительным диагнозом «опухоль почки». Среди прооперированных было 33 мужчины и 29 женщин, средний возраст которых составил 59±11,6 года (от 25 до 86 лет). Операции были выполнены в Институте урологии и репродуктивного здоровья человека Первого МГМУ им. И. М. Сеченова (Сеченовский Университет). Анализ материала проводили в биопсийной лаборатории, в лаборатории электронной микроскопии и иммуногистохимии централизованного патологоанатомического отделения Первого МГМУ им. И. М. Сеченова.
Фрагменты ткани опухоли фиксировались в 10%-ном нейтральном забуференном формалине на протяжении 24 ч. Далее осуществлялась проводка материала по стандартной методике и заливка в парафин. С парафиновых блоков получали срезы толщиной 4 мкм. Далее материал депарафинировали и окрашивали гематоксилином и эозином.
При световой микроскопии полученных препаратов осуществляли верификацию опухолей почек: светлоклеточный почечно-клеточный рак (ПКР), папиллярный ПКР, хромофобный ПКР и онкоцитома (в соответствии с гистологической классификацией ВОЗ, 2016). Степень дифференцировки (от G1 до G4) оценивали только в случаях светлоклеточного и папиллярного ПКР в соответствии с рекомендациями ВОЗ и Международного общества уропатологов (ISUP). Стадию заболевания определяли по классификации злокачественных опухолей мочеполовой системы [6].
Для иммуногистохимического исследования депарафинированные срезы инкубировали с поликлональными антителами против Rec и Arr-1 (30 мкг/мл). Далее проводили иммунопероксидазное окрашивание с использованием стрептавидин-пероксидазного комплекса.
Реакцию считали позитивной при окрашивании более 10% из 100 опухолевых клеток.
В качестве положительного контроля использовали ткань сетчатки глаза, в качестве отрицательного контроля – образцы ткани почки пациентов мочекаменной болезнью.
Обнаружение антител против Rec (AAR) и против Arr-1 (AAA-1) в сыворотке крови пациентов проводили с помощью анализа вестерн-блот. После проведения электрофореза антигенов к Arr-1 и Rec в 12,5%-ном полиакриламидном геле в присутствии SDS осуществляли перенос белков (по 1,5 мкг каждого белка) из геля на нитроцеллюлозную мембрану «Hybond-C extra» в буфере 1 (Трис-Глицин-Этанол рН=7,5) при постоянной силе тока 300 мА в течение 1 ч. Далее мембраны инкубировали в 5%-ном растворе сухого обезжиренного молока в буфере 2 (20 мМ Трис-HCl рН=7,5), содержащем 500 мМ NaCl и 0,05% Tween 20, в течение 1,5 ч. Затем инкубировали в присутствии сыворотки крови пациентов с опухолью почки (разведение 1:20) в течение 12 ч. Окрашивание проводили при помощи вторичных антител, полученных против иммуноглобулинов человека, связанных с пероксидазой хрена. Для этого мембрану инкубировали в растворе вторичных антител (разведение 1:1000 в буфере 2), после чего промывали буфером 2 для удаления несвязавшихся белков. Окрашивание белков, связавших меченые иммуноглобулины, проводили в буфере 2, содержащем 20 мкл 30%-ной перекиси водорода и диаминобензидина.
Статистическая обработка выполнена с применением методов описательной статистики. Различия между группами считали значимыми при показателе p меньше 0,05.
Результаты. Морфологическая характеристика опухолей. Согласно данным световой микроскопии строение 28 (45,2%) опухолей соответствовало светлоклеточному ПКР, 11 (17,7%) – папиллярному ПКР, 11 (17,7%) – хромофобному ПКР и 12 (19,4%) – онкоцитоме.
Среди 50 пациентов со злокачественными новообразованиями у 11 (22%) человек выявлена стадия рT1а, по 5 (10%) случаев пришлось на стадии рТ1b и рТ2а, у 3 (60%) пациентов диагностирована стадия рТ2b. Cтадия рТ3 диагностирована в 26 (52%) наблюдениях, из которых в 17 – стадия Т3а, в 9 – стадия Т3b, что составило 34 и 18% соответственно (см. таблицу).
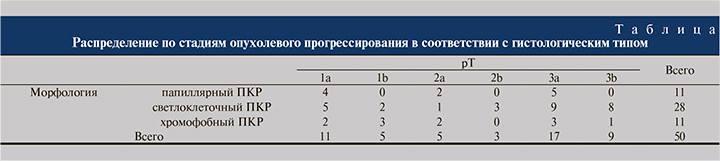
Распределение 39 человек с морфологически верифицированным светлоклеточным и папиллярным ПКР в соответствии с классификацией TNM и принятой градацией степени злокачественности опухоли (WHO) было следующим: светлоклеточный ПКР; стадия рТ1а, градация G1 – 1 (2,56%) пациент, G2 – 3 (7,69%), G3 – 1 (2,56%); стадия рТ1b, градация G3 – 1 (2,56%), G2 – 1 (2,56%); стадия рТ2а, G2 – 1 (2,56%); стадия рТ2b, G3 – 3 (7,69%). Наибольшее число случаев светлоклеточного ПКР пришлось на стадию рТ3 (рТ3а, степень злокачественность G2 – 9 [23%] человек, рТ3b, G2 – 6 [15,38%] и G3 – 2 [5,12%]).
Пациентов с папиллярной формой ПКР оказалось почти в 3 раза меньше, чем со светлоклеточной, поэтому процентное соотношение стадий и степени злокачественности оказалось несколько иным: стадия рТ1а, степень злокачественности G2 выявлена у 4 (10,25%) пациентов; стадия рТ2а, G3 – у 2 (5,12%); стадия рТ3а, G1 – у 1 (2,56%), G2 – у 4 (10,25%).
Низкодифференцированные почечноклеточные опухоли, соответствовавшие градации G4, в исследованном материале не встретились. Градация степени злокачественности для оценки хромофобных карцином не применялась.
У 11 (22%) пациентов обнаружены лимфогенные метастазы и отдаленные гематогенные метастазы в надпочечник, головной мозг, легкие, кости и кожу, при этом диагноз светлоклеточного ПКР был верифицирован в 10 (20%) случаях, а хромофобная почечноклеточная карцинома – лишь в 1 (2%).
Экспрессия CRA. Экспрессия Rec и Arr-1 отмечалась при иммуногистохимическом исследовании всех типов опухолей почки, как злокачественных, так и доброкачественных.
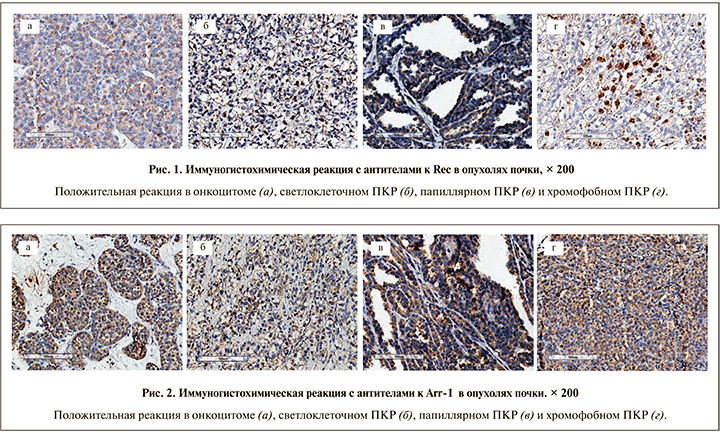
Положительная экспрессия Rec наблюдалась в 71% всех опухолей почки (рис. 1), из них в группе онкоцитом экспрессия Rec наблюдалась в 91,7% случаев (рис. 1а), в группе светлоклеточных (рис. 1б), папиллярных (рис. 1в) и хромофобных (рис. 1г) ПКР аберрантная экспрессия Rec наблюдалась в 71,4%, 72,7 и 45,5% соответственно.
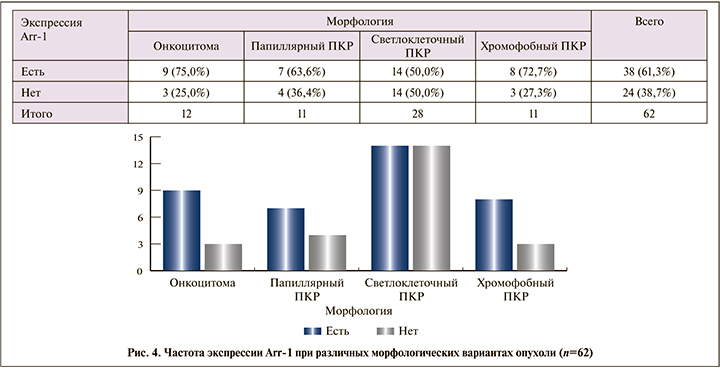
Положительная реакция с антителами к Аrr-1 наблюдалась в 61,3% всех опухолей почки (рис. 2). Количество Arr1-положительных образцов каждого оцениваемого типа опухоли составило 75% в группе с онкоцитом (рис. 2а), 50% в группе светлоклеточных ПКР (рис. 2б), 63,6% для папиллярного ПКР (рис. 2в) и 72,7% для хромофобного ПКР (рис. 2г).
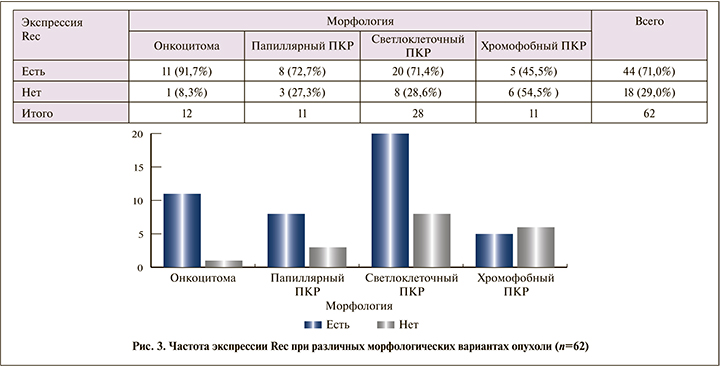
При этом при статистической обработке данных значимых различий частоты экспрессии Rec и Arr-1 в зависимости от морфологии опухоли выявлено не было (р=0,1121 и 0,3784 соответственно) (рис. 3, 4).
При исследовании метастазов ПКР отмечался сходный с первичными опухолями иммуногистохимический профиль.
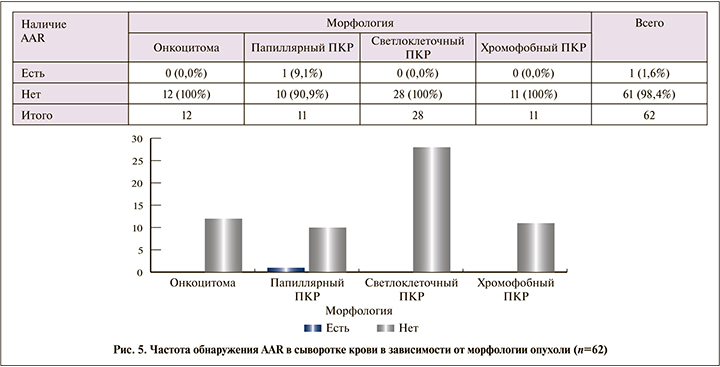
При этом AAR в сыворотке крови обнаружены лишь у 1 (1,6%) пациента с папиллярным ПКР (рис. 5), тогда как AAA-1 – значительно чаще (75,8%) (рис. 6). Частота обнаружения ААА1 в сыворотке крови не зависела от морфологии опухоли (р=0,4098).
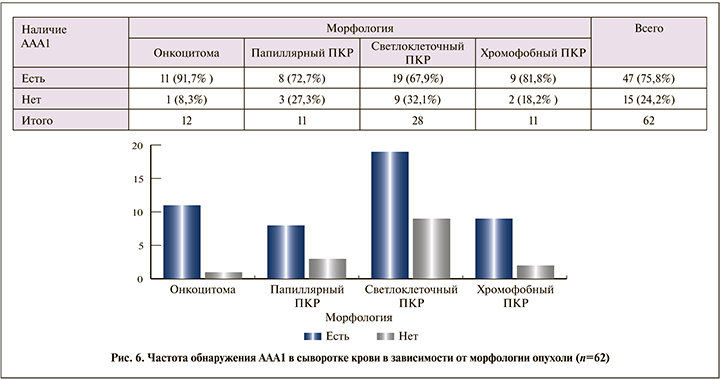
Также стоит отметить, что не у всех пациентов с AAA-1 определялась положительная экспрессия Arr-1 в тканях опухоли, так как при исследовании сыворотки крови проводился качественный анализ на присутствие антител, тогда как при иммуногистохимическом исследовании проводился подсчет окрашенных клеток на 100 клеток опухоли.
Обсуждение. В представленном исследовании изучалась экспрессия CRA у пациентов с различными опухолями почки с целью оценки потенциала использования данных белков в ранней диагностике ПКР. Для этого проводилось иммуногистохимическое исследование образцов опухолей и анализ сыворотки крови на наличие аутоантител против данных белков.
В предыдущей работе [4] у больных раком легких частота обнаружения аутоантител в сыворотке крови находилась на уровне 15% (в случаях мелкоклеточного рака легких) и 20% (в случаях немелкоклеточного рака легких), в то время как позитивная реакция в соответствующих опухолевых тканях наблюдалась в 68 и 85% случаев. В ходе настоящего исследования было установлено, что положительная экспрессия рековерина и Arr-1 встречается как в различных вариантах ПКР, так и в доброкачественных новообразованиях почки. Антитела против рековерина в сыворотке пациентов, страдающих раком почки, определялись довольно редко (1,6%), в то время как антитела против Arr-1 встречались в сыворотке крови значительно чаще (75,8%). Следовательно, установленная в нашем исследовании частота встречаемости экспрессии рековерина и Arr-1 в опухоли аналогична данным предыдущих исследований экспрессии при раке легких [4].
Заключение. При проведенном нами ислледовании выявлено, что в различных подтипах опухолей почек была обнаружена экспрессия Rec и Arr-1 c довольно высокой частотой, колеблющейся в диапазоне от 45 до 92%. В то же время АAR в сыворотке крови определяется не более чем в 1,6% наблюдений, тогда как AAA-1, напротив, довольно часто – 75,8%. Как показала наша работа, обнаружение AAR, в отличие от AAA-1, в сыворотке крови не может расцениваться как маркер опухоли почки, однако высокая экспрессия Rec и Arr-1 в опухолях почки позволяет предположить возможность использования в перспективе данных белков в качестве маркера при диагностике или даже потенциальной мишени для иммунотерапии.



