Введение. Одной из актуальных проблем урологии в мире в настоящее время остаются инфекции нижних мочевыводящих путей (ИНМП) [1–3]. Каждый год к врачу по поводу цистита обращаются более 7 млн женщин. У трети из них в течение 6 мес. развивается рецидив, у половины заболевание переходит в хроническую форму [4, 5]. В 40% случаев цистит встречается у женщин трудоспособного возраста и приводит к утрате трудоспособности, нарушению привычного образа жизни и психоэмоциональным расстройствам, что в свою очередь отражается на состоянии организма в целом [6–10].
Физиологические процессы в организме носят ритмический, циркадный, характер, что является одним из важных механизмов адаптации. Для каждого человека характерен свой график регулярных изменений их характера и интенсивности. Патологические процессы сопровождаются десинхронозом, т.е. рассогласованием ритмов физиологических систем. Диагностика данного состояния позволяет контролировать своевременность активизации процессов адаптации, динамику восстановления функциональных резервов организма и оценивать эффективность проводимой терапии [6, 11, 12].
Лечение инфекционно-воспалительных заболеваний в большинстве случаев требует применения антибактериальных препаратов. Однако их эффективность с каждым годом становится все ниже [13–16]. В первую очередь это связано со свойствами самих микроорганизмов. Возбудители ИНМП способны к адгезии, что позволяет им противостоять току мочи и обеспечивает их способность к колонизации. Кроме того, им свойственны репликация, репродукция в зонтичных клетках эпителия мочевыводящих путей, инвазия в глубокие слои уротелия и образование биопленок [17, 18]. Микробная биопленка – особая экосистема, обеспечивающая жизнеспособность и сохранение составляющих ее видов микроорганизмов, а также увеличение их общей популяции. В ее состав входят отдельные микроколонии бактерий одного или разных родов и видов, внеклеточный матрикс внутри микроколоний и между ними с сетью каналов для движения жидкости и поверхностная оболочка матрикса, содержащая мембраноподобную структуру. Поверхностная оболочка препятствует проникновению антибактериальных препаратов, а компоненты межклеточного матрикса их связывают и инактивируют. Внутри биопленки устойчивые бактерии защищают чувствительные, выделяя ферменты в матрикс, и обмениваются генами антибиотикоустойчивости [19].
С другой стороны, причиной служит нерациональное использование препаратов как врачами, так и пациентами, которое приводит к снижению чувствительности микроорганизмов и селекции резистентных штаммов [13–16]. В этих условиях отсутствие новых групп антибиотиков требует разработки альтернативных схем терапии и методик более эффективного использования уже имеющихся препаратов.
Одним из перспективных направлений лечения ИНМП является системная энзимотерапия, широко применяемая в различных областях медицины [20–25].
Системная энзимотерапия – метод терапевтического воздействия с помощью целенаправленно созданных смесей гидролитических ферментов растительного и животного происхождения, оказывающих кооперативное влияние на ключевые физиологические и патофизиологические процессы в организме [20]. Доказано, что препараты системной энзимотерапии облегчают проникновение антибиотиков в очаг воспаления, а комбинация содержащихся в них протеиназ повышает концентрацию антибиотиков в тканях [22]. Они обладают выраженными противовоспалительным, противоотечным и иммуномодулирующим эффектами, сокращают катаболическую и ускоряют анаболическую (репарационную) фазы воспаления, что позволяет оптимизировать течение воспалительной реакции [21].
Целью исследования было оценить результаты комплексного лечения женщин с хроническим рецидивирующим бактериальным циститом с использованием одного из препаратов системной энзимотерапии.
Материалы и методы. Проведено обследование и лечение 60 женщин в возрасте от 19 до 45 лет с хроническим рецидивирующим бактериальным циститом в стадии обострения.
Пациенты соответствовали следующему критерию исключения: наличие тяжелых сердечно-сосудистых и онкологических заболеваний, сахарного диабета, беременности и лактации, отягощенного аллергологического анамнеза, менструаций в период лечения, гипермобильности уретры, уретрогименальных спаек. Кроме того, в исследование не были включены пациентки с интерстициальным циститом, гиперактивным мочевым пузырем, врожденными аномалиями развития, а также неврологическими состояниями, связанными с повреждением спинного мозга либо с диабетической нейропатией; гинекологическими заболеваниями и гормональными нарушениями.
Методом случайной выборки пациентки были разделены на две группы по 30 человек, сопоставимых по демографическим и клиническим характеристикам. Женщины 1-й группы получали стандартную антибактериальную терапию [1, 2]. При необходимости проводилась ее коррекция по результатам бактериологического исследования мочи с учетом чувствительности микроорганизмов.
Во 2-й группе наряду со стандартной антибактериальной терапией пациенткам назначали препарат системной энзимотерапии флогэнзим («MucosPharma», Германия) по 3 таблетки 3 раза в день за 30 мин до еды, запивая 1 стаканом воды, в течение 14 дней. Одна таблетка флогэнзима содержит бромелаин 450 F.I.P.-ЕД (90 мг), трипсин 1440 F.I.P.-ЕД (48 мг), рутозид 100 мг [26].
Проводили сбор анамнеза заболевания и жизни, физикальное обследование. Все пациентки ежедневно заполняли дневники мочеиспускания, по данным которых оценивали количество мочеиспусканий в сутки, количество императивных позывов, а также ночных мочеиспусканий. Для оценки интенсивности резей при мочеиспускании использовали 5-балльную вербальную шкалу оценки боли [27].
Кроме того, у каждой пациентки ежедневно регистрировали хроноритм. Под хроноритмом в данном исследовании подразумевали зависимость интегрального показателя здоровья H(Т) от времени суток Т. При этом суточный прогноз включает три зоны функциональных состояний. Первая зона, 100–75%, – «физиологическая норма», нормальный уровень функционирования систем регуляции организма; вторая зона, 75–25%, – «преморбидное состояние», выраженное нарушение регуляторных механизмов; третья зона, 25–0%, – «срыв адаптации», истощение механизмов регуляции.
Лабораторный мониторинг включил общие анализы крови и мочи, бактериологическое исследование проб мочи с посевом урокультуры на твердые питательные среды, установлением вида возбудителей, чувствительности к антибиотикам и степени бактериурии, а также иммуноферментный анализ крови с определением уровней С-реактивного белка (СРБ), IL-6, IL-1β, ФНОα (иммуноферментный анализ крови проводился на анализаторе «SUNRISE-BASIC TECAN» [Tecan Austria] с использованием наборов для твердофазного иммуноферментного анализа «Вектор-Бест», Россия). Исследования в указанном объеме проводили на 1-е, 7-е и 14-е сутки лечения.
Через 6 мес. после окончания курса терапии в обеих группах оценивали частоту рецидивов хронического цистита за указанный период.
Статистическую обработку результатов проводили с помощью программы MSExel 11.0 из стандартного пакета MS Office 2013, а также программного обеспечения IBM SPSS Statistics 21.0. При проверке статистических гипотез применяли критерий t-test Cтьюдента и критерий χ2. При оценке достоверности выявленных различий между средними значениями выборок рассчитывали параметр р, вероятность справедливости нулевой гипотезы была принята равной 5% (р<0,05).
Результаты. При анализе хронограмм в 1-е сутки у всех пациенток выявлены признаки десинхроноза. В 1-й группе в 25 (83,3%) случаях кривые хроноритмов располагались в третьей зоне, в 5 (16,7%) – во второй. Во 2-й группе хронограммы в третьей и второй зонах регистрировали у 26 (86,7%) и 4 (13,3%) женщин соответственно.
К 7-м суткам терапии в 1-й группе у 8 (26,7%) пациенток была отмечена нормализация хроноритмов, у 15 (50%) и 7 (23,3%) графики хроноритмов располагались во второй и в третьей зонах соответственно. Во 2-й группе у 14 (46,7%) женщин хроноритмы располагались в первой зоне (норма), у 14 (46,7%) – во второй, у 2 (6,7%) – в третьей.
К 14-м суткам у всех 30 (100%) пациенток 2-й группы хронограммы располагались в первой зоне, тогда как в 1-й группе десинхроноз сохранялся в 10 (33,3) случаях – хронограммы были расположены во второй зоне.
Результаты клинико-лабораторных исследований и иммуноферментного анализа крови представлены в табл. 1, 2.
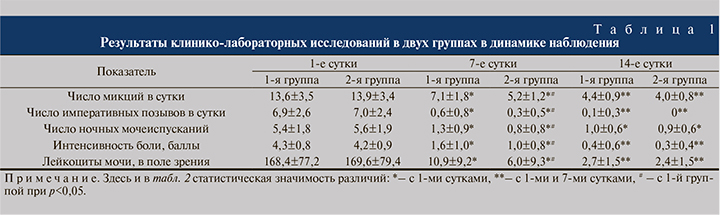
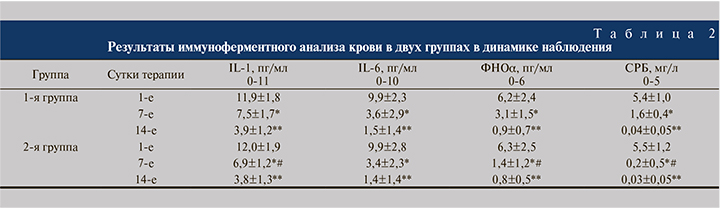
В 1-е сутки у пациенток обеих групп имелись признаки обострения хронического цистита, такие как учащенное мочеиспускание с резями, императивные позывы, ноктурия, лейкоцитурия, а также повышение уровня СРБ и незначительное повышение уровня провоспалительных цитокинов в крови.
Динамика изученных показателей, которые достигли нормальных значений к концу курса терапии в обеих группах, свидетельствует об эффективности лечения. Однако более выраженное снижение частоты мочеиспускания, императивных позывов, ноктурии, а также уменьшение воспалительных изменений в крови и моче к 7-м суткам терапии позволяют говорить о более быстром купировании воспалительного процесса у пациенток, получавших системную энзимотерапию.
Исходно в бактериальном посеве мочи пациенток 1-й группы E. coli оказалась возбудителем в 17 (56,7%) случаях, St. saprophiticus – в 6 (20%), Enterococcus faecalis – в 4 (13,3%), а Klеbsiella spp. – в 3 (10%). Во 2-й группе E. coli была выявлена у 18 (60%) пациенток, St. saprophiticus – у 7 (23,3%), Enterococcus faecalis – у 4 (13,3%) и Klеbsiella spp. – у 1 (3,3%). Все возбудители были чувствительными к фосфомицину, нитрофурантоину, левофлоксацину и клавулановой кислоте.
К 7-м суткам E. coli в пробах мочи в 1-й группе выделена у 2 (6,7%) пациенток, тогда как во 2-й группе эрадикации возбудителя удалось добиться в 100% наблюдений. На 14-е сутки посевы мочи в обеих группах оказались стерильными. Нежелательных явлений и случаев отказа от предложенного лечения не было.
В ходе дальнейшего 6-месячного наблюдения рецидивы заболевания выявлены у 9 (30%) пациенток 1-й группы и у 4 (13,3%) –2-й. Полученные различия были статистически значимыми (p<0,05).
Обсуждение. Лечебное действие системной энзимотерапии реализуется через влияние на воспалительный процесс, иммунитет, сосудисто-тромбоцитарный гемостаз [23, 25, 28, 29].
Препараты данной группы модулируют активность ряда провоспалительных цитокинов, таких как IL-1β, ФНОα, IL-6, IL-8 и др., играющих важную роль в патогенезе воспалительных заболеваний [30, 31]. Индуцируемый цитокинами иммунный ответ во многом зависит от рецепторного аппарата клеток-мишеней, при этом уменьшение количества рецепторов на клеточной мембране резко снижает или отменяет специфическое действие интерлейкинов [32]. Энзимы способны подавлять экспрессию цитокиновых рецепторов на «клетках-мишенях» и поддерживать их оптимальную концентрацию, что служит одним из регуляторных механизмов, препятствующих чрезмерной реализации провоспалительных эффектов цитокинов на системном уровне [33]. Это соответствует полученным в ходе исследования данным, согласно которым в группе пациенток, получавших системную энзимотерапию, к 7-м суткам терапии была выявлена достоверно (p<0,05) более выраженная динамика снижения уровня IL-6, IL-1β, ФНОα и СРБ.
При воспалительном процессе энзимокомплексы уменьшают инфильтрацию интерстиция и способствуют утилизации продуктов воспаления, одновременно повышая снабжение тканей кислородом и питательными веществами за счет улучшения пластических свойств эритроцитов и снижения агрегации тромбоцитов [23–25]. Данные эффекты системной энзимотерапии позволяют в более короткие сроки уменьшать выраженность местных воспалительных явлений и как следствие – клинических симптомов заболевания. Это подтверждается результатами проведенного нами исследования, в ходе которого отмечена более быстрая динамика купирования дизурии и лейкоцитурии у пациенток, получавших флогэнзим. Кроме того, в данной группе отмечено более значимое уменьшение выраженности болевых ощущений по сравнению с 1-й группой к 7-м суткам лечения. На наш взгляд, это может быть связано с вторичным анальгетическим действием энзимов, которое реализуется через прямое влияние на протеолиз медиаторов воспаления и косвенное влияние в виде уменьшения онкотического давления, отека тканей и сдавления нервных окончаний, а также устранения ишемии за счет нормализации микроциркуляции [20, 21].
Недостаточная эффективность антибактериальной терапии, резистентные штаммы микроорганизмов и формирование биопленок остаются основной причиной развития рецидивов ИНМП [16–18]. Препараты системной энзимотерапии обладают бустер-эффектом в отношении антибиотиков. Они улучшают условия их доставки в очаг инфекции за счет повышения всасывания, нормализации микроциркуляции, конкурентного взаимодействия с транспортными белками крови, усиления некролиза и расщепления детрита, а также эффекта очищения клеточной мембраны как клетки-хозяина (носителя), так и возбудителя, что увеличивает их проницаемость [20, 23]. Кроме того, снижается кислотность среды в очаге воспаления, что улучшает условия для работы противомикробных препаратов [24]. Под действием средств системной энзимотерапии формируются «дефектные» штаммы и пленки, при этом антибиотики начинают лучше проникать в биопленки. На этом фоне частота передачи плазмидных генов антибиотикоустойчивости в бактериальных биопленках снижается в 2 раза [19]. Указанные механизмы позволяют рассматривать системную энзимотерапию как эффективное средство профилактики рецидивов хронического цистита, что подтверждается меньшим числом рецидивов в группе пациенток, получавших комбинированную терапию с флогэнзимом, в течение 6 мес. наблюдения.
Заключение. Результаты исследования продемонстрировали высокую эффективность системной энзимотерапии, применение которой в составе комплексного лечения позволяет ускорить купирование дизурии и болевых ощущений, а также уменьшить число рецидивов заболевания у женщин с хроническим рецидивирующим бактериальным циститом. Считаем патогенетически обоснованным и оправданным применение препаратов системной энзимотерапии, в частности флогэнзима, в лечении данной категории пациенток.



