Введение. Инфекции мочевыводящих путей (ИМП) остаются важной проблемой современной урологии в силу высокой распространенности и тенденции к рецидивирующему течению [1]. Рост резистентности патогенной микрофлоры, появление штаммов E. coli, способных к внутриклеточной персистенции, повышенная адгезия возбудителя к уротелию, рост числа сопутствующих заболеваний – все это создает предпосылки к развитию хронического рецидивирующего течения цистита с частыми обострениями [2, 3–5]. В современной урологии все более популярны отказ от назначения антибиотиков при лечении больных острым неосложненным циститом [6–8] или, напротив, тенденция назначения комбинированной антибактериальной терапии [9–10]. По своей сути комбинированная противомикробная терапия является возвращением к истокам антибактериального лечения инфекции мочевыводящих путей: вспомним классическую схему О.Л. Тиктинского [11]: назначение одновременно двух антибактериальных препаратов в качестве эмпирической терапии позволяет с большей надежностью перекрывать спектр уропатогенов и их резистентность. Например, во фтизиатрии всеми отечественными и международными руководствами предписывается проведение начального интенсивного курса лечения комбинацией не менее чем четырех препаратов [12–14].
Но и самые эффективные антибиотики могут не дать желаемого результата без дополнительной патогенетической терапии, которая включает фитотерапию, неспецифические противовоспалительные средства, препараты, направленные на улучшение микроциркуляции и антимикробные пептиды (AMП). Роль АМП в комплексной терапии ИМП высока. По сравнению с эмпирическими антибиотиками они не вызывают развития резистентности уропатогена, бактерицидны, проявляют активность широкого спектра и влияют на штаммы с множественной лекарственной устойчивостью. Экспериментальные данные показывают, что АМП обладают активностью даже в отношении высокорезистентных патогенов [15–16]. Неспособность микроорганизмов вырабатывать устойчивость к большинству противомикробных пептидов особенно важна в эру растущей резистентности патогенов [17]. АМП потенциально могут выступать в качестве альтернативы обычным антибиотикам [18–20].
АМП представляют собой соединения, продуцируемые всеми прокариотическими и эукариотическими клетками, – это низкомолекулярные белки с широким спектром антимикробной активности в отношении грамположительных и грамотрицательных бактерий, вирусов и грибов [21–25]. В настоящее время обнаружено более 3100 природных АМП [26]. АМП являются важным эффектором врожденной иммунной системы и первой линией защиты от патогенной инфекции [27].
К положительным свойствам АМП относят также минимальное взаимодействие с лекарственными средствами и низкую токсичность. АМП препятствуют образованию биопленок широкого спектра и способны благоприятно модулировать иммунный ответ хозяина [28].
На рынок уже поступило более 60 пептидных препаратов, и несколько сотен новых терапевтических пептидов находятся в доклинических и клинических исследованиях [29].
В борьбе с инфекцией принимают участие и цитокины (ЦК) – собирательное название белковых полипептидных гормоноподобных модуляторов, продуцируемых клетками иммунной системы. ЦК являются межклеточными медиаторами; их основная роль – передача информации о вторжении патогенов. Для этого ЦК связывается с рецептором, от поверхности клетки к ядру передает соответствующий сигнал, активирующий экспрессию определенных генов; последовательно запускаются синтез белков, секреция различных защитных молекул; возникают каскадные реакции иммунного ответа. Цитокины инициируют секрецию гистамина, лизоцима, С-реактивного белка, интерферонов, интерлейкинов и других биологически активных веществ. В зависимости от продуцентов и биологических эффектов ЦК подразделяют на группы (классы): интерфероны, интерлейкины (ИЛ), колониестимулирующие факторы, факторы некроза опухоли (ФНО) и др. Описаны и выделены более 60 цитокинов.
Отечественный препарат Суперлимф® представляет собой естественный комплекс природных антимикробных пептидов и цитокинов – универсальных стимуляторов иммунной системы, секретируемых лейкоцитами периферической крови свиней. Суперлимф, согласно инструкции, обладает противовирусным, противомикробным и фунгицидным действиями, а также является иммуномодулятором. Препарат стимулирует функциональную активность клеток фагоцитарного ряда (моноцитов и нейтрофилов): активирует фагоцитоз, выработку цитокинов (ИЛ-1, ФНО), индуцирует противоопухолевую цитотоксичность макрофагов, способствует гибели внутриклеточных паразитов, регулирует миграцию клеток в очаг воспаления, увеличивает активность естественных киллеров. Препарат обладает антиоксидантной активностью, снижает развитие воспалительных реакций, стимулирует регенерацию и эпителизацию раневых дефектов.
Цель исследования: определить эффективность этиопатогенетической терапии, включающей ректальные суппозитории Суперлимф® в дозе 10 и 25 ЕД больным хроническим циститом.
Материалы и методы. В проспективное многоцентровое рандомизированное сравнительное контролируемое исследование была включена 91 пациентка.
Критерии включения:
- • Женский пол.
- • Возраст 18–50 лет.
- • Повторяющиеся, не реже чем 2 раза в полгода или 3раза в год эпизоды цистита в течение 2 лет и более.
1. Лейкоцитурия не менее 10 клеток в поле зрения.
2. Число баллов по шкале симптомов острого цистита Acute Cystitis Symptom Score (ACSS) 6 и более.
3. Согласие участвовать в исследовании. Критерии исключения:
1. Менопауза/постменопауза.
2. Соматические заболевания в стадии декомпенсации.
3. Острый геморрой.
4. Признаки пиелонефрита (более 1 балла по домену «differential – отличительные признаки» шкалы симптомов острого цистита ACSS; температура тела – 37,50оС и выше, боль в поясничной области, положительный симптом Пастернацкого).
5. Любые острые инфекции в момент включения в исследования (или обострение хронических).
Критерии невключения:
1. Аутоиммунные заболевания.
2. Злокачественные заболевания любой локализации.
3. Тяжелые аллергические реакции, в том числе в прошлом.
4. Повышенная чувствительность к компонентам препарата, включая белки свиного происхождения.
5. Беременность/лактация.
6. Наркомания/алкоголизм.
7. Психические заболевания.
8. Аномалии развития нижних мочевыводящих путей.
9. Прием антибиотиков по любому поводу в течение 1 мес., предшествовавшего включению в исследование.
10. Проведение какого-либо лечения по поводу настоящего обострения хронического цистита.
Пациентки были рандомизированы в три группы:
- • Группа сравнения ГС-1 – 32 человека, получали базовую терапию в течение 5 дней;
- • 2-я группа сравнения ГС-2 – 28 человек, получали базовую терапию плюс ректальные суппозитории Суперлимф® 25 ЕД 1 раз в день в течение 10 дней;
- • Основная группа ОГ – 31 человек, получал базовую терапию плюс ректальные суппозитории Суперлимф® 10 ЕД 1 раз в день в течение 20 дней.
В качестве базовой терапии всем назначали комбинацию двух антимикробных препаратов: фосфомицина трометамол 3,0 г на ночь однократно в первый день терапии, и фуразидин по 100 мг трижды в день после еды в течение 5 дней. Патогенетическое лечение в ГС-1 не проводилось, в ГС-2 длилось 10, в ОГ – 20 дней. Эффективность комбинированной антибактериальной терапии оценивалась во всех группах по ее завершении через 5 дней. Конечная первичная эффективность оценивалась соответственно в ГС-1 через 5 дней, в ГС-2 – через 10, и в ОГ – через 20 дней от начала терапии.
Назначение лечения и контроль его эффективности осуществляли на последовательных визитах.
0/1 визит – скрининг/включение. На этом визите выполняли антропометрические измерения, проводили анализ жалоб, изучали anamnesis morbi et vitae, выполняли исследование на гинекологическом кресле; мочу направляли на общий анализ и бактериологическое исследование на неспецифическую микрофлору с определением чувствительности выделенного патогена к антимикробным препаратам. Пациенткам предлагали самостоятельно ответить на вопросы русскоязычной версии шкалы симптомов острого цистита Acute Cystitis Symptom Score (ACSS); анкеты анализировались исследователем непосредственно на визите. В рамках исследования проводили анализы мазка из уретры и цервикального канала методом полимеразной цепной реакции (ПЦР) для выявления возбудителей инфекций, передаваемых половым путем (ИППП).
При соответствии критериям включения и отсутствия критериев невключения выполняли измерение локальной микроциркуляции посредством лазерной допплерфлоуметрии (ЛДФ) в области наружного отверстия уретры и на уровне середины уретры со стороны влагалища при помощи прибора ЛАКК-02 (НПП «Лазма», Россия). С целью повышения точности исследования световод в момент измерения закрепляли в штативе Бунзена. После этого назначали базовую терапию и рандомно распределяли пациентку в одну из групп.
На 2-й визит пациентки всех трех групп приходили через 5 дней, по завершении комбинированной антибактериальной терапии для оценки ее эффективности.
На 3-й визит приходили пациентки ГС-2, получавшие наряду с комбинированной антибактериальной терапией патогенетическое лечение при помощи ректальных суппозиториев, содержавших по 25 ЕД Суперлимф® № 10 – через 10 дней для оценки непосредственной эффективности комплексного этиопатогенетического лечения.
На 4-й визит приходили пациентки ОГ, получавшие наряду с комбинированной антибактериальной терапией патогенетическое лечение при помощи ректальных суппозиториев, содержавших по 10 ЕД Суперлимф® № 20 – через 20 дней для оценки непосредственной эффективности комплексного этиопатогенетического лечения.
Таким образом, состав и продолжительность комбинированной антибактериальной терапии во всех трех группах были идентичными, а доза и продолжительность патогенетической терапии в ГС-2 и ОГ различались.
Первичными критериями эффективности служили:
- • Доля пациенток с отсутствием лейкоцитурии и бактериурии в контрольных анализах;
- • Динамика количества баллов по шкале симптомов. Вторичные критерии эффективности:
- • Сроки исчезновения бактериурии;
- • Сроки нормализации лейкоцитурии;
- • Сроки прекращения дизурии;
- • Улучшение локальной микроциркуляции.
Безопасность и переносимость комбинированной терапии оценивали по частоте и степени тяжести нежелательных явлений и серьезных нежелательных явлений, причинам досрочного прекращения участия в исследовании.
Статистический анализ. Результаты исследования были обработаны с использованием электронных таблиц Microsoft Excel из пакета программ Microsoft Office, 2007. Все количественные данные описывались как среднее (М)±стандартное отклонение (SD). При описании качественных данных использовали абсолютные значения (n) и проценты (%). Также для определения статистической значимости различий использовали метод Вилкоксона, Манна–Уитни с коррекцией Бонферрони, корреляцию вычисляли методом Спирмена.
Результаты. Пациентки наблюдались по поводу хронического цистита в среднем в течение 7,1±4,2 года (колебания от 2 до 24 лет), все неоднократно получали антимикробную терапию.
Поводом для обращения к врачу у всех женщин была дизурия, 14 (15,4%) пациенток также отмечали терминальную гематурию. При осмотре на гинекологическом кресле признаков кольпита или аномального расположения наружного отверстия уретры не выявлено ни в одном случае.
Напервомвизитеувсехпациентокбылавыявленалейкоцитурия. При микробиологическом исследовании у всех получен рост патогенной микрофлоры в титре 103–107 КОЕ/мл. Спектр уропатогенов представлен в табл. 1.

Следует отметить, что наиболее часто выявляемым в исследовании возбудителем была E. coli, что согласуется с данными большинства отечественных и международных исследований, но спектр микроорганизмов был достаточно широк. Резистентность к тем или иным антибиотикам отмечена у всех изолятов, ни один штамм не обладал полной чувствительностью, однако устойчивость к фосфомицину и нитрофурантоину не была выявлена ни в одном случае.
Рис. 1 демонстрирует идентичность исследуемых групп до начала терапии.

Как следует из рис. 1, на момент включения в исследование ни баллы по типичным жалобам, ни баллы по качеству жизни, ни, соответственно, сумма баллов существенных различий между группами не имели.
Во всех группах пациенток по завершении этиотропного лечения отмечен статистически значимый эффект, что показано в табл. 2. Отмечено статистически значимое превосходство результатов лечения пациенток, получавших ректальные суппозитории Суперлимф®. Вместе с тем достоверных различий между ГС-2, где доза Суперлимф® была 25 ЕД, и ОГ, в которой доза Суперлимф® была 10 ЕД, не обнаружено. При сопоставлении данных обследования на последнем визите установлено, что эрадикация возбудителя достигнута у всех пациенток во всех трех группах, что показано в табл. 3. Однако нормализация анализов мочи к моменту финального визита наступила у всех пациенток только в ОГ, а в ГС-1 у двух больных сохранялась незначительная лейкоцитурия (8–12 клеток в поле зрения), как и у одной пациентки в ГС-2.
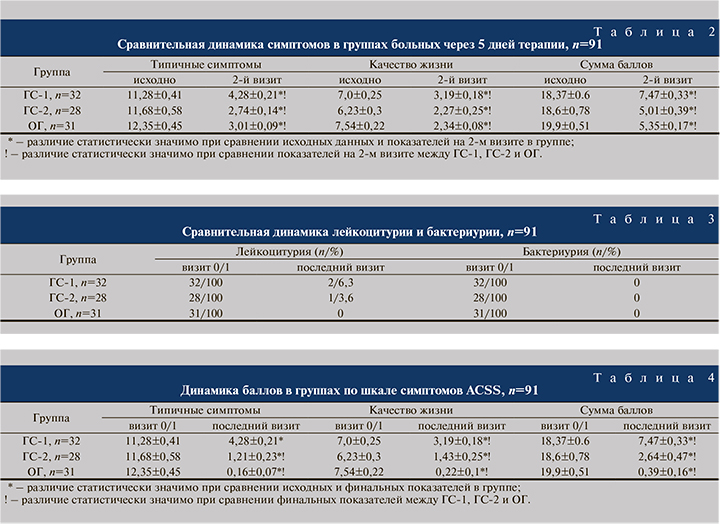
При оценке субъективных признаков видно безусловное преимущество этиопатогенетической терапии, включившей суппозитории Суперлимф® по 10 ЕД в течение 20 дней. Сравнительная динамика баллов по шкале симптомов острого цистита представлена в табл. 4.
Как следует из табл. 4, в среднем и балльное выражение типичных симптомов и балльное выражение качества жизни, соответственно, сумма баллов по окончании лечения статистически значимо уменьшились. Однако если в группе пациенток, получавших только антибактериальную терапию, баллы уменьшились в 2,6–2,2–2,5 раза, то в ГС-1 отмечена более выраженная динамика: снижение симптоматики и улучшение качества жизни произошло в среднем в 9,6–4,4–7,0 раз. В ОГ наблюдалась наиболее выраженная положительная динамика по шкале симптомов острого цистита; среднее количество баллов по домену «Typical» (типичные симптомы) уменьшилось в 77 раз, т.е. практически у всех пациенток, несмотря на многолетний анамнез, полностью прекратились симптомы цистита. Это сказалось и на качестве жизни: среднее число баллов по этому домену снизилось в 34 раза.
На заключительном визите по завершении этиотропного лечения в ГС-1 и по завершении этиопатогенетического лечения в группах ГС-2 и ОГ выявлены статистически значимые различия (р=0,0001), что наглядно демонстрирует рис. 2.
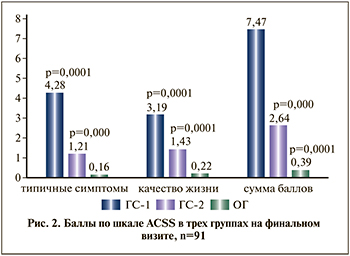
Как следует из рис. 2, несмотря на нормализацию объективных лабораторных и микробиологических показателей, субъективно не все пациентки чувствовали себя абсолютно здоровыми, у некоторых сохранялись дискомфорт при наполнении мочевого пузыря, неприятные ощущения при мочеиспускании, и они расценивали это как факторы, существенно снижающие качество их жизни. Тем не менее частота и выраженность симптомов цистита по завершении этиопатогенетической терапии в ОГ были высоко статистически значимо менее выражены, чем в группах сравнения (р=0,0001), а также обнаружено статистически значимое различие между ГС-1 и ГС-2 (р=0,0001). Сравнительная динамика баллов показана в табл. 5.
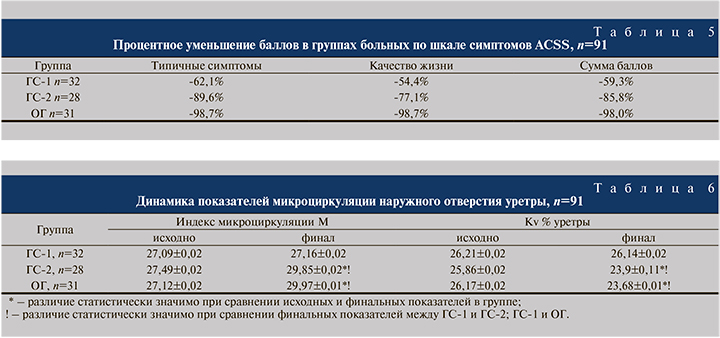
Мы полагаем, что более высокая эффективность комбинированной терапии в группах, получавших патогенетическую терапию посредством ректальных суппозиториев Суперлимф®, в немалой степени обусловлена локальным улучшением микроциркуляции. Повторные измерения микроциркуляции методом ЛДФ подтвердили это предположение. В табл. 6 показана динамика индекса микроциркуляции (ИМ) в области наружного отверстия уретры на фоне лечения и изменение в процессе лечения коэффициент вариации Kv.
Как следует из табл. 6, применение пептидно-цитокиновой терапии статистически значимо улучшило показатели микроциркуляции в области уретры, однако между ГС-2 и ОГ различий установлено не было, т.е. доза и продолжительность применения Суперлимф® не влияют на уровень локальной микроциркуляции.
При сравнительной оценке уровня микроциркуляции уретры через стенку влагалища мы также не нашли различий между группами пациенток, получавших Суперлимф® (ГС-2 и ОГ), однако в обеих группах зафиксировано статистически значимое усиление микроциркуляции по сравнению с ГС-1, получавшей только этиотропную терапию (табл. 7).
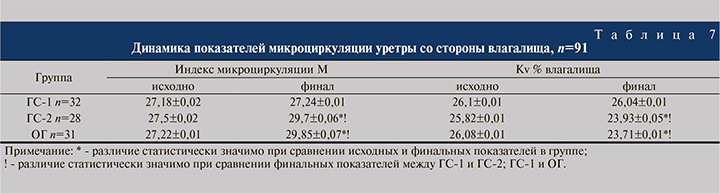
Повторное измерение уровня микроциркуляции в средней части уретры со стороны влагалища также показало улучшение этого параметра у пациенток, в комплекс лечения которых входил Суперлимф®.
Обсуждение. Поскольку бактериальный цистит вызывается микробной флорой, во главе угла стоит этиотропная терапия. Российские клинические рекомендации и Европейские гайдлайны предписывают начинать лечение с фосфомицина или нитрофуранов, как альтернативный выбор указаны цефалоспорины [30–31]. Казалось бы, чувствительность E. сoli к фосфомицину и нитрофуранам приближается к 100% – почему же частота рецидивов столь удручающе высока?
Во-первых, меняется спектр уропатогенов при цистите. Наряду с традиционно общепризнанной E. сoli на сцену выходят клебсиеллы, ацинетобактер, энтерококки и стафилококки, коринебактерии и ряд других микроорганизмов, а также вирусов [32–34]. Во-вторых, меняются характеристики патогенов, многие из них в процессе эволюции приобрели способность к адгезии к клеткам уротелия и к внутриклеточной персистенции. И безусловно, решающее значение имеет резистентность микроорганизмов. Устойчивость к противомикробным препаратам служит второй по величине причиной смерти в мире. И грамположительные, и грамотрицательные бактерии становятся невосприимчивыми к существующему арсеналу противомикробных препаратов. Лечение бактериальных инфекций, вызванных штаммами с множественной лекарственной устойчивостью, включая устойчивые к ванкомицину Enterococcus faecium, Enterobacter cloacae, штаммы с широкой лекарственной устойчивостью, включая устойчивые к карбапенемам Acinetobacter baumannii, и устойчивые к цефалоспоринам третьего поколения E. coli, продуцирующие β-лактамазу Klebsiella pneumonia, стало довольно сложно [5]. За последние два десятилетия на рынок для клинического применения поступило всего несколько новых антибактериальных препаратов: линезолид, баптомицин и бедаквилин [22]. Y. Luo, Y. Song [36] считают, что эпоха антибиотиков заканчивается и наступает эра «постантибиотиков», что означает необходимость поиска методов воздействия на лекарственно-устойчивые бактерии иным способом, без применения антибиотиков [36].
Фосфомицин и нитрофураны как монотерапия являются препаратами первого выбора при неосложненном цистите – когда небеременная женщина впервые встретилась с инфекцией, поразившей слизистую ее мочевого пузыря. Безусловно, в такой ситуации достаточно одного антибактериального препарата коротким курсом. Однако в случае развития хронического цистита, который вызывается реинфекцией и суперинфекцией, когда эволюция основного уропатогена E. coli создала возможность формирования биопленок и внутриклеточной персистенции возбудителя, монотерапии, с нашей точки зрения, будет недостаточно. Одновременный прием однократно 3,0 г фосфомицина трометамола и продолжающийся в течение 5 дней прием фуразидина в качестве эмпирической терапии, по нашему мнению, имеют ряд преимуществ: во-первых, перекрывает весь спектр уропатогенов, во-вторых, перекрывает потенциально возможную резистентность возбудителя у больных хроническим циститом, уже получавшим много курсов антибактериальной терапии, в-третьих, действует на патоген с разных позиций, что минимизирует риск образования биопленки и ухода возбудителя в состояние персистенции. Все пациентки, вошедшие в исследование, ранее получали монотерапию фосфомицина трометамолом или фуразидином, тем не менее,у данных больных цистит приобрел хроническое рецидивирующее течение. Именно это побудило нас к поиску альтернативных подходов к терапии, примененных нами в данном исследовании.
Неудовлетворенность результатами антибактериальной монотерапии заставляет все большее число исследователей активно применять патогенетическую терапию, дополняя, а в ряде случаев и заменяя ею антибиотики [37]. А. Н Джалилова и соавт. [38] полагают, что использование препаратов, обладающих полимодальным действием (авторы назначали азоксимера бромид), повышает клинико-микробиологическую эффективность комплексной антибактериальной терапии, поскольку эти препараты усиливают противовоспалительный эффект антибиотиков.
Описан опыт применения Суперлимф® в лечении больных хроническим циститом. И. А. Аполихина и соавт. [39] наблюдали 60 женщин, больных циститом, в возрасте в среднем 34,7 года. Все пациентки получали фосфомицина трометамол 3,0 однократно. Тридцать пациенток дополнительно применяли ректально Суперлимф® по 1 суппозиторию (25 ЕД) в день в течение 10 дней с начала терапии; курс повторяли через месяц. Оценку результатов проводили при помощи дневника мочеиспускания и шкалы симптомов острого цистита (ACSS). Авторы нашли, что пациентки, получавшие комплексное лечение (антибактериальная терапия+Суперлимф®), показали лучшие результаты (повышение эффективности лечения в 2,6 раза, удлинение ремиссии между обострениями в среднем на 30,3±5,9 дня, более быстрое и выраженное улучшение качества жизни) [39].
В исследовании А. С. Саидовой и соавт. [40] определен уровень экспрессии гена провоспалительного цитокина TNFa у женщин, больных хроническим циститом, получавших Суперлимф®. Статистически значимое снижение уровня TNFa на фоне применения ректальных суппозиториев Суперлимф® в дозе 25 ЕД свидетельствует об уменьшении воспалительной реакции и наступлении фазы реконвалесценции, что подтверждает иммунорегуляторное действие препарата.
Заключение. Этиопатогенетическая терапия, включающая ректальные суппозитории Суперлимф® в дозе 10 и 25 ЕД больным хроническим циститом, позволяет достоверно улучшать результаты комбинированной терапии. Анализ шкалы симптомов острого цистита показал преимущество более длительного применения ректальных суппозиториев Суперлимф® в сниженной дозировке (10ЕД). Пептидноцитокиновая терапия привела к достоверному улучшению локальной микроциркуляции в ГС-2 и ОГ.



