Введение. В настоящее время проблема бесплодия затрагивает около 15,0% супружеских пар в мире, при этом каждая восьмая пара репродуктивного возраста сталкивается с ней при планировании первого ребенка [1–3]. У половины бездетных пар бесплодие связано с «мужским фактором», проявляющимся различными видами патоспермии [4]. Проблема мужской инфертильности мультифакторна [2, 5]. В последние годы активно обсуждается вопрос причастности вирусов, в частности вируса папилломы человека (ВПЧ), к развитию данного состояния [6, 7].
Заболевания, ассоциированные с ВПЧ, чаще передаются половым путем [7, 8]. В настоящее время известно более 200 различных генотипов ВПЧ, которые были разделены на группы низкого или высокого риска в соответствии с онкогенным потенциалом [9–11].
Долгие годы считалось, что ВПЧ с низким онкогенным потенциалом причастен к различным заболеваниям кожных покровов и слизистых оболочек, тогда как ВПЧ с высоким онкогенным потенциалом ассоциировался с онкологическими заболеваниями мочевыводящих путей и репродуктивных органов как у мужчин, так и у женщин [12]. В большинстве случаев папилломавирусная инфекция (ПВИ) устраняется иммунной системой в течение 12–24 мес., что позволяет избегать каких-либо клинических исходов. Вместе с тем неспособность иммунной системы элиминировать вирус приводит к установлению персистирующего течения ПВИ и вызывает ряд состояний, о которых сказано выше [12, 13].
Однако в недавнем исследовании G. Capra и соавт. (2022) [13] указано, что к развитию инфекционно-воспалительных заболеваний уретры, мочевого пузыря, простаты и яичек причастен ВПЧ как с высоким, так и с низким патогенным потенциалом. Также ВПЧ (особенно высокого онкогенного риска) может влиять на репродуктивное здоровье и фертильность как женщин, так и мужчин и пары в целом [13, 14].
Инфицирование ВПЧ способствует развитию неблагоприятных патологических состояний: снижению мужской фертильности, характеризующейся качественными и количественными изменениями эякулята, нарушению фертильности пары с усилением апоптозабластоцисты и уменьшением имплантации в эндометрий трофобластических клеток, пороками развития зародышей и плодов с увеличением числа самопроизвольных абортов и самопроизвольных преждевременных родов [14].
За последние годы все большее внимание уделяется пониманию того, как инфицирование мужчин ВПЧ может влиять на ухудшение качества спермы и отрицательные исходы беременности. Однако данные по этому вопросу малочисленны и противоречивы. Известно, что ВПЧ с одной стороны, оказывает непосредственное патогенное действие, вызывая генетическую нестабильность/повреждение ДНК сперматозоидов, с другой, – ингибируя иммунокомпетентную составляющую репродуктивной системы, активизирует аутоиммунные процессы в тестикулах, в том числе и запуск цитокиногенеза, вследствие чего происходит усугубление сперматогенеза в целом [15].
Поэтому необходимо не только выявлять вирусы в эякуляте, но и изучать их негативное воздействие на сперматозоиды.
Цель исследования: изучить роль электронной микроскопии эякулята в диагностике инфертильности, ассоциированной с папилломовирусной инфекцией.
Материалы и методы. Проведен анализ результатов электронно-микроскопического исследования эякулята у 51 пациента в возрасте от 22 до 40 лет (средний возраст – 32,3±6,4) с диагнозом «бесплодие» и патоспермией, сочетающейся с ПВИ, но с отсутствием других факторов риска.
Критерии включения в исследование: возраст старше 18 лет, диагноз «бесплодие», установленный на основании неспособности здоровой партнерши забеременеть в течение 1 года при регулярном сексе без контрацепции, положительный результат полимеразной цепной реакции (ПЦР) на ВПЧ, согласие пациентов на участие в исследовании.
Критерии невключения в исследование: другие заболевания, передаваемые половым путем (ЗППП), инфекционно-воспалительные заболевания репродуктивных органов бактериальной этиологии (простатит, везикулит, орхит, уретрит), инфравезикальная обструкция (стриктура уретры, нейрогенная дисфункция нижних мочевыводящих путей и др.), сопутствующие сердечно-сосудистые, неврологические, эндокринные, системные и другие заболевания, онкологические заболевания в настоящее время или в анамнезе, гормональные нарушения со стороны репродуктивной системы, аномалии со стороны мочевыводящих путей и репродуктивных органов, любое иммунодефицитное состояние.
Материалом для исследования служил эякулят. Образцы эякулята были собраны в специальный стерильный контейнер путем мастурбации после рекомендуемого периода полового воздержания в течение 3–4 дней с учетом всех рекомендаций по подготовке пациента к исследованию. После разжижения при комнатной температуре оценивали концентрацию, подвижность и нормальную морфологию сперматозоидов в соответствии с рекомендациями Всемирной организации здравоохранения по анализу спермы (2010). Аликвоту общей спермы каждого пациента отправляли в клиническую и морфологическую лаборатории.
Для электронной микроскопии нативный материал эякулята фиксировали в 2,5%-ном глютаровом альдегиде (AppliChem, Германия) в течение суток. После фиксации материал трехкратно (по 15 мин) промывался в фосфатном буфере. После обработки в буферах исследуемые образцы помещались в 1%-ный раствор OsO4 (Acros Organics, Бельгия) на фосфатном буфере pH 7,2–7,4 на 1,5 часа, затем обезвоживались в спиртах восходящей концентрации и ацетоне, заключались в эпоксидную смолу Эпон-812 плоскопараллельным методом и полимеризовались при 600. Полученные блоки из эпоксидной смолы вытачивались на высокоскоростной фрезе Leica EM TRIM для получения полутонких срезов, окрашенных толуидиновым синим, и поиска в них клубочков. Блоки из эпоксидной смолы, содержащие клубочки, подвергались ультрамикротомии алмазным ножом на ультрамикротоме Ultracut-UC6 (Leica, Германия). Толщина ультратонких срезов составляла 70 нм.
Для контрастирования срезы обрабатывались 1,5%-ным раствором уранилацетата на 700 этаноле и цитратом свинца. После контрастирования срезы просматривались в трансмиссионном электронном микроскопе Jem 1011 (Jeol, Япония) с помощью цифровой камеры Erlangshen ES500W (Gatan, США, Канада). Измерение размеров ультраструктур осуществлялось в абсолютных единицах (мкм и нм). При необходимости проводилась морфометрия ультраструктур с помощью программного обеспечения DigitalMicrograph (Gatan, США). Для идентификации типа вируса использовали амплификационный метод ДНК-диагностики ПЦР. Анализ охватывал все известные в настоящее время генотипы как высокого онкогенного риска (ВПЧ-16, ВПЧ-18, ВПЧ-26, ВПЧ-31, ВПЧ-33, ВПЧ-35, ВПЧ-39, ВПЧ-45, ВПЧ- -51, ВПЧ-52, ВПЧ-53, ВПЧ-56, ВПЧ-58, ВПЧ-59, ВПЧ-64, ВПЧ-66, ВПЧ-67, ВПЧ-68, ВПЧ-69, ВПЧ- 70, ВПЧ-73, ВПЧ-82), так и низкого онкогенного риска (LR-ВПЧ), (ВПЧ-6, ВПЧ-11, ВПЧ-40, ВПЧ-42, ВПЧ-43, ВПЧ-44, ВПЧ- 54, ВПЧ-55, ВПЧ-61, ВПЧ-62, ВПЧ-71, ВПЧ-72, ВПЧ-81, ВПЧ-83, ВПЧ-84, ВПЧ-87, ВПЧ-89, ВПЧ-90). Различие между генотипами высокого и низкого рисков основано на классификации Международного агентства по изучению рака на основании ПЦР.
Для проведения статистического анализа полученные данные заносили в электронные таблицы Microsoft Excel пакета программ Microsoft Office 2007, их обработку проводили с использованием пакета программы STATISTICA 6.1 (StatSoftInc, США). Проведение расчетов и интерпретацию результатов осуществляли согласно руководству О. Ю. Ребровой.
Исследование проведено на базе урологической клиники ФГБОУ ВО «РостГМУ» Минздрава России и ООО Медицинского центра «Профессионал». Исследование выполнено в рамках диссертационной работы «Оценка папилломавирусного фактора при мужском бесплодии», одобрено Локальным независимым этическим комитетом ФГБОУ ВО «РостГМУ» МЗ РФ, протокол 16/19 от 17.10.2019.
Результаты. При анализе эякулята среди различных вариантов патозооспермии чаще выявлялась астенозооспермия (35,3%) и астенотератазооспермия (31,4%), а удельный вес олигоастенотератазооспермии и олигоастенозооспермии составлял 19,6 и 13,7% соответственно.
У всех обследуемых в эякуляте верифицированы различные типы ВПЧ. Причем из 20 идентифицированных вирусов 17 (85,0%) относились к вирусам высокого онкогенного риска (рис. 1). В структуре ВПЧ доминировали вирусы 18-го (33,3%) и 16-го (31,3%) типов. Реже обнаруживали вирусы 31-го и 33-го типов (27,4%; 21,5% соответственно). Удельный вес остальных вирусов был достоверно ниже (p<0,05).
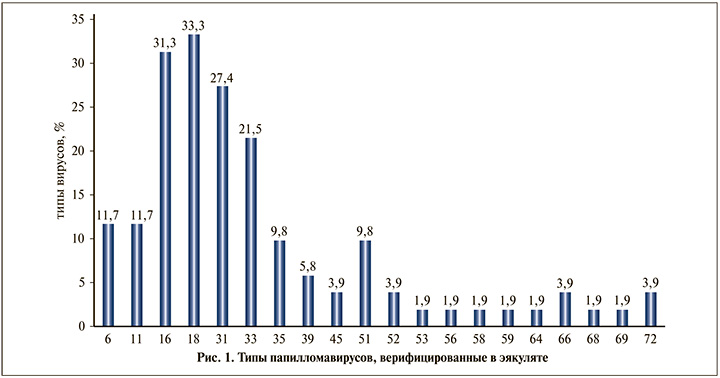
Обращает на себя внимание следующее обстоятельство: в 88,2% наблюдений в эякуляте регистрировали ассоциации из нескольких типов вирусов с доминированием 16-го и/или 18-го и 33-го типов, а также 18-го и 33-го типов.
Необходимо отметить, что у всех пациентов с олигоастенотератазооспермией в эякуляте выявлено три типа ВПЧ: 16-й, 31-й и 33-й.
Связь между ВПЧ и их негативным влиянием на морфологические характеристики сперматозоидов остается малоизученной, тем не менее вирус может присутствовать в различных фракциях спермы. При этом патогенный потенциал вируса может быть направлен на различные составляющие как сперматозоида, так и эякулята в целом. При анализе результатов электронной микроскопии отмечена фиксация вируса на сперматозоидах у 80,3% пациентов. При этом у большинства (76,4%) пациентов вирус локализовался на акросоме, а в спермоплазме (эпителиальные клетки и др.) был выявлен у 52,9% пациентов (рис. 2, 3).
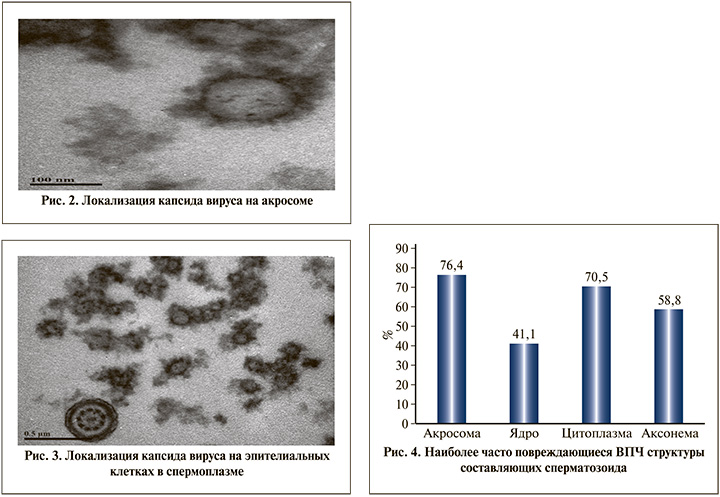
Кроме того, при выполнении электронно-микроскопического исследования эякулята были выявлены различные патологические изменения сперматозоида с доминированием (76,4%) изменений акросомы (рис. 4).
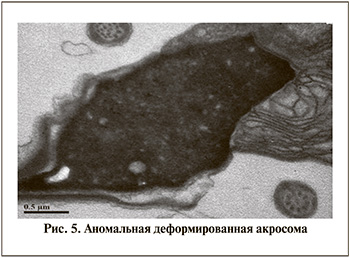
В настоящее время установлено, что изменения акросомы в большинстве случаев является основополагающим фактором снижения фертильного потенциала. В исследуемой когорте пациентов были выявлены различные варианты таких изменений акросомы: расширение субакросомального пространства (52,9%), уменьшенный размер акросомы (43,1%), патологические изменения постакросомной пластины (33,3%) (рис. 5). Кроме того, у большинства (60,8%) обследованных пациентов были выявлены патологические изменения ядра: наличие неконденсированного (29,4%) и разрушенного хроматина (31,4%), а регистрация вакуолей выше нормативных значений отмечена у 27,4% пациентов. Наиболее тяжелые изменения акросомы были выявлены при наличии в эякуляте 31-го и 33-го типов вируса.
Обсуждение. В последние годы в сообществе специалистов, занимающихся репродуктивным здоровьем мужчин, все большее внимание уделяется изучению того, как инфицирование мужчин ВПЧ может влиять на ухудшение качества спермы и отрицательные исходы беременности. Однако мнения по данной проблеме противоречивы и далеки от консенсуса.
Структура ВПЧ, представленная в нашем исследовании, частично корреспондирует с результатами прежних лет, в которых было установлено, что при инфертильности чаще регистрируют типы вирусов высокого онкогенного риска (16, 18, 31, 33). Суммарный эффект различных факторов патогенности, а также персистенция вируса способствуют длительному существованию ВПЧ в организме, вызывая различные виды патоспермии [15].
В исследованиях Y. Kato и соавт. (2021) и А. Piroozmand и соавт. (2020) установлено, что у ВПЧ-положительных пациентов при исследовании эякулята регистрировали низкие показатели прогрессивной подвижности и высокий процент неподвижных сперматозоидов [18, 19].
Рядом авторов [19, 20] при изучении качественных (морфологических) параметров эякулята установлено, что в ВПЧ-позитивных образцах спермы как фертильных, так и инфертильных пациентов снижается количество сперматозоидов с нормальной морфологией. Вышеописанная позиция корреспондирует с результатами проведенного нами исследования.
Патоспермия, ассоциированная с ВПЧ, может быть обусловлена присутствием вириона в какой-либо составляющей эякулята. По данным электронной микроскопии, нами выявлены различные варианты как акросомы, так и аксонемы сперматозоидов, что привело к качественным и количественным изменениям характеристики эякулята. Кроме того, обнаружено, что все компоненты эякулята (сперматозоиды, соматические клетки, плазма) могут содержать различные типы ВПЧ.
Важным результатом данного исследования являлось применение метода электронной микроскопии, позволяющего выявлять точки приложения ВПЧ, точную локализацию вируса и патологические изменения сперматозоида, вызываемые вирусом. У большинства пациентов были выявлены патологические изменения акросомы сперматозоида. При этом самая частая точка приложения ВПЧ – это постакросомная пластина, которая является важным фактором активации овоцитов. Кроме того, данная структура является одним из определяющих факторов пенентрационной способности сперматозоидов, что может быть выявлено только при электронной микроскопии. У большинства пациентов отмечено снижение целостности постакросомной пластины и расширение субакросомального пространства.
Данные изменения являются определяющими при планировании беременности, а также при проведении вспомогательных технологий при инфертильности.
Выводы. Основываясь на наших предыдущих данных и результатах настоящего исследования, можно сделать заключение, что ПВИ независимо от типа ВПЧ и локализации вирионов на сперматозоидах значительно ухудшает прогрессивную подвижность и морфологию сперматозоидов. Метод электронной микроскопии позволяет не только выявлять ВПЧ в эякуляте, но и уточнять его локализацию на сперматозоиде, определять те негативные изменения сперматозоида, которые вызваны вирусом.



