Введение. Хронический рецидивирующий цистит (ХРЦ) – распространенное заболевание в женской популяции [1, 2]. Вопросы диагностики и лечения ХРЦ тесно связаны с этиологическими факторами заболевания, ведь только точная идентификация патогена служит залогом успешного лечения. В подавляющем большинстве случаев ХРЦ вызывается различными представителями бактериальной флоры [3], преимущественно семейство Enterobacteriacea играет ведущую роль в этиологии ХРЦ. Среди них на протяжении десятилетий доминирующим патогеном является Escherichia coli: от 60 до 80% случаев, а Klebsiella spp., Proteus sрр., Enterobacter spp., Serratia spp. составляют небольшой удельный вес в этиологической структуре данного заболевания [4]. Кроме того, возбудителями ХРЦ могут выступать некоторые представители грамположительной флоры, такие как S. aureus, Enterococcus spp., некоторые таксоны коагулазоотрицательных стафилококков, а также микоплазмы, уреаплазмы, хламидии, неклостридиальные анаэробные бактерии, дрожжеподобные грибы рода Candida [5–8].
В настоящее время наименее изученной и, следовательно, наиболее дискуссионной проблемой является вирусная составляющая этиологической структуры ХРЦ [9, 10]. Долгое время в научном сообществе считалось, что причиной развития вирусного ХРЦ может стать пострансплантационная, постлучевая и постхимиотерапевтическая супрессия, сопровождающаяся нарушениями в иммунных звеньях защиты стенки мочевого пузыря [11]. Однако в последние годы появляются сообщения о пациентках с ХРЦ вирусной этиологии, не отягощенных вышеперечисленными состояниями. Следует отметить, что диагностика и лечение ХРЦ вирусной этиологии в корне отличаются от таковых при ХРЦ бактериальной этиологии [9, 11].
В вопросах, касающихся вирусного ХРЦ, новым и самым сложным является диагностика и лечение поражения папилломавирусной инфекцией (ПВИ), данное обстоятельство обусловлено неразработанностью специфических маркеров и/или критериев диагностики данного вирусного фактора [11].
Для выявления ПВИ рекомендованы следующие диагностические методы: молекулярно-биологический (ПЦР), эндоскопический, цитологический и гистологический [12].
Молекулярно-биологический метод в определении ПВИ в течение последнего десятилетия занимал ведущее место в клинической практике. Однако при локализации ПВИ в мочевом пузыре чувствительность и специфичность данного метода резко снижены – 20 и 10% соответственно. Причиной может быть низкая эффективность ПЦР из-за наличия ингибирующих веществ в моче или потере ДНК вируса папилломы человека (ВПЧ) при взятии образца мочи. В связи с этим при ПВИ предпочтительными могут оказаться итологические и гистологические исследования [11, 12].
Цитологическое исследование мочи – метод, который может быть включен в план диагностики ПВИ при ХРЦ, однако его использование в диагностических целях требует дополнительного углубленного изучения и высокой квалификации специалиста диагностической службы [12, 13].
Среди возможных методов диагностики ХРЦ папилломавирусной этиологии рассматривают эндоскопические (уретроцистоскопия) и гистологическое исследования [13]. Именно многогранность этиологии ХРЦ и особенности проведения вышеперечисленных диагностических методик в зависимости от природы биоматериала, взятого у пациента, делают актуальными исследования в этой области.
Цель исследования: повысить точность дифференциальной диагностики бактериального и папилломавирусного ХРЦ.
Материалы и методы. Проведен анализ эндоскопического и гистологического методов диагностики у 118 пациенток с ХРЦ, в зависимости от этиологического фактора заболевания разделенных на две группы. Первую составили 65 пациенток с ХРЦ папилломавирусной этиологии, вторую группу – 53 больных ХРЦ бактериальной этиологии (E. coli).
Все пациентки были обследованы согласно рекомендациям EAU и РОУ, дополнительно в диагностику было включено эндоскопическое исследование мочевого пузыря (цистоскопия) с морфологическим исследованием биоптатов мочевого пузыря. Цистоскопию выполняли под общим обезболиванием (внутривенной анестезией) в стадии ремиссии заболевания. Гистологическое исследование проводили всем пациенткам. Полученный морфологический материал фиксировали в растворе нейтрального 10%-ного забуференного формалина (PBS-буфер) с экспозицией не более 24 ч, после чего материал проводили по стандартной технологической обработке, сформировав парафиновые блоки. Из полученных блоков готовили срезы толщиной 3–5 мкм, окрашенные гематоксилином и эозином. Микроскопическое исследование проводили при увеличении объективов 100, 200 и 400 с целью обзорной гистологической характеристики биоптатов, оценки состояния уротелия и клеточного состава воспалительного инфильтрата.
Работа выполнена в рамках диссертационного исследования, одобренного Локальным независимым этическим комитетом ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России.
Результаты. Эндоскопическая картина ХРЦ бактериальной этиологии, как правило, характеризовалась гиперемией слизистой мочевого пузыря, полнокровием и инъекцией сосудов с участками (мелкоточечных/диапедезных) кровоизлияний без признаков пролиферативных изменений (рис. 1).
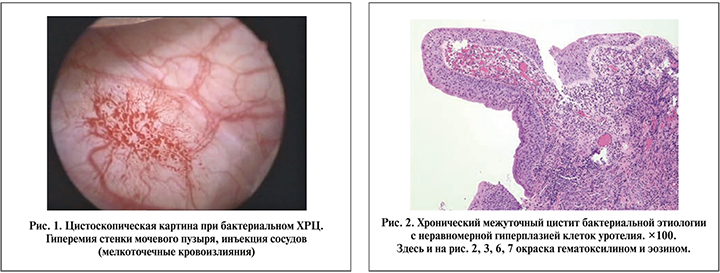
При морфологическом анализе биоптатов мочевого пузыря отмечались утолщение уротелия, очаги десквамации, неравномерная гиперплазия с формированием папиллоподобных структур. В слизистой и подслизистом слое имели место отек, полнокровие капилляров, воспалительная инфильтрация, представленная лимфоцитами, плазматическими клетками и лейкоцитами, среди которых превалировали нейтрофилы и макрофаги. Кроме того, в подслизистом слое определялось замещение эластических волокон грубыми соединительнотканными, тесно соединяющимися с гипертрофированными мышечными волокнами (рис. 2).
Следует подчеркнуть важные особенности: хроническое воспаление бактериальной этиологии приводило к реактивным изменениям уротелия в виде его разрыхления, гиперплазии с ослаблением клеточных связей вплоть до десквамации клеток. Вероятно, взаимодействие рецепторов уротелия и уропатогенов служит пусковым фактором выброса медиаторов воспаления и др., что объясняет возможность перехода хронического воспалительного процесса в острый (рис. 3).

Эндоскопическая картина при ХРЦ папилломавирусной этиологии у всех пациенток была представлена очаговыми или диффузными, слегка возвышающимися экзофитными, часто полиповидными образованиями белесоватого или белесовато-серого цвета, локализующимися преимущественно в треугольнике Льето. При механическом контакте с цистоскопом полиповидные образования легко отделялись от стенки МП, при этом не вызывая кровотечения, в отличие от цистита бактериальной этиологии, когда малейшая травма слизистой приводит к кровотечению.
У 28 (48,3%) пациенток патологический процесс определялся только в треугольнике Льето (рис. 4).
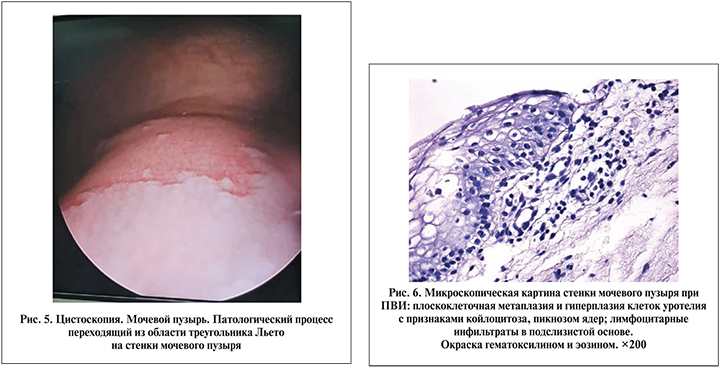
У 29 (50%) пациенток процесс был локализован как в треугольнике Льето, так и на боковых стенках мочевого пузыря. При этом образования были представлены либо небольшими фокальными участками, либо единым пластом патологического процесса в виде ковра, перешедшего из области треугольника Льето на боковые стенки мочевого пузыря (рис. 5).
У одной пациентки патологический процесс имел диффузный характер с поражением всех стенок мочевого пузыря.
При гистологическом анализе слизистой мочевого пузыря у всех пациенток с признаками поражения ПВИ отмечались утолщение уротелия, его плоскоклеточная метаплазия, хроническое воспаление слизистого и подслизистого слоев, микроциркуляторная сосудистая реакция и отек. При этом у большинства пациенток воспалительные изменения слизистой мочевого пузыря были представлены лимфоцитарной инфильтрацией с примесью плазматических клеток.
Плоскоклеточная метаплазия уротелия носила характер субтотального или тотального поражения с увеличением толщины эпителиального пласта за счет отека и паракератоза – неполного ороговения эпителиальных клеток. По этой причине пораженный участок слизистой мочевого пузыря при цистоскопии выглядел приподнятым, рыхлым и гиперплазированным. Однако самым главным отличительным патоморфологическим симптомом ПВИ мочевого пузыря являлась койлоцитарная трансформация клеток уротелия, обусловленная цитопатическим эффектом вируса. Этот феномен имел место у всех больных и сочетался с плоскоклеточной метаплазией шейки мочевого пузыря различной степени выраженности (рис. 6).
Дифференцированные клетки уротелия с признаками койлоцитоза характеризовались увеличенными или анормальными размерами, содержали 1–2 (реже больше) ядер, окруженных большой, четкой перинуклеарной зоной просветления или ореолом. Ореол представлял собой утолщенный периферический ободок цитоплазматической конденсации. Ядра чаще всего гиперхромные, неправильной формы («изюмоподобные»).
 Кроме плоскоклеточной трансформации уротелия и койлоцитарной дистрофии среди морфологических изменений с признаками хронического продуктивного воспаления были обнаружены плоскоклеточные папилломы (5,1%) и остроконечные кондиломы (13,7%), которые приходилось дифференцировать с опухолевым процессом. Данные признаки наблюдали у пациенток с длительностью заболевания более 5–6 лет, ранее подвергавшихся хирургическому лечению – трансуретральной резекции. При папилломаподобных образованиях гребни уротелия локализовались вместе с базальными шиповатыми клетками без инвазии в базальную мембрану на фоне папиллярной плоскоклеточной гиперплазии и эксцентрично расположенных ядер уротелия. При кондиломах мочевого пузыря отмечалась веррукозная (папиллярная) гиперплазия уротелия с выраженными койлоцитозными изменениями без признаков дисплазии и атипии (рис. 7).
Кроме плоскоклеточной трансформации уротелия и койлоцитарной дистрофии среди морфологических изменений с признаками хронического продуктивного воспаления были обнаружены плоскоклеточные папилломы (5,1%) и остроконечные кондиломы (13,7%), которые приходилось дифференцировать с опухолевым процессом. Данные признаки наблюдали у пациенток с длительностью заболевания более 5–6 лет, ранее подвергавшихся хирургическому лечению – трансуретральной резекции. При папилломаподобных образованиях гребни уротелия локализовались вместе с базальными шиповатыми клетками без инвазии в базальную мембрану на фоне папиллярной плоскоклеточной гиперплазии и эксцентрично расположенных ядер уротелия. При кондиломах мочевого пузыря отмечалась веррукозная (папиллярная) гиперплазия уротелия с выраженными койлоцитозными изменениями без признаков дисплазии и атипии (рис. 7).
Таким образом, при морфологической картине хронического межуточного воспаления, проявляющегося отеком, полнокровием сосудов, десквамацией клеток уротелия, воспалительной лейкоцитарной (нейтрофильной) инфильтрацией, диагностируют хронический бактериальный цистит. При наличии в патогистологической картине плоскоклеточной метаплазии с койлоцитарно-клеточной трансформацией и пикнотическими изменениями ядер уротелия лимфоцитарно-плазмоцитарной инфильтрации диагностируют хронический цистит с признаками папилломавирусной инфекции (Патент на изобретение РФ № 2723024) [14].
Заключение. Хронический рецидивирующий цистит, который может быть вызван как бактериальным, так и вирусным этиологическим фатором, – сложная и нерешенная проблема современной медицины. Поражение затрагивает гемодинамические, иммунокомпетентные структуры мочевого пузыря и требует разработки новаторского подхода к лечению.
По нашему мнению, «золотым» стандартом диагностики ХРЦ ПВИ этиологии может стать эндоскопическое исследование мочевого пузыря с морфологической оценкой биоптатов мочевого пузыря.
Плоскоклеточная метаплазия уротелия в сочетании с койлоцитарной трансформацией клеток в виде эксцентрически расположенных ядер с обширной перинуклеарной зоной просветления, пикнозом ядер и воспалительной лимфоцитарной инфильтрацией служат достоверным признаком ХРЦ папилломавирусной этиологии.



