Введение. Уретростомия традиционно рассматривается как операция, используемая после исчерпания других возможностей реконструктивно-восстановительной хирургии уретры [1–3]. Также считается, что она применима к людям пожилого возраста и/или пациентам с сопутствующими заболеваниями, исключающими длительную анестезию [3]. Кроме того, уретростомия необходима при травматической ампутации полового члена и злокачественных опухолях уретры и пениса [4, 5].
Однако в литературе последнего десятилетия уретростомия все чаще обсуждается в контексте рационального выбора лечения мужчин с протяженными (пануретральными), рецидивными стриктурами передней уретры, а также пациентов с распространенным склероатрофическим лихеном и стриктурами, сформировавшимися после неудачных хирургических вмешательств при гипоспадии [6–9].
Во многом такая точка зрения объясняется результатами лечения и степенью удовлетворенности пациентов. Так, исследование, проведенное в клинике Лахи (США), продемонстрировало, что среди пациентов со склеротическим лихеном при среднем периоде наблюдения 32,4 мес. самая высокая частота успешного лечения стриктурной болезни отмечалась после выполнения перинеальной уретростомии – 93%, в то время как при одно- и двухэтапной буккальной пластике уретры она составляла 75 и 76% соответственно [10]. Схожие данные приводят A. C. Peterson et al. [11], утверждая, что перинеальная уретростомия может быть лучшим выбором для пациентов с протяженными стриктурами, ассоциированными со склеротическим лихеном, нежели чем этапная реконструктивно-восстановительная хирургия. При этом авторы отмечают, что качество жизни удовлетворяло всех пациентов. Исследование G. P. Murphy et al. [8] подтвердило, что уретростомия, избавляя больных от обструктивных симптомов без негативного влияния на эректильную функцию, предполагает сопоставимую удовлетворенность функциональными результатами по сравнению с пациентами, которые подверглись пластике передней уретры. При этом частота рецидивов заболевания через 2 года наблюдения в группе уретропластик составила 30,2%, в группе уретростом – 14,5%.
Изучив тенденцию использования различных хирургических техник при сложных стриктурах передней уретры в специализированном центре Юта (США), J. S. Fuchs et al. [12] показали, что доля уретростомий с 2008 по 2017 г. неуклонно росла, увеличившись почти 10-кратно – с 4,3 до 38,7%. Авторы также подчеркивают, что при среднем периоде наблюдения (50,7 мес.) показатели успеха лечения выше среди пациентов с уретростомами (94,8%) по сравнению с теми, кому выполнена буккальная и кожная уретропластика (78,5 и 78,2% соответственно), даже несмотря на то что пациенты, подвергнутые уретростомии, были старше и имели более протяженные стриктуры.
Другим опосредованным основанием для пересмотра роли уретростомии в лечении стриктур уретры стало развитие и широкое применение этапной хирургии [13–15].
В этой ситуации уретростомия, выполненная в качестве первого этапа лечения, зачастую становится окончательным видом деривации мочи ввиду удовлетворенности пациентов как самим мочеиспусканием, так и связанным с ним качеством жизни. Фактически только 24–58% респондентов подвергаются второму этапу хирургии [2, 11, 16, 17].
И наконец, многие пациенты, в частности, с рецидивными стриктурами, перенесшие неоднократные хирургические вмешательства, не желая подвергаться длительной реконструкции уретры, изначально выбирают более простой путь – уретростомию [18].
Тем не менее, несмотря на все положительные стороны метода, существуют риски развития как ранних, так и поздних послеоперационных осложнений, включая одно из наиболее распространенных – стеноз уретростомы.
Цель исследования: оценить результаты промежностной и пенильной уретростомий, выявить факторы, связанные с развитием ранних хирургических осложнений и стеноза уретростом.
Материалы и методы. В 2010–2019 гг. 754 пациента подверглись хирургическому лечению стриктур уретры, 85 (11,3%) из них выполнена уретростомия. В 48 (56,5%) случаях уретростома использовалась как окончательный метод лечения стриктурной болезни (пожизненная уретростома), в 37 (43,5%) наблюдениях в последующем планировалась уретропластика, однако она не была проведена ввиду отказа пациента (94,6%) либо развития жизнеугрожающих осложнений сопутствовавших заболеваний (5,4%). Клиническая характеристика пациентов представлена в табл. 1.
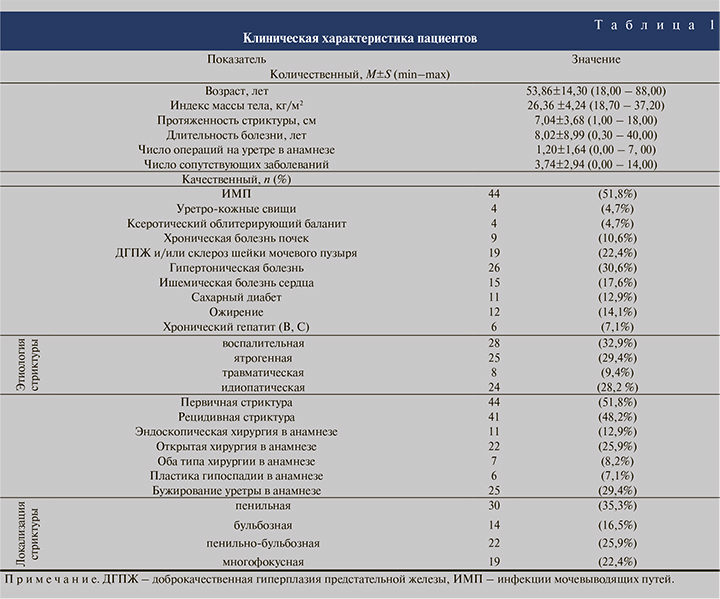
Почти в половине (51,8%) случаев выполнена промежностная уретростомия, в остальных наружное отверстие мочеиспускательного канала сформировано на стволе полового члена.
Хирургическая техника. При проведении промежностной уретростомии использовали технику без пересечения дорсальной стенки уретры. Пациенту в литотомическом положении выполняли вертикальный срединный разрез на промежности от задней полуокружности мошонки до края анального сфинктера. В случае планирования в дальнейшем уретропластики обнаженную вентральную стенку уретры рассекали на всем протяжении стриктуры, продолжая разрез в проксимальном направлении в надстриктурной части уретры на протяжении 1,5–2,0 см. После этого для исключения структуры уретры в вышележащих отделах или стеноза шейки мочевого пузыря производили калибровку уретры бужом 24–28 Ch и уретроцистоскопию. Затем края продольно рассеченной уретры в стриктурной и надстриктурной зонах сшивали с краями кожи промежности отдельными узловыми швами (марсупиализация). Уретральный катетер вводили через меатус в надстриктурной части уретры. При ограниченной эластичности кожи промежности применяли технику Z-пластики в нижней части разреза промежности для создания уретростомы без натяжения. В случае окончательной уретростомии стриктурную часть уретры продольно не рассекали, а разрез по вентральной поверхности уретры проводили только в надстриктурной ее части. При выполнении пенильной уретростомии также использовали вышеописанную технику Johanson с марсупиализацией уретры.
Послеоперационный период, мониторирование. Уретральный катетер удаляли на 4–7-е сутки после операции. Контрольные обследования проводили через 3, 6 и 12 мес. в течение первого года мониторирования, далее ежегодно. В эти сроки выполняли общий анализ мочи, урофлоуметрию, измеряли количество остаточной мочи. При наличии жалоб, уменьшении максимальной скорости потока мочи менее 12 мл/с или выявлении остаточной мочи объемом более 100 мл выполняли восходящую уретрографию и при необходимости – уретроцистоскопию. При ухудшении мочеиспускания пациенты обращались вне плановых сроков мониторирования, и им проводилось стандартное обследование, направленное на выявление рецидива стриктурной болезни.
Методы статистического анализа. Статистическая обработка результатов проведена с помощью программы «SPSS Statistics v. 17.0». Использовали методы расчета описательных статистик (частота – для качественных показателей, среднее (M), стандартное отклонение (SD), минимальное (min) и максимальное (max) значения – для количественных). При одномерной оценке риска осложнений/стеноза уретростомы рассчитывали показатели относительного риска (значимость проверяли с помощью критерия хи-квадрат) для качественных показателей и выполняли дисперсионный анализ (значимость проверена с помощью критерия Фишера) для количественных показателей. Многомерный анализ выполнен посредством оценки логистической регрессии.
Результаты. Ранние хирургические осложнения развились у 7 (8,2%) пациентов (табл. 2).

Инфекционно-воспалительные осложнения были купированы усилением антибактериальной терапии, в двух случаях из них в последующем был выявлен стеноз уретростомы. В одном случае после удаления катетера возникла острая задержка мочеиспускания, потребовавшая хирургической коррекции неомеатуса. Пациент со сниженным объемом мочевого пузыря после восстановления мочеиспускания через промежностную уретростому отказался от самостоятельного мочеиспускания из-за поллакиурии и сохранил цистостому.
У 14 (16,5%) пациентов в сроки от 3 до 200 мес. (медиана – 8 мес.) выявлен стеноз уретростомы. В 6 (42,9%) случаях отмечен стеноз пенильных стом, в 8 (57,1%) ― промежностных. Хирургическая коррекция стеноза уретростомы выполнена 12 (14,1%) пациентам, причем у троих из них она проведена впоследствии повторно в период 4 – 48 мес. после первой коррекции. Двум (2,4%) пациентам было рекомендовано проведение системного бужирования стеноза.
Таким образом, ранние и/или поздние осложнения в виде стеноза уретростомы имели место в целом у 18 (21,2%) пациентов. При этом у 3 (3,5%) пациентов наблюдались и ранние послеоперационные осложнения, и стеноз уретростомы. Риск неуспешности операции исследовали среди пациентов, у которых возникли или ранние послеоперационные осложнения, или стеноз уретростомы, или то и другое вместе.
Одномерный анализ (табл. 3) выявил повышение риска развития осложнений (ранних и поздних) у пациентов с ИМП (в 3,3 раза, р=0,013), гипертонической болезнью (в 2,3 раза, р=0,044), бужированием уретры в анамнезе (в 2,4 раза, р=0,031) и многофокусной локализацией стриктур (в 2,8 раза, р=0,011). Остальные изучаемые факторы статистически значимого влияния на развитие осложнений не оказывали.

Многомерный анализ с использованием модели логистического регресса показал, что совокупность таких факторов, как возраст пациента (каждый год снижает риск в 0,924 раза (р<0,01)), наличие уретро-кожных свищей, гипертонической болезни, бужирования в анамнезе, хронической болезни почек, многофокусной локализации стриктур и стриктуры после пластики гипоспадии, обусловливает риск развития ранних и поздних осложнений в пределах 32,1−49,9% случаев (табл. 4). Модель статистически значима по критерию хи-квадрат (р<0,0001).
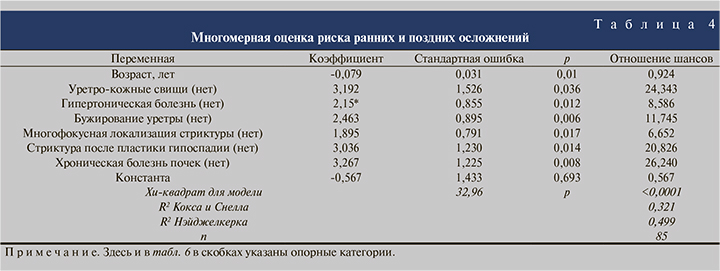
Отдельно изучены факторы риска развития стеноза уретростомы. Одномерный анализ выявил, что наличие инфекции мочевых путей повышает риск стеноза в 6 раз (р=0,003), гипертонической болезни – в 2,6 (р=0,035), стриктуры после пластики гипоспадии – в 3,3 (р=0,031). Также риск стеноза увеличивается в 4 раза (р=0,004) при наличии ранних послеоперационных осложнений (табл. 5).
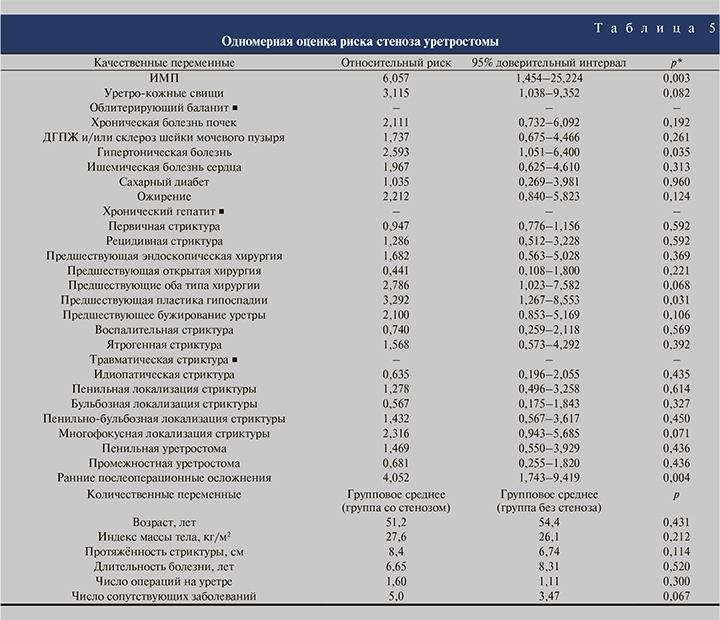
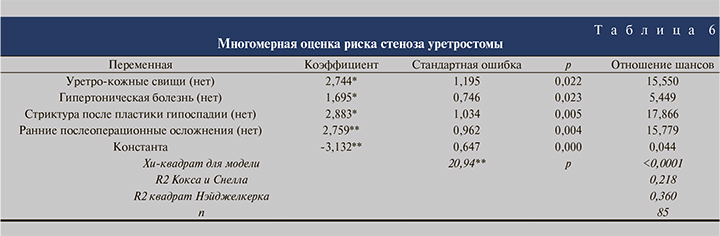
В табл. 6 представлены результаты многомерной оценки риска развития стеноза уретростомы при помощи модели логистического регресса с зависимой переменной «наличие стеноза». Совместная вариация факторов: уретро-кожные свищи, гипертоническая болезнь, стриктура после пластики гипоспадии и ранние послеоперационные осложнения, могут обусловить 21,8−36,0% случаев вероятности развития стеноза уретростомы. Модель статистически значима по критерию хи-квадрат (р<0,0001).
Обсуждение. В настоящем исследовании мы определили первичный успех лечения как отсутствие осложнений, требующих повторного хирургического вмешательства на уретре и/или системного бужирования. Таким образом, при среднем периоде мониторирования 58 мес. мы констатировали 81,2% (70 / 85) случаев успешного лечения стриктур уретры, при этом стеноз уретростомы выявлен в 16,5% (14/85) наблюдений, что совпадает с данными литературы, согласно которым частота развития стенозов составляет от 0 до 30% случаев [2, 3, 7, 8, 10, 11, 12, 16–21]. Такой широкий разброс результатов может быть связан с неоднородностью изучаемых групп, а также различными сроками наблюдения. Более чем 10-летний опыт Университета Дьюка (США) показывает стопроцентно благоприятные исходы уретростомии, за 38,5 мес. наблюдения ни одному из пациентов не потребовалась повторная операция или бужирование [11]. Однако в этом исследовании только 18% больных имели в анамнезе неэффективную хирургию уретры, что значительно разнится с выборкой наших пациентов, а также пациентов из серий J. B. Myers et al. [18], G. Barbagli et al. [2] и S. Kulkarni et al. [19], в которых доля рецидивных стриктур составила 48,2; 48; 52,6 и 96,3%, при этом стеноз регистрировался в 16,5, 18, 30 и 28% наблюдений соответственно. Также в приведенных выше исследованиях, за исключением работы J. B. Myers et al. [18], заявлен более длительный срок наблюдения – от 58 до 62 мес.
Ранее перенесенные неэффективные вмешательства на уретре – хорошо известный фактор риска неблагоприятного исхода любой планируемой операции на уретре [22–25], и уретростомия здесь не исключение, что подтверждается данными вышеперечисленных работ и других исследований [3, 26]. В нашей работе мы также наблюдали более высокий риск развития осложнений при наличии в анамнезе открытой и/или эндоскопической хирургии, но данная тенденция не получила статистического подтверждения. При этом выявлено, что предшествовавшее операции системное бужирование уретры, являясь независимым достоверным предиктором развития ранних и поздних осложнений, повышает вероятность их возникновения в 2,4 раза в совокупности с другими неблагоприятными факторами, выявленными при многомерном анализе, ― в 11,7 раза (см. табл. 3, 4).
Второй по частоте обсуждения в литературе фактор риска развития стеноза уретростом связан с этиологией стриктур. Неблагоприятными считаются воспалительные стриктуры. Так, G. Barbagli et al. [2] выявили наибольшую частоту осложнений среди пациентов с инфекционными стриктурами (66,7%). Травматические стриктуры могут иметь неблагоприятный прогноз в случаях, когда повреждена промежность. Не вызывает сомнений отрицательное воздействие лучевой терапии, что связано с развитием рубцовой ткани и предрасположенностью таких пациентов к плохому заживлению ран. J. B. Myers et al. [18] сообщили о 12-кратном повышении риска развития стеноза уретростом у пациентов с предшествовавшей радиотерапией таза.
В нашу выборку не входили пациенты с постлучевыми стриктурами, а количество больных травматической этиологией стриктур составили всего лишь 9,4% случаев, при этом ни в одном из них стеноза не выявлено. Среди пациентов с воспалительными стриктурами стеноз диагностирован в 10,7% (3/28) наблюдений, а инфекционный генез заболевания не оказывал значимого влияния на вероятность его развития. А вот наличие ИМП, напротив, играло значимую роль в повышении рисков развития осложнений, как ранних и поздних в совокупности, так и поздних в отдельности (см. табл. 3, 5).
В отношении склероатрофического лихена и отдаленных результатов уретростомии в литературе представлена неоднозначная точка зрения. С одной стороны, существует ряд работ, в которых уретростомия при склероатрофическом лихене демонстрирует наивысшие показатели успеха (93–100%) по сравнению с различными видами уретропластик [10, 11, 18, 26]. В других же исследованиях склероатрофический лихен рассматривается как фактор неблагоприятного прогноза. Так, G. Barbagli et al. [2] связывают со склеротическим лихеном 36,7% неудачных исходов хирургии, J. C. Lopez et al. [27] утверждают, что пациенты с лихеном в 3 раза чаще нуждаются в повторных операциях по сравнению с пациентами, которым уретростомия выполнена по поводу идиопатических стриктур или стриктур, сформировавшихся после пластики гипоспадии. Вероятно, это связано со степенью распространенности лихена и зоной формирования уретростомы. Возможно, благополучные исходы обусловлены тем, что поражается головчатая или пенильная уретра, тогда как операция проводится на здоровой бульбарной уретре. А одной из вероятных причин стеноза становится прогрессирование заболевания в зоне сформированной уретростомы. Что касается нашего исследования, то доля пациентов с лихеном была крайне низкой (4,7 %), при этом все пациенты имели удовлетворительный результат.
Считается, что самый благоприятный прогноз при выполнении перинеальной уретростомии имеют пациенты со стриктурами, развившимися в результате неудачной коррекции гипоспадии. В исследовании G. Barbagli et al. [2] у данной категории больных отмечен лучший (87,5 %) результат среди пациентов с любой другой причиной формирования стриктур (33,3–73,6 %). В нашем исследовании эта точка зрения не получила подтверждения, напротив, предшествовавшая пластика гипоспадии послужила достоверным фактором риска развития стеноза уретростом (см. табл. 5, 6), а среди пациентов этой группы определилась самая высокая частота стенозирования – 50% (3 / 6). При этом важно учитывать и другие отягощающие факторы: так, пациенты с неудовлетворительным исходом уретростомии неоднократно оперированы уже после неудачной коррекции гипоспадии (от 3 до 7 раз), имели протяженные стриктуры (от 4 до 8 см) с грубыми рубцовыми изменениями парауретральных тканей, ИМП, хронические сопутствующие заболевания, у двух из них отмечена избыточная масса тела.
Другая группа причин развития стеноза уретростом связана непосредственно с операцией. Так, успех лечения определяют радикальное иссечение рубцов уретры, отсутствие натяжения в зоне анастомоза между уретрой и кожей, сохранение дорсальной полуокружности уретры и прочие хирургические приемы. Исследования по сравнению различных техник уретростомий не выявили очевидных преимуществ какой-либо одной из них [3, 26, 28]. Тем не менее предполагается, что непересекающие техники Johanson и Blandy, предусматривающие сохранение дорсальной стенки уретры и ретроградного кровоснабжения из дорсальной артерии полового члена, обеспечивают лучшую профилактику стенозов уретростом [8, 18, 27, 29]. Данный подход был применен в нашем исследовании, однако преимущественное использование техники Johanson (78 / 85) не позволило оценить риски осложнений при различных техниках, что, с одной стороны, является слабой стороной работы, с другой – обеспечивает однородность выборки по данному показателю. Помимо этого нам не удалось рассчитать отдельно риски осложнений для промежностных и пенильных уретростом, что также можно отнести к ограничениям исследования. Тем не менее мы определили, что локализация уретростом значимого влияния на их стенозирование не оказывает (см. табл. 3, 5).
Результаты хирургии также могут быть связаны с сопутствующими хроническими заболеваниями. Об их негативном влиянии известно по ряду работ, посвященных течению стриктурной болезни и исходам уретральной хирургии при сахарном диабете, ишемической болезни сердца, артериальной гипертензии, гипотестостеронемии, метаболическом синдроме и др. [24, 30–33]. Тем не менее обзор публикаций показал, что характер сопутствовавших заболеваний и их причастность к развитию осложнений при выполнении уретростомий освещаются крайне редко.
В своей работе мы учли данные об имеющихся хронических заболеваниях, определив при этом достоверно значимую роль артериальной гипертензии в развитии осложнений как в целом, так и стенозов в частности (см. табл. 3–6). Влияние артериальной гипертензии на результаты хирургии может объясняться тем, что у таких больных имеются выраженные расстройства микроциркуляции, связанные с изменением сосудистого тонуса, а также реологических свойств крови. Данные нарушения ведут к снижению капиллярного кровотока, ухудшению перфузии органов и тканей, формированию хронической ишемии. А о роли ишемии в развитии стриктурной болезни известно давно из работ, в которых изучалась частота развития стриктур уретры у пациентов палат интенсивной терапии. Так, в журнале Тегеранского сердечного центра опубликовано исследование, доказывающее связь тяжести ишемической болезни сердца и риска развития катетер-ассоциированных стриктур уретры. Авторы установили, что пороговое значение шкалы SYNTAX Score более 22,5 баллов позволяет прогнозировать вероятность развития катетер-ассоциированных стриктур уретры с чувствительностью 76,7% и специфичностью 85,1% [34]. J. C. Lopez et al. [27] сообщили, что ишемическая болезнь сердца, опосредованно воздействуя на процесс заживления ран, увеличивает вероятность стенозирования уретростом в 2,3 раза. Данный факт необходимо учитывать при планировании уретральной хирургии у пациентов с гипертонической болезнью, и помимо адекватной антигипертензивной терапии проводить лечение, улучшающее микроциркуляцию.
Что касается ранних послеоперационных осложнений, то здесь исследователи сходятся в одном: уретростомия позиционируется как операция, характеризующаяся низкой частотой их развития. В работах упоминается о единичных случаях кровотечения, образования гематом, расхождения швов и прочих осложнений, как правило не требующих дополнительных хирургических вмешательств [2, 8, 17, 26, 27]. Наше исследование не стало исключением, также показав относительно низкий уровень послеоперационных осложнений (8,2 %). Это обстоятельство не позволило отдельно оценить факторы, влияющие на их развитие, что можно считать еще одним ограничением работы. Однако при изучении рисков развития стенозов уретростом ранние послеопер ционные осложнения оказались достоверным фактором их развития, повышающим вероятность стенозирования в 4,1 раза, в совокупности с другими неблагоприятными факторами, выявленными при многомерном анализе, – в 15,8 раза (см. табл. 5, 6).
Выводы
1. Уретростомия обеспечивает восстановление удовлетворительного мочеиспускания в 97,6% случаев, сопровождается низкой частотой ранних послеоперационных осложнений (8,2%), но сопряжена с развитием в отдаленном периоде стеноза уретростом (16,5%). Первичная успешность уретростомии при медиане наблюдения 58 мес. составляет 81,2%.
2. Независимым фактором риска развития ранних и поздних осложнений являются ИМП, артериальная гипертензия, бужирование и многофокусная локализация стриктур. Совокупность неблагоприятных факторов может обусловить 32,1–49,9% вероятности развития ранних и поздних осложнений.
3. Независимым фактором риска развития стеноза уретростом являются ИМП, артериальная гипертензия, предшествующая пластика гипоспадии и ранние послеоперационные осложнения. Совокупность неблагоприятных факторов обусловливает 21,8–36% вероятности развития стеноза уретростом.



