Введение. Стриктура уретры – полиэтиологическое заболевание, определяющееся патологическим сужением любого сегмента уретры, окруженного спонгиозным телом с различной степенью спонгиофиброза [1]. Стриктуры и облитерации мочеиспускательного канала – вторая по частоте причина развития обструктивного мочеиспускания у мужчин после доброкачественной гиперплазии предстательной железы [4]. Изучение патоморфологического строения стриктур мочеиспускательного канала является важной задачей, решение которой позволит точнее определить этиологию и патогенез формирования структурной болезни и повлиять на выбор оптимального метода оперативного вмешательства.
Цель исследования: оценить морфологическое и иммуногистохимическое строения стриктур различной этиологии.
Материалы и методы. Морфологическому, гистохимическому и иммуногистохимическому исследованию подверглись послеоперационные ткани патологически измененной уретры 110 пациентов в возрасте от 23 до 74 лет, проходивших лечение в Университетской клинике урологии РНИМУ им. Н. И. Пирогова (2014–2018). Исследование выполнено совместно с кафедрой патологической анатомии и клинической патологической анатомии РНИМУ им. Н. И. Пирогова, Москва; на базе ГКБ № 1 им. Н. И. Пирогова, Москва. Для сбора операционного материала использовали специализированные контейнеры с герметично закрывающейся крышкой. В процессе консервации гистологического материала использовали стандартный метод фиксации в 10%-ном растворе нейтрального формалина (раствор формальдегида 4% на 5%-ном фосфатном буфере, забуференный при рН 6,8–7,4). Исследуемый материал не оставляли без фиксирующей жидкости на открытом воздухе или на гигроскопичных поверхностях. Маркировку контейнеров и иных емкостей с операционным материалом выполняли при помощи маркировочных средств, не смываемых водой, спиртами и органическими растворителями.
Материал, помещенный в фиксирующую жидкость, хранился исключительно при комнатной температуре. Срок хранения до доставки в патологоанатомическое отделение не превышал 2 сут. Перевозка осуществлялась в специальных транспортировочных контейнерах, исключая тряскую езду, удары, падения и повреждения упаковки, а также воздействия экстремальных температур. Фрагменты стриктур уретры фиксировали в забуференном HCl 10%-ном растворе формалина (рН=7,2; от 5 до 24 ч); дегидратировали в батарее спиртов восходящей концентрации, заливали в парафин. Срезы ткани толщиной 4–610–6м (≈ 5 μm) помещали на обычные предметные стѐкла, депарафинировали согласно принятой стандартной методике. Впоследствии срезы окрашивали гематоксилином и эозином (H&E) для гистологического исследования.
Гистохимическое исследование. Срезы толщиной 4–6,10–6 м (≈5 μm) помещали в дистиллированную воду, затем окрашивали железным гематоксилином по Вейгерту в течение 10 мин, промывали под проточной водой, далее наносили пикрофуксин по Ван–Гизону, выдерживали также 10 мин. В дальнейшем срезы дегидратировали в батарее восходящих спиртов, просветляли в ксилоле и заключали в гель «Aquatex»® (aqueous mounting agent, «Andwin Science», Франция). В последующем по результатам окраски выполнялась морфометрия с целью выявления соотношения распределения мышечных и фиброзных элементов стромы.
Иммуногистохимическое исследование. ИГХ-исследование выполнялось по стандартному протоколу в автоматическом режиме в иммуногистостейнере BenchMark XT Ventana («Биовитрум», Россия) на выявление диагностических маркеров регенеративного процесса.
В качестве первичных антител во всех реакциях использовали мышиные моноклональные антитела к сократительным белкам (Smooth Muscle Actin, Vimentin, Calponin) и маркеры воспаления (CD45R, CD58, CD138, CD20, CD3) компании «Leica Biosystems Newcastle Ltd», United Kingdom). Вторичные антитела (антимышиные) кроличьи той же фирмы-производителя. Для каждого маркѐра выполнялись контрольные исследования с целью исключения псевдопозитивных и псевдонегативных результатов. Титр антител подбирали с использованием раствора для разведения антител (antibody diluents). Разведение 1:200; срезов на стекле по два. Ядра клеток докрашивали гематоксилином Mayer; промывали под проточной водой; дегидратировали (спирт 96%) 2 раза по 10 мин; срезы подвергали дегидратации и заключали в гель «Aquatex»® (aqueous mounting agent, «Andwin Science», Франция).
Интенсивность окрашивания срезов оценивали согласно рекомендациям производителей и с использованием цветовой шкалы детекции: «-» – отсутствие экспрессии, «+» – слабая экспрессия, «++» – умеренная экспрессия, «+++» – выраженная экспрессия (высокоинтенсивная иммунопероксидазная реакция). Визуализацию биопсийного материала выполняли на светооптическом микроскопе «Carl Zeiss Lab.A1» (Carl Zeiss, Германия), совмещѐнном с видеокамерой «AxioCam ERc5s» (Carl Zeiss Microscopy GmbH, Германия) и программным обеспечением ZEN Lite.
Статистическая обработка данных выполнена на индивидуальном компьютере с помощью электронных таблиц Microsoft Excel и пакета прикладных программ Statistica for Windows v. 7.0, StatSoft Inc.
Результаты. Образцы ткани для морфологического исследования забирали во время проведения реконструктивно- пластических операций на уретре (в большинстве случаев это иссечение и прямой анастомоз). Гистологический материал получен от 110 пациентов с 2011 по 2016 г.
Среднее значение возраста пациентов составило 65,5±23,7 года (от 23 до 74). Этиология стриктур, подвергшихся морфологическому исследованию, отображена в табл. 1.

Согласно выявленным морфологическим изменениям, сформировано три группы (рис. 1):
1) выраженное воспаление (густой, диффузный хронический воспалительный инфильтрат) без признаков фиброза стромы;
2) выраженный фиброз стромы со слабовыраженным (рассеянные клетки воспаления) хроническим воспалительным процессом;
3) смешанная группа, включившая как признаки хронического воспаления (слабовыраженный воспалительный инфильтрат), так и различную степень разрастания соединительной ткани (отсутствие/выраженный фиброз).
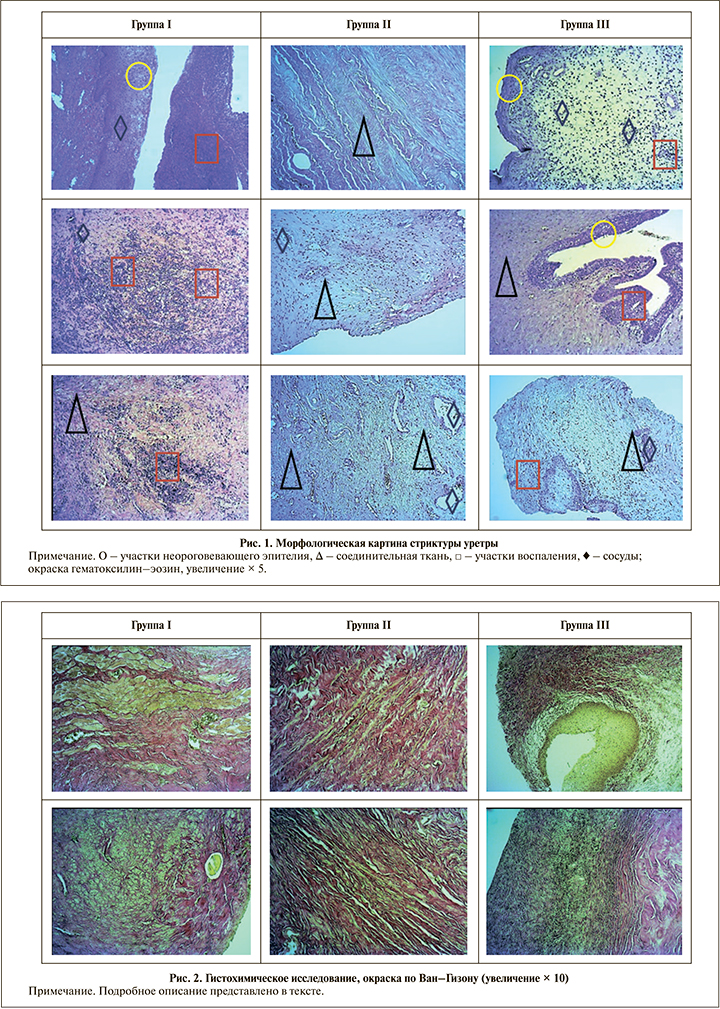
Особенности морфологических изменений и этиология стриктур уретры, вошедших в заявленные группы, представлены в табл. 2.

При окраске образцов ткани стриктуры уретры по Ван–Гизону коллагеновые волокна исследуемых образцов были окрашены пурпурно-красным цветом. Также в поле зрения присутствует ярко-желтое окрашивание различной степени выраженности мышечной ткани и гладкомышечных клеток кровеносных сосудов (рис. 2).
В отношении распределения мышечных и фиброзных элементов стромы получены следующие результаты: в первой группе доля эластического компонента стромы варьировалась от 24 до 37%; второй – от 59 до 72%; третьей – от 45 до 51%.

Иммуногистохимическое исследование показало, что наиболее интенсивная реакция со всем спектром антител обнаружилась в группе I; в группах II и III реакция была выражена менее активно. Результат реакции с антителами представлен в табл. 3.
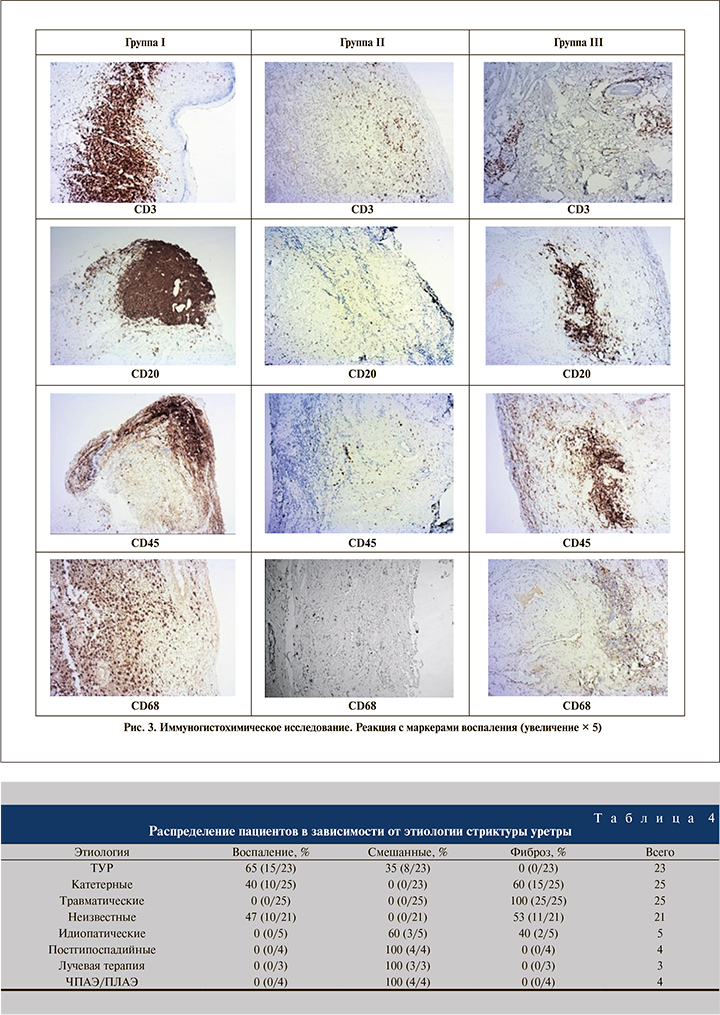
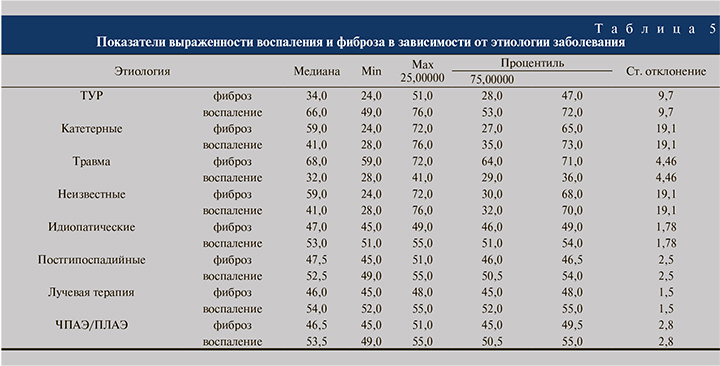
Ввиду специфики исследуемого материала маркеры мышечной и фиброзной ткани (Desmin, Smooth Muscle Actin, Vimentin, Calponin-1) активно экспрессируются во всех выделенных группах. Реакция с маркерами воспаления (CD3, CD20, CD45, CD68) имеет прямую зависимость от степени выраженности воспаления и развитости соединительной ткани. Таким образом, самый высокий уровень экспрессии данной категории маркеров показывает группа I, в которой преобладают морфологические признаки воспаления, в то время как во II группе реакция иммуномечения с антителами представлена менее выраженно (рис. 3, 4).
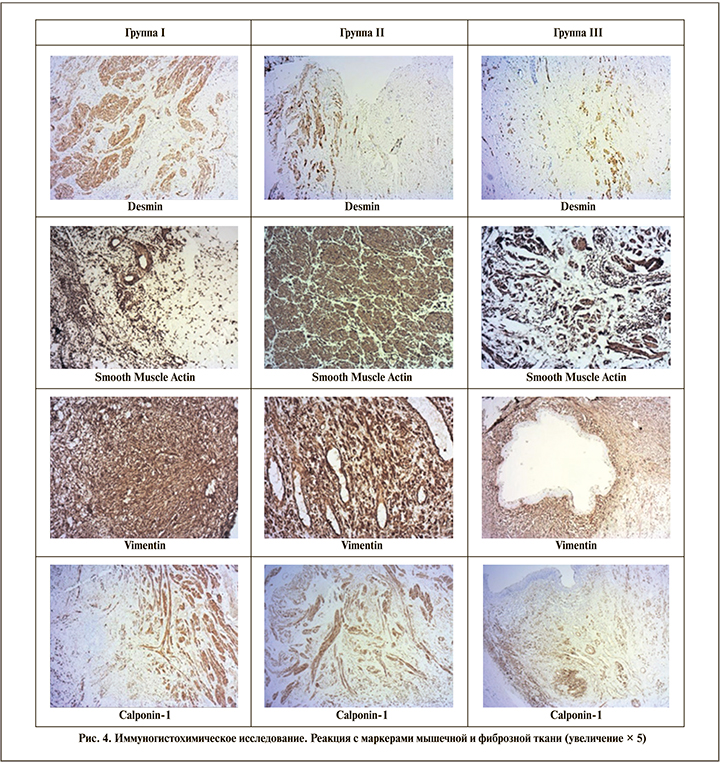
Количественное распределение пациентов в сформированных группах отображено в табл. 4.
Статистические показатели выраженности воспаления и фиброза, согласно этиологии, отображены в табл. 5.
По данным патоморфологических исследований, показатели воспаления у пациентов, перенесших трансуретральные вмешательства, составили в среднем 63,6% (рис. 5).
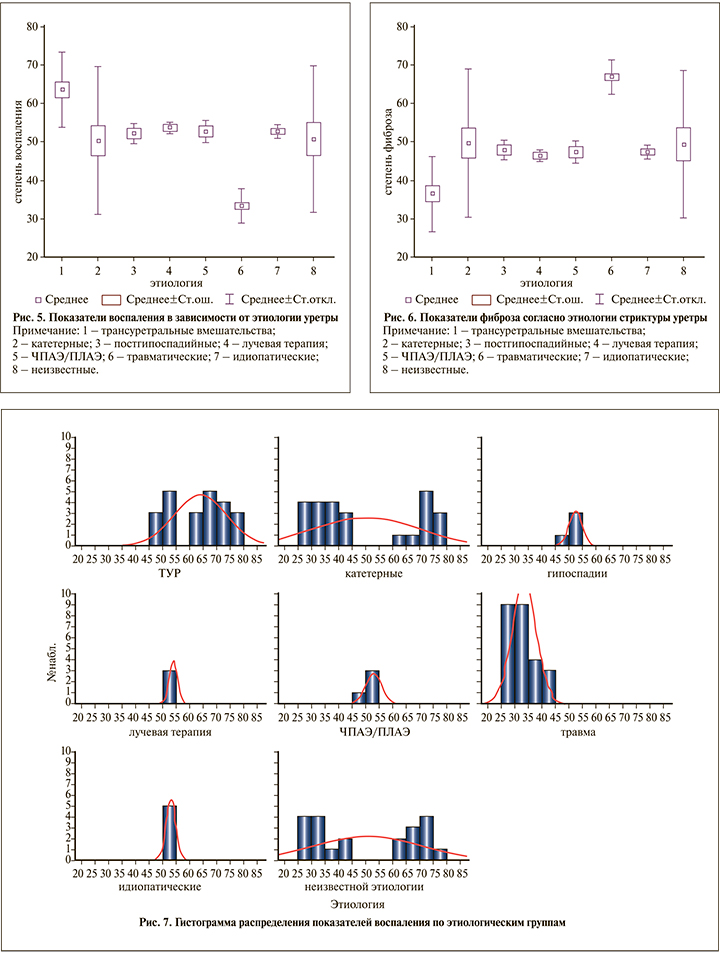
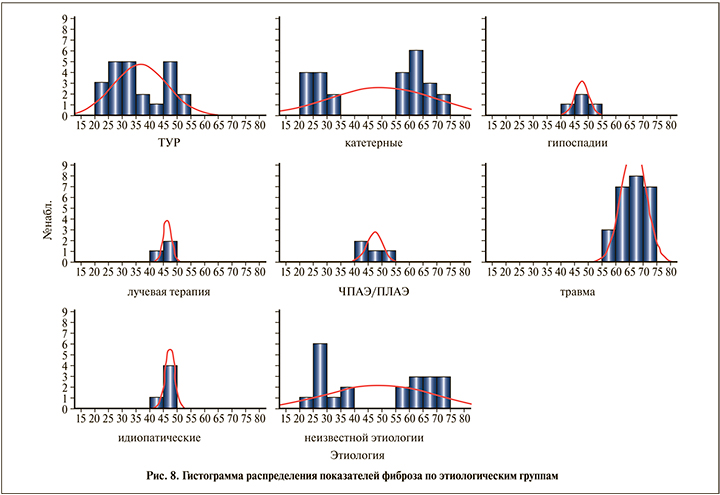
Показатели фиброза, по данным патоморфологических исследований, были выше у пациентов с травматической этиологией стриктуры мочеиспускательного канала и составили в среднем 66,0% (рис. 6).
В группе пациентов, перенесших трансуретральные вмешательства, по данным патоморфологических исследований, преобладают признаки хронического воспаления над фиброзом (p<0,05). Медиана оценки воспалительного процесса составляет 66% (min – 49; max – 76) (рис. 7).
В группе пациентов с травматической этиологией стриктуры мочеиспускательного канала преобладают признаки фиброза по сравнению с другими этиологическими группами (p<0,05). Медиана оценки фиброзной ткани – 68,0% (min – 59; max – 72) (рис. 8).
Обсуждение. Характерной особенностью стриктур уретры является замещение губчатого тела по отношению к слизистой уретры плотной волокнистой тканью из-за локального тромбофлебита, сам эпителий обычно не повреждается [3].
Исследования морфологии стриктур уретры показывают, что изменения представляют собой метаплазию эпителия уретры из его нормального многорядного столбчатого эпителия в многослойный плоский [2].
В морфологическом исследовании идиопатических стриктур уретры отмечалось замещение многорядного столбчатого эпителия многослойным плоским со слабовыраженным ороговением. Воспалительные изменения носили слабовыраженный характер, включая подслизистую соединительную ткань и спонгиозное тело. Спонгиофиброз сопровождался значительным сокращением сосудистого русла как венозных синусов, так и артерий. Те же изменения отмечались при воспалительном генезе стриктур уретры. При исследовании стриктур с травматической этиологией наблюдалась перестройка цилиндрического эпителия. В случаях с выраженным воспалением в слизистой оболочке изменения носили атрофико-гиперпластический характер с реактивной атипией клеток. При слабовыраженном воспалении наблюдалась плоскоклеточная метаплазия с незначительным ороговением.
Выявленные изменения при гистологическом исследовании показали наличие выраженного хронического диффузного воспаления в группе стриктур уретры после трансуретральных вмешательств. Достоверно отмечено отсутствие выраженного фиброза при стриктурах, развившихся после трансуретральных вмешательств, что несомненно указывает на отсутствие выраженного спонгиофиброза и будет одним из факторов эффективности уретропластики (при выполнении в специализированных центрах). Также необходимо отметить, что стриктуры, развившиеся после лучевой терапии рака предстательной железы, относятся к группе со смешанными изменениями. Выраженный рубцово-спаечный процесс, сложность хирургического доступа, частое сочетание со стриктурами бульбозного отдела и необходимость восстановления функции удержания мочи в последующем делают хирургию задней уретры исключительно прерогативой хирургов и центров с достаточным опытом уретральной и промежностной хирургии [5].
Заключение. Стриктуры уретры у мужчин имеют специфический этиологический фактор, но патогенез образования поражения мочеиспускательного канала можно разделить на посттравматический и поствоспалительный, что подтверждается гистоморфологическими исследованиями. Стриктуры уретры после трансуретральных вмешательств характеризуются преобладанием признаков хронического воспаления над фиброзом, в то время как при травматических, идиопатических и посткатетерных стриктурах в тканях уретры доминируют явления фиброза над воспалением.



