Введение. Согласно рекомендациям Европейской урологической ассоциации (EAU), все урологические вмешательства и операции ранжированы по риску развития послеоперационных инфекционно-воспалительных осложнений (ИВО). Перкутанная нефролитотрипсия (ПНЛТ) относится к операциям с высоким риском развития ИВО, требующим периоперационной антимикробной профилактики [1].
В исследовании [2], в котором участвовали 227 пациентов, перенесших первичную ПНЛТ, инфекция мочевыводящих путей (ИМП) после операции отмечалась у 37 (16%) пациентов, острый пиелонефрит – у 11 (5%), ССВР – у 21 (9%), уросепсис – у 2 (0,9%). Среди предикторов инфекционных осложнений выделены положительный интраоперационный посев камня (p=0,01), наличие струвитных камней (р<0,01); коралловидные (р<0,001) и множественные (р=0,02) камни почек. Коралловидные конкременты повышают риск развития инфекционных осложнений более чем в 3 раза, а наличие множественных камней обусловливает высокий риск осложнений. После анализа факторов риска до и после ПНЛТ только коралловидные конкременты оказались статистически значимо связанными с развитием послеоперационной лихорадки/ССВР/сепсиса (р=0,01) и общими инфекционными осложнениями.
По данным [3], из 303 пациентов, которым была выполнена ПНЛТ, у 83 (27,4%) наблюдали ССВР, у 23 (7,6%) развился сепсис. По мнению авторов, независимым предиктором развития ССВР и сепсиса могут служить положительный бактериологический анализ камня и рецидивирующая ИМП.
Согласно данным L. Liu et al. [4], из 303 пациентов, перенесших ПНЛТ, у 95 (31,4%) был положительный бактериологический анализ мочи до операции. В большинстве случаев выявлена E. coli (58,9%), у 35,7% из них развился ССВР. Таким образом, авторы пришли к выводу, согласно которому даже при интенсивной периоперационной профилактике у пациентов с предоперационной бактериурией был более высокий уровень частоты развития ССВР, чем у пациентов с отрицательным бактериологическим анализом мочи (р=0,043).
С учетом роста антибиотикорезистентности возбудителей урологической инфекции к антимикробным препаратам, одной из актуальных проблем является поиск методов антимикробной профилактики инфекционно-воспалительных осложнений после оперативных вмешательств по поводу мочекаменной болезни, в частности после ПНЛТ, а также адекватный режим антибиотикотерапии.
Цель исследования: определить эффективную методику периоперационной антимикробной профилактики ИВО у пациентов с камнями почек, подвергшихся ПНЛТ.
Материалы и методы. Проспективное сравнительное исследование проходило в клинике НИИ урологии и интервенционной радиологии им. Н. А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России с 03.2017 по 09.2019.
Исследование проведено на 90 пациентах с коралловидными или множественными крупными камнями почек, которым выполняли ПНЛТ. До ПНЛТ всем пациентам проводили бактериологический анализ мочи с целью определения чувствительности не только к антибиотикам, но и к препаратам бактериофагов. Мы не включали в исследование пациентов, у которых не было чувствительности выделенного возбудителя к исследуемым препаратам. Пациенты подписывали информированное согласие на антимикробную профилактику. Во время пункции лоханки почки у пациентов забирали мочу для дальнейшего микробиологического культурального исследования. Однако не от всех пациентов во время пункции лоханки была получена моча, поэтому микробиологические данные представлены не на 90 пациентов. Также часть анализов по техническим причинам не была проведена ряду пациентов на 3-и и 7-е сутки во всех 3 группах. В работе помимо хорошо известных антибиотиков: фторхинолона ципрофлоксацина и ингибиторзащищенного цефалоспорина 3-го поколения цефотаксим+сульбактам, мы применяли пиобактериофаг поливалентный, очищенный. Пиобактериофаг представляет собой смесь очищенных фильтратов фаголизатов бактерий Staphylococcus spp., Streptococcus spp., Proteus spp., Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli. Препарат обладает способностью специфически лизировать эти бактерии.
В зависимости от использованной периоперационной профилактики ИВО после ПНЛТ пациенты были разделены на 3 группы по 30 человек. Группы формировали методом случайной выборки в зависимости от результатов бактериологического анализа мочи.
В 1-й группе пациенты получали 1000 мг ципрофлоксацина внутривенно капельно в течение всей операции (в среднем около 60 мин) с последующим продолжением терапии внутривенно капельно по 1000 мг 1 раз в день в послеоперационном периоде в течение 3–5 дней.
Пациентам 2-й группы назначали одну дозу цефотаксим+сульбактама (1,0 г+0,5 г) за 2 ч до оперативного вмешательства внутримышечно однократно.
В послеоперационном периоде антибактериальная терапия не проводилась, за исключением пациентов с показаниями (развитие ССВР). Необходимо отметить, что мы применяли эту методику в основном к пациентам без предоперационной бактериурии.
В 3-й группе пациенты получали перорально за 1 ч до оперативного вмешательства 40 мл пиобактериофага поливалентного, очищенного, строго по чувствительности к нему уропатогенов и после операции по 40 мл того же бактериофага 3 раза в день перорально в течение 3–5 дней.
До начала исследования с целью подбора (повышения литической активности) препаратов бактериофагов к уропатогенам мы отсеяли и направили на фаговое производство (Уфа) 100 штаммов уропатогенной E. coli, выделенной от наших пациентов. Препараты пиобактериофага, которые мы назначали пациентам 3-ей группы, были подобраны к нашим штаммам кишечной палочки.
Для наблюдения за состоянием пациентов, контролем течения послеоперационного периода мы оценивали показатели температуры тела, общего анализа крови, результаты бактериологического анализа мочи на 3-и, 7-е сутки и мочи, полученной при пункции из лоханки почки. Также оценивали возраст; длительность заболевания; характеристику конкрементов (единичные/множественные, размеры); сопутствующие заболевания; наличие оперативных вмешательств в анамнезе; предоперационную бактериурию; вид выполненного оперативного вмешательства; количество оперативных доступов; установку послеоперационных дренажей/внутреннего стента.
При статистическом анализе использовали критерий Крускала–Уоллиса+post-hoc-анализ c использованием теста Steel–Dwass–Critchlow–Fligner, включившего корректировку на множественные сравнения. Статистически значимыми считали различия р≤0.05.
Результаты исследования. Основным возбудителем, выявленным до операции в моче, была E. coli (от 58% до 78%; табл. 1).

Антибиотики и препараты бактериофагов назначали строго в соответствии с чувствительностью к ним выделенных уропатогенов, хотя более чем в 50% случаев (особенно в группе, получавшей только 1 дозу цефотаксим/сульбактама) бактериурии перед операцией не было.
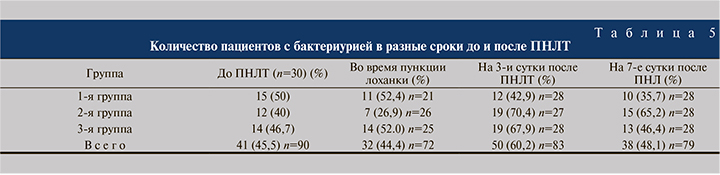
При исследовании мочи, полученной во время пункции лоханки почки, в группе ципрофлоксацина бактерии были выявлены у 52,4% пациентов, в группе цефотаксим/сульбактама – у 26,9%, в группе пиобактериофага – у 52%.
Во всех трех группах выявлено несоответствие результатов посевов мочи, полученной до операции и во время пункции лоханки почки. Среди выделенных микроорганизмов преобладала Е. coli: она встречалась в 54,4, 71,4 и 78,6% случаев в 1-й, 2 и 3-й группах соответственно.
Проведено межгрупповое сравнение по следующим показателям: лейкоциты крови, палочкоядерные нейтрофилы, температура тела на 1-е, 3-и и 7-е сутки после операции.
При сравнении содержания лейкоцитов крови на 1-е и 3-и сутки после операции статистически значимых различий не получено (р=0,05; рис. 1). Однако на 7-е сутки выявлены статистически значимые различия между 1-й и 2-й (p=0,0016), а также между 1-й и 3-й (p=0.0221) группами.
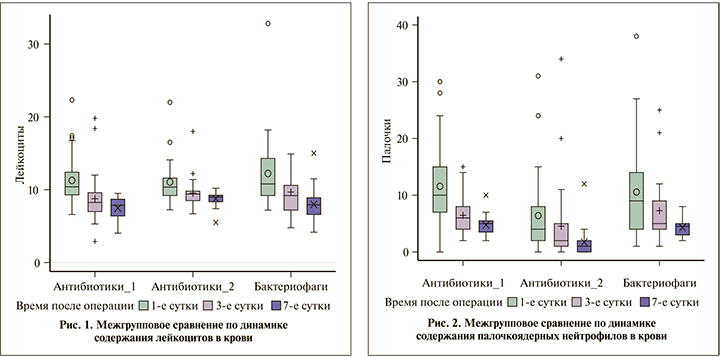
К 7-м суткам во всех группах уровень лейкоцитов крови нормализовался, однако во 2-й группе скорость снижения выраженности лейкоцитоза была наименьшей.
При сравнении содержания палочкоядерных нейтрофилов (рис. 2) на 1-е сутки статистически значимые различия получены между 1-й и 2-й (p=0,0033), а также между 1-й и 3-й группами (p=0,0401). При межгрупповом сравнении уровня палочкоядерных нейтрофилов крови на 1-е сутки после ПНЛТ наименьшие значения получены во 2-й группе (медиана – 4,0), тогда как в 1-й и 3-й группах медиана данного показателя была равна 10,0 и 9,0 соответственно.
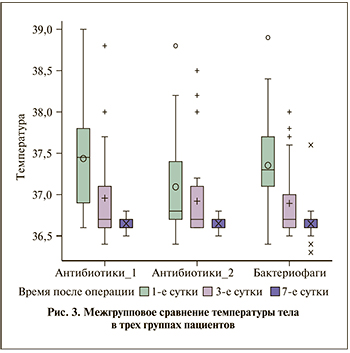 Сравнение показателей палочкоядерных нейтрофилов крови на 3-и сутки после операции также выявило статистически значимые различия между 1-й и 2-й (p=0,0033) и 1-й и 3-й (p=0,0065) группами. Во 2-й группе уровень палочкоядерных нейтрофилов на 3-и сутки был наименьшим (медиана – 2,0), в 1-й и 2-й группах – почти в 2 раза выше (медиана – 6,0 и 5,0 соответственно).
Сравнение показателей палочкоядерных нейтрофилов крови на 3-и сутки после операции также выявило статистически значимые различия между 1-й и 2-й (p=0,0033) и 1-й и 3-й (p=0,0065) группами. Во 2-й группе уровень палочкоядерных нейтрофилов на 3-и сутки был наименьшим (медиана – 2,0), в 1-й и 2-й группах – почти в 2 раза выше (медиана – 6,0 и 5,0 соответственно).
На 7-е сутки уровень палочкоядерных нейтрофилов также статистически значимо различался между 1-й и 2-й (p<0,0001) и 1-й и 3-й (p<0,0001) группами. Во 2-й группе на этом сроке данный показатель был наименьшим (медиана – 1,0) по сравнению с показателями 1-й (медиана 5,0) и 3-й (медиана 4,5) групп.
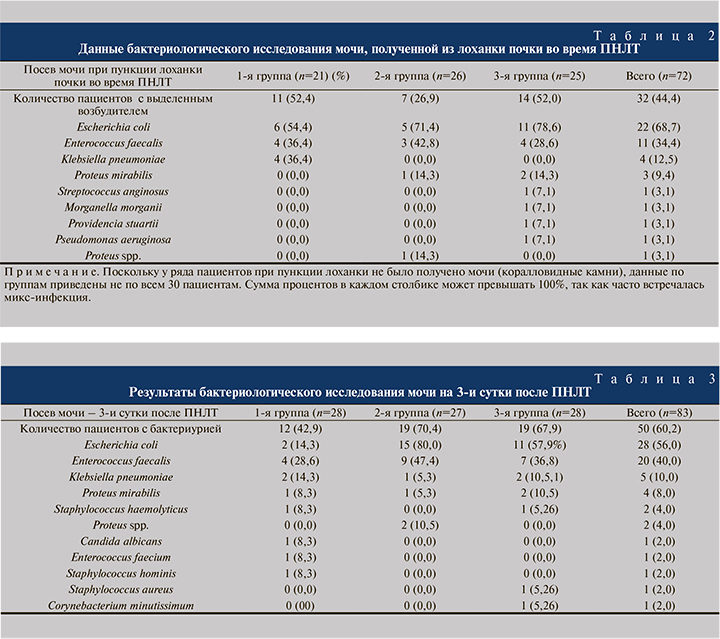
При межгрупповом сравнении температуры тела на 1-е сутки получены статистически значимые различия между 1-й и 2-й группами (p=0,0160). Показатели температуры тела за 1-е сутки у пациентов 2-й группы были ниже (медиана – 36,8°С), чем в 1-й (медиана – 37,5°С). При межгрупповом сравнении температуры тела на 3-и и 7-е сутки статистически значимых межгрупповых различий не выявлено (р=0,05; рис. 3).
Согласно данным бактериологического анализа мочи, на 3-и сутки после операции бактериурия в 1-й группе имела место в 42,9% случаев, во 2-й – в 70,4%, в 3-й группе – в 67,9% (табл. 3); на 7-е сутки – в 35,7, 65,2 и 46,4% случаев соответственно (табл. 4).
Таким образом, снижение послеоперационной бактериурии было наиболее выраженным в 1-й группе, где применяли ципрофлоксацин внутривенно в больших дозах (1000 мг) в течение всей ПНЛТ и далее в послеоперационном периоде. Одной дозы 1,5 г цефотаксим/сульбактама в качестве периоперационной профилактики недостаточно для снижения риска развития бактериурии после операции, но достаточно для профилактики послеоперационных инфекционных осложнений, в том числе ССВР. Применение пиобактериофага поливалентного, очищенного в качестве препарата для профилактики послеоперационных инфекционных осложнений ССВР является достаточным. Несмотря на увеличение числа пациентов с бактериурией (67,9%), на 3-и сутки после операции отмечалось снижение пациентов с бактериурией к 7-м суткам, которое практически соответствовало исходным цифрам до операции (46,4 против 46,7%), что можно объяснить медленным развитием вирусной инфекции среди бактерий (табл. 5).
Обсуждение результатов. В целом из инфекционно-воспалительных осложнений после ПНЛТ во всех трех группах пациентов в раннем послеоперационном периоде мы отметили только развитие ССВР. Ни в одном случае послеоперационный период не осложнился развитием острого пиелонефрита, сепсиса. Из 90 пациентов ССВР отметили 20 (22%) человек. В 1-й группе указанное осложнение диагностировали у 8 (26,6%) человек; во 2-й – у 6 (20%), в 3-й группе – также у 6 (20%).
Среди факторов риска развития инфекционных осложнений можно отметить наличие сахарного диабета у 2 пациентов 1-й группы (6,6%) и у 4 (13,3%) – 3-й. Нежелательных побочных действий лекарственных препаратов ни в одной из групп отмечено не было.
Несмотря на различие методов послеоперационного ведения пациентов: внутривенное введение ципрофлоксацина в течение 3–5 дней; пероральный прием пиобактериофага 3–5 дней и ведение пациентов 2-й группы без антибактериальной терапии в течение 3–5 дней после операции (кроме тех, у кого развился ССВР), к 4 –7 -м суткам после ПНЛТ во всех 3 группах пациентов отмечена нормализация показателей крови (лейкоциты, палочкоядерные нейтрофилы), температуры и общего самочувствия. В то же время мы отметили значительные различия в частоте бактериурии, особенно на 3-и и 7- е сутки после ПНЛТ в трех исследуемых группах. Бактериологический анализ мочи с определением чувствительности выделенного микроорганизма к антибиотикам является обязательным исследованием перед эндоскопическими оперативными вмешательствами по поводу камней почек. Однако не всегда данный анализ коррелирует с результатами микробиологического исследования камня (взятого во время дробления). В 1–3% случаев уросепсис развивается у пациентов без бактериурии [1]. Последняя является наиболее распространенным осложнением после оперативных вмешательств по поводу мочекаменной болезни.
Основные причины бактериальной контаминации после ПНЛТ:
- поступление бактерий с кожи и слизистых оболочек;
- восходящее инфицирование по катетерам и дренажам;
- поступление микроорганизмов при использовании нестерильной ирригационной жидкости, инструментария (особенно оптики, которую трудно дезинфицировать), не одноразовых проводников и т.д.;
- высвобождение бактерий (эндотоксина) из биопленок внутри камней при дроблении конкрементов;
- длительность оперативного вмешательства, а также повышение среднего внутрилоханочного давления [5].
Выявление и лечение предоперационной бактериурии, соблюдение соответствующих принципов периоперационной профилактики и послеоперационного ведения таких пациентов могут предотвращать развитие ИМП и минимизировать риск развития уросепсиса после оперативного вмешательства [6]. В то же время отсутствие бактериурии в моче не может быть показателем отсутствия инфекции в камнях почки. Более того, бывают ситуации, когда у пациентов с крупными и коралловидными камнями почек не совпадают возбудители, выявленные при бактериологическом исследовании средней порции мочи до операции и в моче, взятой непосредственно из лоханки почки во время ее пункции [7].
В нашей ранней работе [8] при сравнении данных бактериологического анализа мочи из лоханки и посева камня несоответствие результатов констатировали в 23,6% случаев. При бактериологическом исследовании камней почек микроорганизмы выявлялись чаще (53,6%), чем при исследовании мочи из лоханки почки во время ее пункции (46,4%).
У пациентов с конкрементами мочеточников, которым выполняли контактную уретеролитотрипсию, также было выявлено расхождение результатов бактериологического анализа мочи, посева конкремента, а также мочи, полученной из проксимального отдела мочеточника [9]. Бактериемия наблюдалась у 19% пациентов, из них у 58% развился ССВР. Положительный посев камня получен в 25% случаев, в моче из лоханки почки – в 66,7%, в то время как ни у одного из этих пациентов не было положительного бактериологического посева мочи до операции (р=0,04).
В работе [10] у пациентов, перенесших контактную уретеролитотрипсию, также имело место расхождение результатов посева средней порции мочи до операции (7%) и камня (29%). Сепсис развился у 3–4% пациентов, из них у 8% человек с положительными результатами бактериологического исследования камня и только у 1% пациентов результат исследования камня был отрицательным.
Таким образом, роль предоперационной бактериурии перед ПНЛТ как фактора риска послеоперационных инфекционно-воспалительных осложнений неоднозначна.
Огромное значение имеют соблюдение санитарно-гигиенических требований во время ПНЛТ, использование одноразового инструментария, стерильной ирригационной жидкости, длительности операции.
По нашим данным, одной дозы цефотаксима/сульбактама, 1,5 г за 60 мин до ПНЛТ, достаточно для профилактики инфекционно-воспалительных осложнений в раннем послеоперационном периоде, однако развитие послеоперационной бактериурии требует дальнейших исследований необходимости продолжения антимикробной терапии в раннем послеоперационном периоде.
Применение ципрофлоксацина в дозе 1000 мг внутривенно в течение всей ПНЛТ эффективно в плане профилактики инфекционно-воспалительных осложнений в раннем послеоперационном периоде. Продолжение лечения ципрофлоксацином в течение 3–5 дней после операции позволило снизить уровень бактериурии с 42,9 до 35,7%, однако рост резистентности к фторхинолонам (до 70% среди внутрибольничных уропатогенов) и запрет на их применение в качестве антибактериальной профилактики из-за серьезных нежелательных побочных действий во всем мире ограничивают применение фторхинолонов в качестве препаратов для антибактериальной профилактики инфекционных осложнений ПНЛТ.
Пиобактериофаг поливалентный, очищенный в дозе 40 мл перорально за 60 мин до ПНЛТ, назначенный строго по чувствительности к нему уропатогенов, – эффективный и безопасный антимикробный препарат для профилактики инфекционных осложнений после ПНЛТ в раннем послеоперационном периоде. Продолжение лечения пиобактериофагом пациентов после ПНЛТ (40 мл 3 раза в день перорально) постепенно снижает уровень бактериурии.
Заключение. Поиск наиболее эффективной методики периоперационной антимикробной профилактики, а также конкретного препарата при ПНЛТ показал, что при применении антибиотиков группы хинолонов (ципрофлоксацин), либо ингибиторозащищенного цефалоспорина (цефотаксим/сульбактам), или препарата бактериофагов (пиобактериофаг поливалентный очищенный) серьезных инфекционно-воспалительных осложнений в раннем послеоперационном периоде не возникло. Развитие ССВР после ПНЛТ на 1–3-и сутки после операции (у 26,6%, 20 и 20% пациентов 1-й, 2 и 3-й групп соответственно) нельзя соотносить только с использованными антимикробными препаратами и методом их введения (внутривенно, внутримышечно и перорально). Скорее всего, развитие ССВР больше связано с операционной травмой.



