Успешный результат оперативного лечения детей с врожденным мегауретером может быть достигнут с помощью открытого лапароскопического везикоскопического или эндоскопического доступа. Вышеупомянутые доступы имеют свои преимущества и могут быть использованы в любом возрасте [1]. В настоящее время разработано множество интра- и экстравезикальных способов формирования уретероцистоанастомоза при мегауретере у детей, основным принципом которых является устранение препятствия току мочи и создание корректного антирефлюксного механизма. Реимплантация, или реимплантация мочеточника, – изящный оперативный метод, который уже более 50 лет применяется в детской урологии. Имеются различные авторские методики пересадки мочеточника, в каждой из них есть свои преимущества и недостатки. Одной из самых популярных методик является транстригональная пересадка мочеточника по методике Коэн. При этой методике подслизистый туннель создается в поперечном направлении в контрлатеральную сторону [2–4].
Ежегодно публикуется новая информация о преимуществах и недостатках хирургических доступов и методик антирефлюксных операций у детей, что приводит к появлению «золотых» стандартов в коррекции мегауретера. В то же время на сегодняшний день подход к лечению пациентов с обструкцией уретеровезикального соустья должен быть обоснован с точки зрения структурных и функциональных изменений верхних мочевыводящих путей, минимизирован в отношении оперативной активности, приемлем для родителей и детей в вопросах этапности и социальной адаптации. Конечной целью оперативного вмешательства на органах мочеполовой системы является исключение рецидивирующего пиелонефрита и предупреждение образования новых очагов нефросклероза при минимизации осложнений, связанных с оперативным вмешательством [5]. Успех оперативной коррекции можно констатировать как по результатам лабораторного и клинического течения заболевания в послеоперационном периоде, так и при рентгенологическом обследовании (цистография, экскреторная урография) [6]. Окончательная оценка результатов оперативного лечения с использованием выбранного доступа и метода коррекции возможна не ранее 12–24 мес. после операции [7, 8].
К сожалению, иногда в связи с неэффективностью или осложнениями первичной уретеронеоцистостомии встает вопрос о необходимости повторной реимплантации мочеточника. В подобной ситуации приходится сталкиваться при открытых классических операциях с техническими трудностями мобилизации тазового отдела мочеточника, что обусловлено как рубцовыми изменениями в паравезикальном пространстве, так и дефицитом длины мочеточника [9, 10].
В таких ситуациях, по нашему мнению, с учетом персонифицированного подхода возможно использование гибридного способа, включающего лапароскопическую оценку состояния мочеточника, его мобилизацию и этапа открытой реимплантации. Данная тактика использована нами у четырех пациентов.
Приводим клиническое наблюдение. В отделении детской хирургии НПЦ специализированной медицинской помощи детям им. В. Ф. Войно-Ясенецкого с 2021 по 2022 г. гибридный доступ был применен у 4 детей (лапароскопическая мобилизация мочеточника [уретеролиз], формирование уретеро-уретероанастомоза, открытая транстри-гональная реимплантация) при рецидиве врожденного мегауретера после первичной реконструктивной операции. У всех детей показанием к проведению гибридного доступа был рецидив мегауретера после многократных оперативных вмешательств, а также дефицит длины мочеточника.
Все представленные дети были мужского пола в возрасте от 1 года до 3 лет 10 мес., средний возраст составил 2 года 1 мес. У всех детей был рецидив обструкции на уровне уретеровезикального сегмента после ранее проведенных открытых и эндохирургических вмешательств. Длительность наблюдения после первичной операции составила от 6 мес. до 2 лет (табл. 1). Во всех наблюдениях первичный обструктивный мегауретер был заподозрен при выполнении пренатального УЗИ скрининга.

В первом случае при выполнении рентген-урологического обследования диагностирован рефлюксирующий мегауретер, и в с связи развитием фебрильной инфекции в возрасте 14 сут. жизни (с.ж.) выполнена операция по формированию концевой уретерокутанеостомы слева, а через 5 мес. проведена внепузырная уретероцистонеоимплантация мочеточника.
Во втором наблюдении при наличии расширения полостной системы почки (лоханка – 25 мм, паренхима – до 5 мм с сохранным кровотоком, мочеточник в дистальном отделе – до 10–12 мм) проведена пункционная нефростомия и бужирование устья мочеточника без оставления катетера-стента или интубатора в дистальном отделе скомпрометированного мочеточника.
У третьего пациента с единственной почкой справа и мегауретером (обструктивным на фоне стеноза) выполнено бужирование устья с формированием обратной Т-образной уретерокутанеостомы.
Четвертый пациент был обследован и радикально оперирован в связи со стенозом дистального отдела мочеточника слева в возрасте 5 мес. с применением лапароскопического эндовидеохирургического доступа. Период наблюдения после удаления стента внутреннего дренирования осложнился блоком почки, что потребовало дренирования полостной системы при помощи нефростомии, развитием фибрильной инфекции, связанной с пузырно-мочеточниковым рефлюксом высокой степени, подтвержденным при выполнении цистографии через 5 мес.
Все вышеописанные пациенты нуждались в проведении повторных реконструктивно-пластических операциях, направленных на восстановление уродинамики (проходимости верхних мочевыводящих путей). Однако, принимая во внимание ранее выполненные операции и дефицит длины мочеточника, по результатам обследования принято решение о гибридном доступе.
Предоперационное обследование выполнено стандартно всем пациентам и включило ультразвуковое исследование (УЗИ) с допплерографией, включая оценку степени расширения мочевыводящих путей в зависимости от объема мочевого пузыря, цистографию, экскреторную урографию, радионуклидное исследование почек (статическая или динамическая нефросцинтиграфия), магнитно-резонансную (МР)-урографию или компьютерную томографию (КТ) с контрастированием при необходимости. Также обязательным исследованием являлась цистоуретроскопия для оценки локализации неоустья, характера изменений слизистой мочевого пузыря в области интереса после ранее выполненного вмешательства, исключения клапана задней уретры.
В трех наблюдениях на первом этапе гибридной операции выполнялась лапароскопическая мобилизация мочеточника на протяжении с сохранением его кровоснабжения. В одном наблюдении подобная тактика сопровождалась эндовидеохирургическим формированием уретеро-уретероанастомоза с резекцией стомированного участка.
Преимущество лапароскопического доступа в данном случае заключалось в том, что мы получили возможность визуально оценить структурные изменения в мочеточнике по его внешнему виду, характеру кровоснабжения, диаметру, способности к перистальтике, степени натяжения после резекционной операции, а также характер и протяженность рубцовых изменений.
Лапароскопический этап оперативной коррекции начинался в положении пациента на спине с подложенным валиком под поясничную область. После установки традиционным открытым способом троакара в области пупочного кольца под контролем лапароскопа выполнялась установка двух манипуляционных троакаров (рис. 1). Визуализировались мочевой пузырь и мочеточник, выполнялось вскрытие париетальной брюшины с мобилизацией тазового отдела мочеточника.
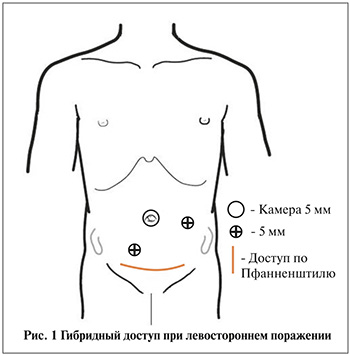
Этап открытой операции включал доступ по Пфанненштилю с созданием механизма антирефлюксной защиты в поперечном направлении.
Выбор открытого доступа был связан с необходимостью надежной внепузырной фиксации мочеточника во избежание экстравезикализации и созданием тоннеля адекватного диаметра и длины для воссоздания механизма антирефлюксной защиты с соблюдением основных принципов операции, предложенных автором.
Этап открытой операции включал доступ по Пфанненштилю с обнажением передней и частично задне-боковой стенок мочевого пузыря в проекции мобилизованного дистального отдела мочеточника. Мочевой пузырь вскрывался в поперечном направлении после перевязки и пересечении мочеточника. По заднебоковой поверхности мочевого пузыря снаружи внутрь выполнялся разрез, далее мочеточник проводился в его просвет и формировался уретероцистоанастамоз в поперечном направлении к противоположному устью.
Подслизистый тоннель был сформирован параллельно и выше межмочеточникового валика путем инъекционного подслизистого введения физиологического раствора с целью предотвращения повреждения слизистой мочевого пузыря при сепарации.
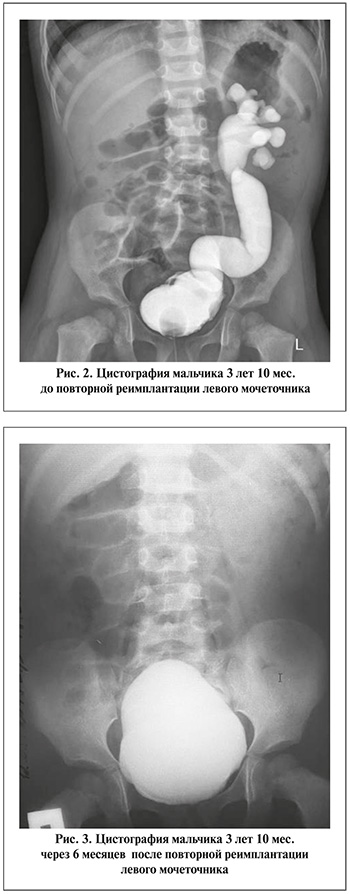
Мочеточник проводили в созданный тоннель и анастомозировали со слизистой мочевого пузыря, эвагинируя на 1–2 мм. Артифициальное устье фиксировали отдельными узловыми швами (PDS 6.0). Дефект слизистой в области входа в мочевой пузырь ушивали. Для адекватного оттока мочи и предотвращения несостоятельности анастомоза мы применяли высокие мочеточниковые Double-J-стенты, которые устанавливали после формирования неоустья. Длину стента определяли предварительно по результатам рентгеноурологических исследований. Операцию заканчивали дренированием мочевого пузыря катетером Фоллея, диаметр катетера определялся согласно возрасту ребенка. Катамнестическое обследование выполняли через 6 мес. (рис. 2, 3).
Длительность оперативного вмешательства с использованием гибридного доступа на уретеро-везикальном соустье в среднем составила 3 ч 22,5 (±15) мин. Объем кровопотери во всех наблюдениях был минимальный – до 10 мл. Всем детям в раннем послеоперационном периоде были назначены антибактериальная инфузионная обезболивающая терапия и пробиотики. Для предупреждения развития болевого синдрома после операции использовалась эпидуральная анестезия в течение 3 сут. после вмешательства. Длительность дренирования нижних мочевыводящих путей уретральным катетером определялась окончанием гематурии и в среднем не превышала 5 дней. Средняя продолжительность пребывания пациентов в стационаре после оперативного лечения составило 7 дней. Обследование в послеоперационном периоде включало стандартную лабораторную диагностику: общий анализ крови и мочи, оценку показателей кислотно-щелочного состояния (КЩС), бактериологическое исследование мочи. Инструментальная диагностика в виде УЗИ почек и мочевыводящих путей выполнялась на уретральном катетере в 1-е сутки после операции и после его удаления на 6–7-е сутки при восстановлении самостоятельного мочеиспускания.
В амбулаторных условиях пациентам проводилась энерготропная терапия (витамины группы В, Q), физиотерапевтическое лечение, направленное на улучшение трофики и сократительной активности мочевыводящих путей. Уретеральные стенты были удалены через 1 мес.
При катамнестическом наблюдении за детьми анализы мочи были без воспалительных явлений, бактериологическое исследование мочи выполнялось каждый месяц. Эпизодов дизурии как в раннем, так и в позднем послеоперационном периодах отмечено не было.
Цистография проведена всем пациентам в сроки 6–8 мес. после радикальной реконструктивной операции в условиях стационара. Пузырно-мочеточниковый рефлюкс не визуализировался ни в одном наблюдении.
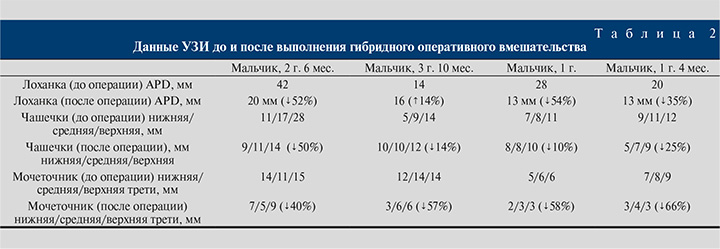
При катамнестическом обследовании по данным УЗИ почек через 12 мес. после операции отмечено сокращение размеров лоханки в среднем на 47%, в одном наблюдении отмечено незначительное нарастание размеров лоханки (на 2 мм) без клинических проявлений. У всех детей имело место сокращение размеров чашечек, и стоит отметить, что у всех пациентов верхняя группа чашечек имела максимальное увеличение по сравнению с нижней и средней группами. Во всех наблюдениях отмечено сокращение чашечек в среднем на 25%. Увеличение толщины паренхимы также было отмечено у всех детей в среднем на 2,5–5,0 мм. Также отмечен положительный эффект в виде значительного сокращения размеров мочеточника. Следует отметить, что мочеточник показал наиболее выраженный эффект в виде сокращения диаметра по всем цистоидам и в среднем составил уменьшение размера более 50% (табл. 2).
За последнее десятилетие произошло смещение в сторону более персонифицированного подхода к каждому пациенту. Избирательный подход к оперативному лечению детей с рецидивами и осложнениями после реконструктивно-пластических операций является одной из главных задач в детской урологии.
Повторная реимплантация мочеточника при мегауретере у детей сложная задача, которая нередко сопряжена со значительными техническими трудностями, обусловленными поиском и выделением из окружающих тканей тазового отдела мочеточника. Нередко возникает необходимость дополнительной мобилизации из-за его недостаточной длины и успешной реимплантации. В таких ситуациях лапароскопический этап позволяет не только оценивать состояние мочеточника, но и значительно облегчает его мобилизацию, делая ее малотравматичной. Кроме того, в ситуации наличия у пациента уретерокутанеостомы позволительно произвести ее закрытие. Подобный подход создает предпосылки к успешной реимплантации и созданию адекватного антирефлюксного механизма на открытом этапе операции.
Таким образом, гибридный способ может быть рассмотрен как метод выбора при проведении повторной реимплантации мочеточника при мегауретере у детей с учетом всех перечисленных выше позиций.



