Введение. Протокол Fast-Track – инновационная концепция мультимодального периоперационного ведения больного, предложенная датским хирургом H.Kehlet (2002) и направленная на минимизацию стресс-ответа на хирургическое вмешательство, восстановление исходного физического состояния организма и функции органов, на достижение полной и скорейшей реабилитации. Цель протокола Fast-Track: высокое качество реабилитации пациента, а не быстрая его выписка. Главная задача протокола – подавить стресс-ответ или системные изменения вследствие операции: нейроэндокринные (гиперсимпатикотонию вследствие выделения стресс-гормонов гипофиза; метаболические (гиперкатаболизм, гипергликемию); воспалительные (цитокины, синдром воспалительной реакции); иммуносупрессивные [1–3]. Нескорригированные явления стресс-ответа приводят к замедлению восстановления и увеличению количества послеоперационных осложнений. Ни один из известных методов общей анестезии (ОА) не способен полноценно блокировать прохождение ноцицептивных импульсов ни на спинальном, ни даже на супраспинальном уровне и не предотвращает развития ответной реакции на хирургический стресс [1]. Сбалансированная регионарная анестезия (РА) в педиатрии рассматривает блокады не как альтернативу общей анестезии (ОА), а как дополнение к последней, позволяя значительно уменьшать концентрацию и дозировки ингаляционных, а также системных анестетиков и опиоидов [4–6]. РА входит в обязательный компонент технологии Fast-Track. РА является наиболее эффективным способом прерывания (торможения) ноцицептивной информации на периферическом нейрональном и спинальном уровнях [2].
Для ее выполнения в педиатрии обязательно необходимы знание анатомо-физиологических возрастных особенностей, практических навыков, знание и профилактика возможных осложнений [4–6].
Цель исследования: внедрение концепции Fast-Track с изучением системной гемодинамики и маркеров стресса на периоперационном этапе лечения детей с урологическими заболеваниями.
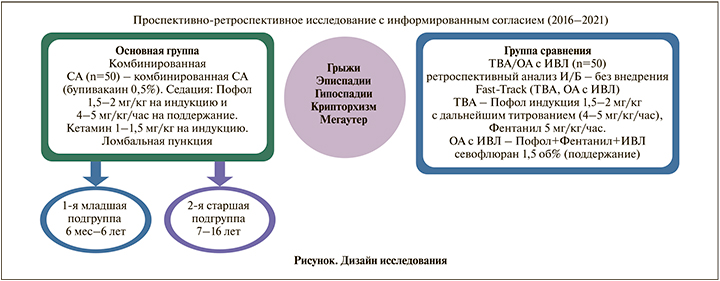
Материал и методы исследования: проспективно-ретроспективное исследование с информированным согласием родителей (09.2016–04.2021) (см. рисунок). В исследование вошли пациенты с заболеваниями урологического профиля: с паховыми грыжами, эпи- и гипоспадией, крипторхизмом, мегауретером. Основная группа (n=42) – пациенты, в отношении которых использовалась комбинированная СА (бупивакаин 0,5%): младшая – 6 мес.–6 лет (n=29) и старшая подгруппы – 7–16 лет (n=21). В качестве седации применялся Пофол (см. везде) 1,5–2 мг/кг на индукцию и 4–5 мг/кг/ч на поддержание с кетамином 1–2 мг/кг на индукцию. Пациентам выполнялась люмбальная пункция в положение лежа на операционном столе. Вторая группа больных – группа сравнения (n=50) по ретроспективному анализу – без внедрения Fast-Track (тотальная внутривенная анестезия (ТВА), общая анестезия (ОА), ТВА – Пофол в индукционной дозе 1,5–2 мг/кг с дальнейшим титрованием (4–5 мг/кг/ч), фентанил в дозе 5 мкг/кг/ч. ОА с ИВЛ – Пофол+фентанил+ИВЛ севофлюран 1,5 об% (поддержание). Распределение пациентов по группам представлено в табл. 1. Все 92 (100%) исследуемые пациента – мальчики. Средняя продолжительность операции – 84±9,7 мин. С целью интраоперационного мониторинга центральной гемодинамики, биохимических маркеров стрессовой реакции проводилось изучение уровня кортизола (методом электрохемилюминесцентного иммуноанализа на аппарате Immulite 2000XPi «Siemens Heailcare Diagnostics Inc.»), глюкозы (фотометрическим методом на аппарате Biossays 240 Plus). Частота сердечных сокращений (ЧСС), артериальное давление (АД), общее периферическое сосудистое сопротивление (ОПСС) и минутный объем кровообращения (МОК) регистрировали неинвазивным ЭхоКГ-методом (на аппарате APLIO 500 TOSHIBA). Показатели определяли на следующих этапах: при поступлении в операционную, в наиболее травматичный момент операции, непосредственно перед переводом ребенка в ОРИТ, в ОРИТ через 1 сут.
В младшей подгруппе СА пункцию субарахноидального пространства проводили в положении больного на боку на уровне L4–L5 под индукцией Пофола и микродоз кетамина (1–1,5 мг/кг). Длительность операции составила 74±15,4 мин. В старшей подгруппе СА пункцию субарахноидального пространства проводили в положении больного ребенка на боку на уровне L2–L3 под индукцией Пофола и микродоз кетамина. Длительность операции составила 87±12,3 мин. Нами были использованы иглы Пенкан с карандашной заточкой и иглы Спинокан со срезом Квинке 25G и 25G.
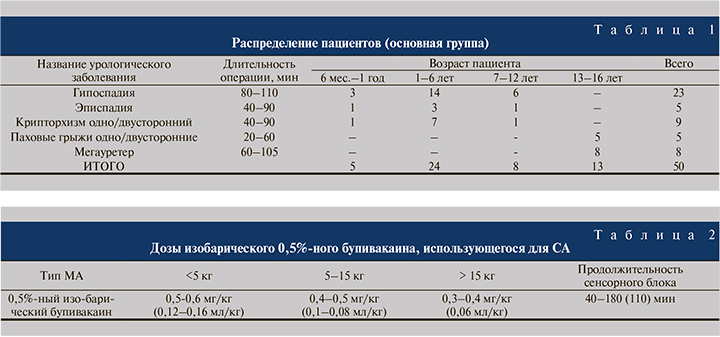
Дозы использованного в исследовании изобарического 0,5%-ного бупивакаина в зависимости от веса ребенка указаны в табл. 2.
Результаты и их обсуждение. Внедрен локальный протокол Fast-Track в различные периоды периоперационного этапа у детей с урологическими заболеваниями.
Предоперационный период:
1. Выбор пациента (возраст, ASA I–II без тяжелых сопутствующих заболеваний).
2. Информирование пациента (его родителей или законных представителей) средним медицинским персоналом, включенным в программу Fast-Track, об особенностях периоперационного периода; предоставление информации об объеме и характере хирургических и анестезиологических манипуляций, возможных послеоперационных осложнениях, их профилактике и терапии.
3. Отказ от рутинной подготовки толстой кишки.
4. Отказ от длительного предоперационного голодания (прозрачные жидкости с углеводами за 2 ч, грудное молоко за 4 ч до операции).
5. Антибиотикопрофилактика за 1 ч до операции (цефалоспорины 1–2-го поколений).
6. Премедикация: мидозолам+атропин внутримышечно.
Интраоперационный период:
7. Нормоволемия. Интраоперационная инфузия. В среднем 11,5±1,2 мл/кг/ч в старшей подгруппе СА; 9,3±1,7 мл/ кг/ч в младшей подгруппе СА. Кристаллоидные растворы (Рингер лактат, физиологический раствор 0,9%).
8. Комбинированная СА с сохраненной спонтанной вентиляцией:
- Бупивакаин 0,5% изобарический 0,3–0,4 мг/кг (0,5–0,6 мг/кг).
- Поддержание седации: Пофол 4–5 мкг/кг/ч инфузионно. Показания пульсоксиметрии сохранялись на уровне 96–99% при спонтанном дыхании воздухом, обогащенным потоком кислорода, – 4 л/мин.
9. Нормотермия
10. Отсутствие опиоидов. Ни одного случая перехода на другой вид анестезии. Интраоперационная анестезия была адекватной в течение 2,5–3,0 ч.
Послеоперационный этап:
11. После операции 1-е сутки – назначение Парацетамола 15 мг/кг 2 раза/сут. в/в (по требованию пациента, 48%).
12. Переход на пероральные анальгетики со 2-го дня (при необходимости, 42%).
13. Мультимодальная терапия анальгетиками (по требованию): Парацетамол 250–500 мг перорально 4 раза/сут. и/ или Кеторолак трометамин 1 мг/кг.
14. Индивидуальная коррекция инфузионной терапии в зависимости от возможных потерь в ближайшем послеоперационном периоде. Сбалансированные кристаллоиды 4–6 мл/кг/ч в первые сутки.
15. Раннее энтеральное питание.
16. Период госпитализации составил в среднем 38,0±1,9 ч.
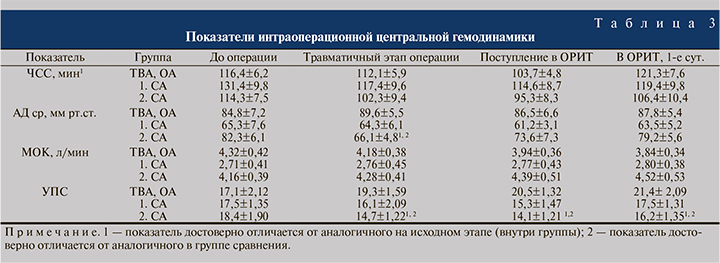
Интраоперационный анализ центральной гемодинамики (табл. 4) показал, что на фоне ТВА и/или ОА с ИВЛ у детей регистрировалось увеличение УПС на 12,8%. В старшей подгруппе СА гемодинамические реакции на операции характеризовались значимым уменьшением УПС и снижением АД на 20,2 и 19,7% соответственно от исходного. В этой подгруппе вазодилатация приводила к умеренной гипотонии, хотя и не влияла на МОК, в то время как в младшей подгруппе на фоне СА отмечалась гемодинамическая стабильность (незначительное снижение УПС не отражалось на уровне АД). Стабильность гемодинамики при СА у детей раннего возраста имеет доказательную базу [8–10] и физиологическое объяснение.
Для пациентов данной возрастной категории характерна незрелость симпатического отдела вегетативной нервной системы.
Изменения маркеров стрессовой реакции на фоне различных методов анестезии выявило более выраженный стресспротекторный эффект при СА, чем при применении ТВА/ ОА с ИВЛ. Уровень кортизола по сравнению с дооперационными значениями повысился на 48% в группе ТВА/ОА с ИВЛ и 4– 6% – в подгруппах СА. На этом фоне снизилась и стресс-индуцированная гипергликемия при СА: концентрация глюкозы не повышалась выше 6 ммоль/л.
Пациенты, прооперированные в условиях комбинированной СА, в течение всей операции и анестезии находились на самостоятельном дыхании. На этапе премедикации в 100% наблюдений отмечено тахипное во всех подгруппах. В последующем выявлено однонаправленное достоверное снижение ЧД: после спинальной пункции в подгруппах СА на 20,6 и 20% соответственно (р<0,05), на травматичном этапе операции на 23,6 и 23% соответственно (р<0,001), пробуждение и перевод – 24,5 и 21,7% соответственно (р<0,001). Брадипного и гипоксии не отмечено. Показания пульсоксиметрии сохранялись на уровне 96–99% при спонтанном дыхании воздухом, обогащенным потоком кислорода, – 4 л/мин.
На этапе пробуждения пациенты основной группы через 10–20 мин после операции были транспортированы в профильное отделение. Осложнений, связанных с СА, не отмечено. Продолжительность остаточной анальгезии после СА составила 305±64 мин. В 1-е сутки и в последующем периоде введения опиоидов с целью обезболивания не потребовалось. Больные группы сравнения, которым проведена ОА с ИВЛ (n=25), были транспортированы в ОРИТ. Экстубация проведена в 80% наблюдений на операционном столе. В 20% наблюдений дети переведены в ОРИТ на продленную ИВЛ (одновременные многоэтапные гипоспадии) длительностью 48±19 мин. В среднем через 92±27 мин возникала необходимость в обезболивании опиоидами или нестероидными противовоспалительными средствами (НПВС). Осложнений, обусловленных ОА, не было.
Критерии выписки из стационара: пероральное питание в полном объеме, удовлетворительные лабораторные показатели, удаление дренажей (кроме катетера в уретре при гипоспадиях), отсутствие болевого синдрома и послеоперационных осложнений, требующих стационарного лечения, а также возможность проводить дальнейший уход и реабилитацию в амбулаторных условиях.
Выводы
1. Проведенные исследования показали, что применение комбинированной СА при вышеуказанных урологических операциях у детей позволяет эффективнее и надежнее, чем при ТВА/ОА с ИВЛ, предотвращать и купировать проявления стресс-индуцированных реакций гемодинамики и метаболизма. У пациентов группы сравнения отмечено нарастание симпатикотонии на этапах исследования.
2. Быстрое восстановление сознания и активизация ребенка после комбинированной СА, сохранение остаточной аналгезии до 6 ч, благоприятный психоэмоциональный фон способствовали стабильному протеканию раннего послеоперационного периода без опиоидов.
3. Внедрение технологии Fast-Track в детскую урологию позволило сократить период послеоперационного восстановления и длительность пребывания данной категории больных в медицинском учреждении в среднем до 38,0±1,9 ч.



