Введение. Пузырно-маточные свищи (ПМС) – это редко встречающееся заболевание, в связи с чем врачи испытывают трудности в адекватной диагностике и лечении. Причиной развития данного заболевания в 83–93% является кесарево сечение (КС) [1]. Необходимо отметить, что чаще ПМС развивается при нижнесегментарном доступе, а каждое последующее КС увеличивает риск развития заболевания на 30% [2, 3]. Интересно знать, что с XIX в. по 1997 г. было диагностировано всего 796 ПМС во всем мире, что подтверждает ограниченное число наблюдений и отсутствие достаточного количества данных для полноценного мета-анализа и разработки точных алгоритмов диагностики и лечения пациенток. Необходимо отметить, что большинство данных мировой литературы по проблеме ПМС содержит демонстрацию отдельных клинических наблюдений либо крайне малую выборку больных [4, 5]. Стремительно растущее количество женщин с ПМС в последние десятилетия связано с расширением показаний и увеличением числа выполненных КС.
Заболевание характеризуется нефизиологическим сообщением между просветом мочевого пузыря и телом либо шейкой матки. Данное заболевание характеризуется не только патогномоничными проявлениями, но и достаточной социальной значимостью, в ряде случаев вызывая инконтиненцию, приводящую к стойкой медико-психологической дезадаптации пациенток и резкому нарушению качества жизни и бесплодию [6]. Среди всех урогенитальных фистул ПМС встречается с частотой от 1 до 16,4% [7, 8].
Впервые данное заболевание описал профессор Юссеф в 1957 г. и в мировой литературе обозначается как синдром Юссефа. В той же работе Юссеф описал основные клинические проявления, характерные для ПМС, которые остаются актуальными до сегодняшнего дня. Основной жалобой пациенток с данным синдромом является циклическая меноурия и аменорея. В своей работе автор описал причины отсутствия недержания мочи при данной патологии, он основывался на механизме сфинктер/клапан, локализующегося в перешейке матки [9]. Стоит отметить, что механизм инконтиненции при сообщении мочевого пузыря и тела матки был описан позже, который в своей основе имеет особенности физиологии менструального цикла. Установлено, что большую часть цикла внутриматочное давление выше, чем внутрипузырное, что и обусловливает подтекание мочи из шейки матки. И лишь малую часть цикла внутрипузырное давление выше внутриматочного, при котором у пациентки сохраняется функция удержания мочи и самостоятельного мочеиспускания [10]. Важное клиническое значение имеет нередкая хронизация инфекции мочеполовой системы и необходимость в длительных курсах антибактериальной терапии в периоды обострения [11, 12].
В 2000 г. Jóźwik и Jóźwik была предложена первая и до настоящего времени единственная специфичная классификация ПМС, которая позволяет стратифицировать пациенток на три группы по клиническим проявлениям.
В I тип предложено включать пациенток с аменореей и циклической меноурией без подтекания мочи. Таким образом, истинный синдром Юссефа можно отнести к I типу ПМС. Ко II типу относятся больные циклической меноурией с сохранением регулярных менструаций и присутствием недержания мочи, а III тип ПМС характеризуется только наличием подтекания мочи с сохранением регулярной менструации и отсутствием меноурии [13].
На сегодняшний день известно, что ПМС являются ятрогенными фистулами. Для минимизации рисков образования фистулы необходимо знать причины развития данного заболеания при выполнении КС, которые подробно описаны и включают [8, 14–17]:
1) Необнаруженный разрыв мочевого пузыря во время экстренного кесарева сечения. Часто происходит при начавшихся родах и сопряжено с неполной мобилизацией мочевого пузыря и недостаточной ревизией после родоразрешения.
2) Непреднамеренное прошивание стенки мочевого пузыря при наложении швов на стенку матки.
3) Нарушение кровоснабжения основания мочевого пузыря, которое развивается вследствие множества вмешательств, чаще имеет значение при повторных и последующих КС.
В литературе описаны и другие причины развития ПМС, к ним относятся затяжные роды, использование щипцов, родоразрешение через естественные пути после предыдущего КС, ручное извлечение плаценты, применение вакуум-экстрактора, предлежание плаценты, иссечение кисты Гартнера, лучевая терапия, травма таза, миграция внутриматочной спирали, передняя кольпорафия, абляция эндометрия, иссечение некротизированной фибромы матки, туберкулез, актиномикоз, поражение матки инвазией злокачественной опухолью [11, 18–21].
В одном клиническом наблюдении описан ПМС как следствие аномалии развития мочеполовой системы, а именно агенезией влагалища с циклической меноурией [22].
Диагностический поиск ПМС характеризуется патогномоничной клинической картиной, которая в преимущественном большинстве включает циклическую примесь крови в моче (меноурию), реже сопровождается аменореей. В случае наличия указанных выше факторов разницы внутриполостного давления матки и мочевого пузыря у пациенток отмечается недержание мочи. Стоит помнить, что описаны случаи отсроченного развития клинических симптомов через 30 лет после КС [23].
Дальнейшая верификация заболевания должна сопровождаться объективными методами обследования. Наиболее специфичным является уретроцистоскопия с хромогистерографией с введением контрастного препарата. Данный вид исследования позволяет оценить локализацию, размер, направление фистулы, а также исключить компрометацию устьев мочеточников с возможностью их одномоментного дренирования при наличии показаний. Менее специфичным, но достоверным методом является выполнение СКТ/МРТ (спиральной компьютерной томографии/магнитно-резонансной томографии) цистографии, по результатам которого можно не только оценить затек контрастного вещества в тело/шейку матки при тугом наполнении мочевого пузыря, но и оценить анатомию мочевыводящих путей, обозначить анатомические ориентиры для оптимизации оперативного лечения, а также исключить опухолевые поражения зоны оперативного интереса [8, 11, 24].
Консервативное лечение ПМС малоэффективно. Jówik и Jówik в своем обзоре литературы описали 41 наблюдение самостоятельного закрытия мочепузырно-маточной фистулы из 796, что составляет всего лишь 5,1%. Авторы описывают эффективность консервативной терапии в 28%, но для получения подобных результатов необходимо включать в подобную стратегию лечения пациенток с максимальным диаметром свища до 2 мм и в обязательном порядке проводить гормональную терапию с целью достижения медикаментозной аменореи (p<0,001) [4].
Золотым стандартом лечения ПМС является оперативное закрытие фистулы. В отсутствие лучевых поражений эффективность данной методики достигает 90% вне зависимости от доступа. При данном подходе есть возможно выполнять симультанные оперативные вмешательства, гистерэктомию, но только при наличии строго установленных показаний. Если стоит исключительная задача по закрытию свища и сохранению матки, в таком случае от превентивной экстирпации матки стоит воздержаться [24]. Описано предположение, что наилучшие результаты оперативного закрытия ПМС возможно достигнуть при работе смешанными бригадами с участием урологов и гинекологов [25].
Ранние и отсроченные результаты малоинвазивных видео-эндоскопических (лапароскопического, робот-ассистированного) доступов при фистулопластике ПМС не отличаются от открытой хирургии, но только при условии достаточного опыта хирургической бригады. Преимуществами лапароскопического и робот-ассистированного доступов являются малоинвазивность оперативного вмешательства; менее интенсивный болевой синдром, что в свою очередь ведет к уменьшению необходимости применения наркотических анальгетиков; меньшая кровопотеря с минимизацией вероятности переливания компонентов донорской крови; более контролируемые анатомические ориентиры, позволяющие проводить операцию более прецизионно; сокращает длительность госпитализации; снижает риски инфекционных осложнений послеоперационных ран; косметический вид. Недостатки подобного доступа: дорогостоящее оборудование, длительная кривая обучения специалистов, необходимость большого опыта в видеоэндоскопической хирургии и навыка интракорпорального шва [26–28]. Также описаны единичные наблюдения трансвагинальной реконструкции ПМС [29].
Цель исследования: оценить эффективность оперативного лечения ПМС с применением малоинвазивной техники.
Материалы и методы. В период с 2010 по 2021 г. в условиях ГБУЗ «Научно-исследовательский институт – Краевая клиническая больница № 1 им. профессора С. В. Очаповского» Минздрава Краснодарского края была выполнена фистулопластика ПМС 15 пациенткам. Возраст больных варьировал от 18 до 37 лет (μ=26,4 года). Определено среднее значение индекса массы тела – 26,3 кг/м2. Максимальный диаметр фистулы составил μ=10,7 мм ( от 2 до 25 мм). Преимущественной причиной развития ПМС явилось КС и определена в 93% (n=14). При этом после первичного КС свищ развился у 2 (13%) пациенток, после повторного КС – 33% (n=5) , и в 7 (47%) наблюдениях причиной развития фистулы явилось третье КС. Лишь в 1 (7%) наблюдении фистула развилась вследствие лучевого повреждения тканей. Пациентки были рандомизированы, согласно классификации Jóźwik и Jóźwik, по клиническим проявлениям. К I типу отнесены 4 (27%) пациентки, ко II типу – 9 (60%) больных, III тип определен у 1 женщины. Рецидивирующая инфекция мочевыводящих путей наблюдалась у 8 больных. Перед оперативным вмешательством все больные были санированы, согласно микробиологическому анализу мочи с чувствительностью к антибиотикам. Синдром хронической тазовой боли отмечался у 4 (27%) больных. У данной когорты болевой синдром не превышал 6 баллов по шкале ВАШ.
Больные были полноценно обследованы. Во всех клинических наблюдениях ПМС был верифицирован путем уретроцистоскопии и гистерографии с контрастным препаратом индигокармин 5% – 5 мл (рис. 1).
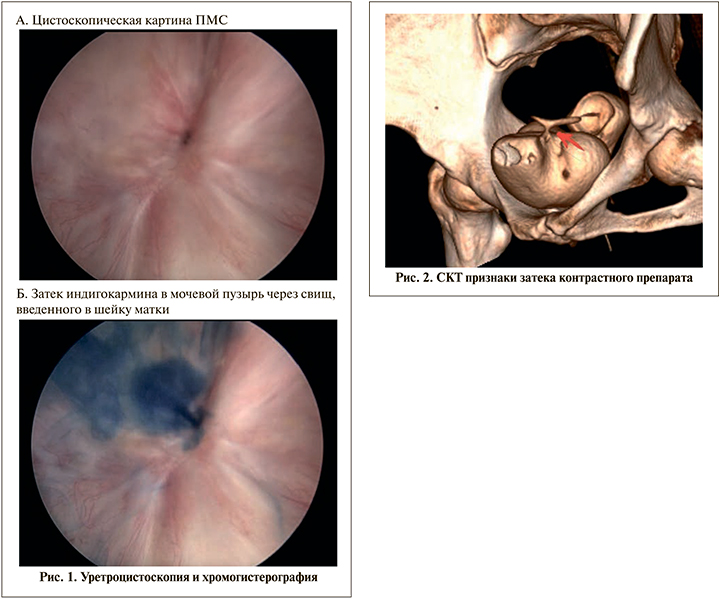
Исследование проводилось под внутривенной анестезией, в асептических условиях устанавливался уретральный катетер в цервикальный канал 10–12Fr, через который вводилось 5,0 мл 5%-ного раствора индигокармина и одномоментно выполнялась цистоскопия на объеме мочевого пузыря 200 мл. При введении индигокармина в полость матки из свища появлялась струйка красителя.
По данным СКТ либо МРТ цистографии, с тугим наполнением мочевого пузыря затек контрастного вещества в полость матки диагностирован в 12 (80%) случаях (рис. 2).
Всем пациенткам проведено оперативное закрытие мочепузырно-маточных фистул видеоэндоскопическим доступом. 33% (n=5) женщин были прооперированы с использованием робототехники, 67% (n=10) лапароскопическим подходом.
Как при роботической, так и при лапароскопической фистулопластиках троакары устанавливались в типичных точках для хирургии малого таза (рис. 3).
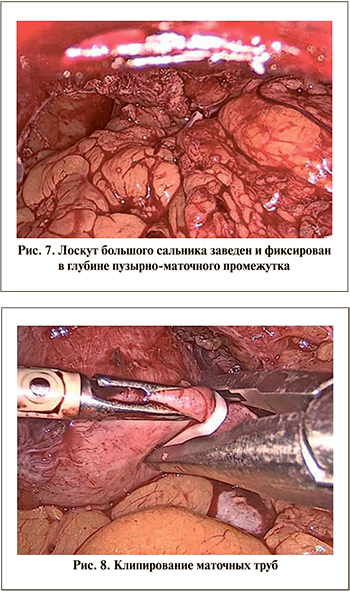
У всех пациенток, включенных в исследование, отмечался распространенный спаечный процесс брюшной полости и малого таза. Первым этапом производился адгезиолизис. Далее рассекалась париетальная брюшина в проекции пузырно-маточного перехода для широкой диссекции анатомических структур (рис. 4).
Во всех случаях мобилизация стенки мочевого пузыря и стенки матки производилась до визуализации ПМС (рис. 5) и далее циркулярно для возможности широкого иссечения рубцовых тканей. В 13 наблюдениях свищи локализовались в зоне нижнего сегмента матки, в двух – фистула располагалась в шейке матки. Для точной идентификации просвета полости матки в цервикальный канал устанавливался буж Гигара, что значительно облегчало точную локализацию и размер фистулы. После достижения достаточной мобилизации стенки мочевого пузыря и матки выполнялось парафистульное иссечение рубцовых тканей. В последующем производилось поэтапное раздельное ушивание дефекта матки и стенки мочевого пузыря двухрядным непрерывным швом нитью V-Loc 3/0 (рис. 6). После закрытия дефекта выполнялась проверка герметичности мочевого пузыря введением 200 мл физиологического раствора.
При обоих доступах соблюдались все принципы фистулопластики и оперативные вмешательства проводились по идентичным методикам. В 14 наблюдениях удалось мобилизовать лоскут большого сальника как материала для разграничения органов и предотвращения их контакта, что, по нашему мнению, является одним из основополагающих моментов профилактики рецидива заболевания (рис. 7). Далее проводилась санация брюшной полости и во всех случаях устанавливался дренаж в Дугласово пространство.
Результаты. Оценка результатов оперативного лечения проводилась на основании развития рецидивов в раннем и отсроченном послеоперационном периодах, а также по продолжительности оперативного вмешательства, госпитализации, степени болевого синдрома после операции и сроках дренирования мочевого пузыря.
Из 15 прооперированных пациенток рецидивов ПМС в объеме настоящего наблюдения не зарегистрировано ни в одном случае, период наблюдения составил от 4 нед.до 10 лет. Оценка проводилась по клиническим показателям восстановления циклической менструации, отсутствия меноурии, нивелирования недержания мочи при его наличии перед фистулопластикой, а также по герметичности мочевого пузыря при контрольной СКТ цистографии и с сохранением матки. Стоит отметить, что ни в одном наблюдении не были определены показания к гистерэктомии. Стерилизация была проведена двум женщинам по согласованию с ними. На момент операции у них было по три живых ребенка (рис. 8).
Средняя продолжительность оперативного вмешательства при робот-ассистированном подходе составила 118 мин (от 80 до 140 мин), при лапароскопическом доступе – 125,5 мин (100–160 мин); p>0,05. Средняя продолжительность госпитализации при роботическом доступе составила 5,2 дня (от 4 до 8 дней), при лапароскопическом – 6,7 дня (от 5 до 10 дней); p>0,05. Болевой синдром явился также статистически незначимым при сравнении доступов.
Интраоперационная кровопотеря у всех 15 больных не превышала 130 мл. При лапароскопическом доступе средний показатель составил 97 мл (от 50 до 130 мл), а при робот-ассистированном подходе – 82 мл (от 30 до 110 мл); p>0,05.
Таким образом, статистически значимой разницы в результатах фистулопластики ПМС между робот-ассистированным доступом и лапароскопическим не обнаружено.
Интраоперационных и послеоперационных осложнений по классификации Clavien–Dindo не наблюдалось в обеих группах данного исследования.
Обсуждение. Одним из наиболее важных результатов оперативного лечения ПМС является отсутствие рецидива заболевания и возможность сохранения матки. Изучив немногочисленные данные мировой литературы, нами были определены условия успешной фистулопластики, которые включают:
1. Адекватный адгезиолизис и мобилизацию стенки мочевого пузыря и матки.
2. Широкое разделение слоев.
3. Полноценное иссечение рубцовых тканей.
4. Послойное двурядное ушивание матки и мочевого пузыря.
5. Отсутствие натяжения по линии шва.
6. Герметичность швов.
7. Тонкий резорбирующийся шовный материал.
8. Достижение полного гемостаза.
9. Использование большого сальника в качестве межтканевого протектора.
Немаловажно помнить, что, несмотря на соблюдение всех вышеуказанных правил, основным условием удовлетворительного результата оперативного лечения ПМС остается достаточный опыт хирургической бригады в лапароскопической, роботической хирургии при вмешательствах на органы малого таза, свободное владение методиками как трансвезикальной, так и экстравезикальной фистулопластики.
В нашем наблюдении не определено статистически значимой разницы в результатах фистулопластики ПМС при лапароскопическом и робот-ассистированном доступах. С учетом вышесказанного возможно предположить, что выбор доступа должен определяться лишь предпочтением и наличием опыта оперирующего хирурга.
Оценив мнения и результаты лечения ПМС урогинекологов всего мира, мы определили возможность наступления беременности не ранее чем через 2 года после фистулопластики, однако решение о возможности беременности решается индивидуально с учетом хирургических особенностей при оперативном закрытии ПМС. При этом важно помнить, что, по мнению разных авторов, вероятность наступления беременности варьируется от 25 до 37,5% [8, 30].
В нашем наблюдении все пациентки были прооперированы одним хирургом с соблюдением всех принципов фистулопластики ПМС. Полученные нами результаты позволяют объективно утверждать прямую корреляцию опыта врача с отсутствием рецидива заболевания и возможностью сохранить матку при оперативном закрытии фистулы. Продолжительность оперативного вмешательства во многом зависела от выраженности спаечного процесса брюшной полости и малого таза, а также от распространенности рубцового процесса и различной протяженности интракорпоральных швов матки и мочевого пузыря.
Заключение. Результаты малоинвазивного видеоэндоскопического оперативного лечения ПМС не отличаются от открытой фистулопластики и напрямую зависят от своевременной диагностики, соблюдения сроков оперативного лечения, адекватной предоперационной подготовки пациентов, учета интраоперационных особенностей фистулопластики и опыта врача вне зависимости от вида доступа. Необходимо стремиться к сохранению матки в отсутствие абсолютных показаний к гистерэктомии и предлагать женщинам хирургическую стерилизацию при наличии высоких рисков рецидива ПМС при наступлении повторной беременности.



