По статистике, в последнее десятилетие на территории Европы и Северной Америки второе место по летальности среди онкологических заболеваний занимает рак предстательной железы (РПЖ). В России за тот же период заболеваемость выросла до 120,5% на 100 тыс. населения, при этом отмечено снижение среднего возраста первичного выявления заболевания [1]. Такая картина обусловлена не только естественным ростом заболевания, но и расширением перечня базовых методов диагностики. В данный момент к ним относятся пальцевое ректальное исследование (ПРИ), определение в сыворотке крови уровня простатического специфического антигена (PSA), трансректальное ультразвуковое исследование (ТРУЗИ) с последующим выполнением биопсии предстательной железы (ПЖ) [2].
Некоторое время наиболее точным диагностическим критерием РПЖ считался уровень ПСА, хотя повышение уровня этого органоспецифического маркера может сигнализировать о разнообразных заболеваниях предстательной железы, причем не обязательно о раке, а также просто быть следствием ранее проведенных манипуляций. При выявлении повышенного уровня PSA, положительных результатах ПРИ и обнаружении гипоэхогенных зон в ткани ПЖ по данным ТРУЗИ применяется разработанная в 1989 г. К. Hodge мультифокальная биопсия ПЖ под ультразвуковым контролем из 6 точек (так называемая секстантная биопсия), имеющая лучшие показатели выявляемости рака [3]. При этом число ложноотрицательных биопсий варьируется от 31,5 до 45% [4–6], тогда как частота обнаружения рака, по данным G. Guichard et al. [7], при 21-, 18-, 12- и 6-точечной биопсии составляет 42,5, 41,5, 38,7 и 31,7% соответственно.
В настоящее время продолжается поиск наиболее информативных методов диагностики РПЖ и базовые методики исследования стали дополнять результатами изучения таких онкомаркеров, как proPSA (незрелая форма PSA, или предшественник), PSCA (антиген простатических стволовых клеток), PSP 94 (секретируемый белок предстательной железы 94), ECPA и ECPA-2 (ранние антигены РПЖ), uPA/uPAR (рецепторы активатора плазминогена урокиназы), GSTP1 (глутатион-S-трансфераза Р1), TMPRESS2:ERG (химерный белок, образующийся при хромосомной мутации со слиянием генов TMPRESS2 и ERG), РСА3 (prostate cancer antigene 3 – антиген рака ПЖ 3) [8, 9].
Одним из наиболее информативных методов ранней неинвазивной диагностики РПЖ в настоящее время считается определение PCA3.
В начале 1990-х гг. в медицинской практике стали активно применять метод определения PSA для диагностики РПЖ. Тогда же в лаборатории William B. Isaacs при использовании техники дифференциального дисплея для исследования ткани ПЖ человека молекулярный биолог из Голландии M. Bussemakers нашел новый ранее не занесенный ни в одну генетическую базу ген, который назвал DD3 (от англ. differential display clone 3), а позже он получил название PCA3 (от англ. prostate cancer antigen 3). Он был обнаружен в 53 из 56 образцов ткани РПЖ и отсутствовал в 18 нормальных образцах других тканей организма. Поскольку уровень экспрессии данного гена в раковых клетках ПЖ более чем в 60 раз превышал показатели в нормальных клетках, М. Bussemakers сделал вывод о пригодности DD3 для диагностики РПЖ [10, 11]. Последующие исследования показали, что новый ген является некодирующей РНК, которая может быть картирована в хромосоме 9q21-22. Транскрипционная единица PCA3 (см. рисунок) состоит из 4 экзонов (красные квадраты 1, 2с, 3 и 4) и 3 полиаденилирующих сайтов в экзоне 4 (оранжевые ячейки 4а, 4b и 4c). Также идентифицировали 2 новых экзона (2а и 2 b), 4 новых полиаденилирующих сайта (вертикальные линии в экзоне 4) и 4 новых транскрипционных стартовых сайта (экзон 1, розовая и светло-розовая ячейки; см. рисунок) [11].
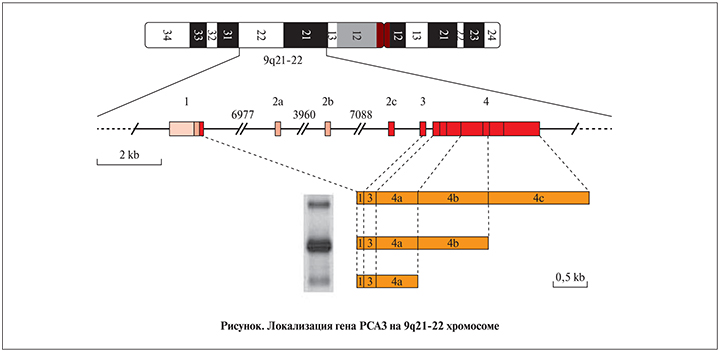
Также известно, что PCA3 находится в 6-м интроне гена BMCC1, который участвует в нормализации пролиферации, а также в клеточной смерти и опухолевом изменении клеток ПЖ [12].
DD3 (PCA3) был впервые представлен в 1994 г. на Конгрессе Европейского сообщества урологической онкологии и эндокринологии в Берне (Швейцария). Дальнейшее изучение PCA3 проходило в лабораториях J. A. Schalken в Нидерландах [10].
PCA3 избыточно экспрессируется почти во всех образцах (95%) ткани РПЖ, но не в нормальной или гипертрофированной ткани [8]. Уровень данного маркера определяется путем расчета соотношения числа копий мРНК PCA3 к числу копий мРНК PSA в анализе мочи, собранной после выполнения ПРИ или массажа простаты. Уровень экспрессии РСА3 в моче не зависит от локализации опухоли в ПЖ и наличия хронического простатита [13].
Возможность использования оценки уровня РСА3 в моче впервые была предложена de Kok et al. в 2002 г. [14]. Предполагается, что оценка РСА3 в моче способна повысить выявляемость РПЖ, особенно при значениях PSA, находящихся в «серой зоне». При обследовании 534 пациентов из 5 разных институтов показано, что использование РСА3 способно с большей точностью, чем PSA (р<0,01), выявлять РПЖ на ранних стадиях, избегая лишних биопсий [15]. Также показано, что уровень РСА3 в моче статистически достоверно связан с объемом опухоли и суммой Глисона.
По данным различных авторов, чувствительность РСА3 варьируется от 46,9 до 82%, а специфичность – от 55 до 92%, положительная прогностическая ценность – от 39 до 86%, а отрицательная прогностическая ценность – от 61 до 89,7% [8, 16–18].
По мнению I. L. Deras et al. [19], преимуществом PCA3 служат более высокая чувствительность и специфичность по сравнению с PSA. Уровень РСА-3 не зависит от наличия простатита или объема железы [20,21], при этом при положительном результате биопсии отражает небольшие, но значимые увеличения данного показателя [19].
На данный момент РСА3 позиционируется как скрининговый тест первой линии, достоверно улучшающий выявление РПЖ, имеющий большую чувствительность и специфичность по сравнению с общим PSA [13].
В настоящее время существует уже три поколения систем диагностики, опирающихся на количественный анализ мРНК гена РСА3 в моче или ее клеточном осадке. Полученное значение нормируют на число клеток предстательной железы в анализируемом образце, в свою очередь определяемое по количеству мРНК гена KLK3, кодирующего белок PSA и экспрессирующегося исключительно в тканях ПЖ [1].
В первой предложенной тест-системе суммарную клеточную РНК выделяют из клеточного осадка мочи, собранного центрифугированием. Полученную РНК используют для реакции обратной транскрипции и последующей полимеразной цепной реакции (ОТ-ПЦР). Затем количество мРНК гена PCA3 и PSA определяют методом гибридизации продуктов ОТ-ПЦР на специальных микрочипах. Эта система диагностики была апробирована в Голландии в ходе исследования, в котором приняли участие 108 пациентов. Одновременно с анализом экспрессии РСА3 в данной группе обследованных проводили гистологическое исследование биоптатов ПЖ. Исследование показало, что высокий уровень PCA3 в клеточном осадке мочи коррелирует с высоким риском обнаружения РПЖ по результатам биопсии [14].
Второй метод диагностики РПЖ, разработанный компанией «DiagnoCure Inc.» (Канада) в 2004 г., основан на определении уровня экспрессии PCA3 и PSA в клеточном осадке с помощью ОТ-ПЦР в режиме реального времени (ОТ-ПЦР-РВ). В ходе проведенного мультицентрового исследования 517 пациентов показано, что выявление высокого уровня РСА3 в моче пациента коррелирует с ростом вероятности обнаружения РПЖ; продемонстрирована высокая специфичность и чувствительность теста [22, 23].
В ноябре 2003 г. компания «Gen-Probe Inc.» (Сан-Диего) получила от DiagnoCure эксклюзивные права на диагностику РПЖ по уровню экспрессии PСA3 по всему миру. Gen-Probe вскоре разработала количественный анализ PCA3 третьего поколения – Progensa®. Отличительной чертой данного теста является определение уровня экспрессии гена PCA3 не в клеточном осадке, а непосредственно в первой порции мочи после массажа ПЖ. Все дальнейшие биохимические процессы также проводятся в той же пробирке, куда первоначально собиралась исследуемая моча. В 2012 г. FDA (Food and Drug Administration – Управление контроля качества продуктов и лекарственных средств, США) приняло данный тест в качестве одного из параметров для решения о проведении повторной биопсии ПЖ мужчинам старше 50 лет. Вариабельность и воспроизводимость методики были положительно оценены в мультицентровом исследовании. Также было установлено, что в отличие от PSA концентрация PCA3 не зависит от объема ПЖ, возраста пациента, наличия простатита или лечения ингибиторами 5α-редуктазы, поэтому эффективность данного маркера выше, чем у PSA [24].
В настоящее время разработан набор реагентов для выявления мРНК гена PCA3 и определения уровня его экспрессии методом двустадийной ОТ-ПЦР-РВ «Проста-Тест», предназначенный для профессионального применения в медицинских организациях и клинико-диагностических лабораториях онкологического и урологического профиля.
Данный набор реагентов позволяет выявлять отношение количества некодирующей мРНК гена РСА3 к уровню мРНК гена KLK3 методом ОТ-ПЦР с гибридизационно-флуоресцентной детекцией в пробе РНК человека, выделенной из образцов свежего или фиксированного в среде для стабилизации и сохранения РНК клеточного осадка, полученного центрифугированием или фильтрованием мочи, собранной после массажа ПЖ.
На базе ГАУЗ «Республиканский клинический онкологический диспансер МЗ РТ» были проведены клинические испытания разработанного набора реагентов «Проста-Тест». В качестве объектов исследования использовано 50 образцов клеточного осадка, полученного центрифугированием мочи, собранной после массажа ПЖ, от мужчин в возрасте 40 лет и старше с наличием показаний к биопсии ПЖ. Ранее с целью выполнения валидации функциональных характеристик испытания набора реагентов были проведены на 200 образцах клеточного осадка мочи, в результате чего были определены диагностические показатели, аналогичные полученным в данном исследовании. Таким образом, общий объем выборки составил 250 образцов.
После процедуры отбора проб мочи, собранной после пальцевого ректального массажа ПЖ, пациента в обычном порядке подвергали процедуре биопсии. Анализ и оценка результатов проведенных клинико-лабораторных испытаний разработанного набора реагентов подтвердили его качество, эффективность и безопасность применения. По результатам статистической обработки полученных характеристик эффективности с доверительной вероятностью 90% диагностическая чувствительность исследуемого набора реагентов на образцах проб мРНК человека, выделенных из образцов свежего клеточного осадка, составила 68,4%, диагностическая специфичность – 73,1%. Воспроизводимость результатов – 100%. В процессе испытаний набор реагентов «Проста-Тест» продемонстрировал высокую надежность [25].
При оценке результатов различных тест-систем для определения РСА3 ряд исследователей обращает внимание на тот факт, что условия сбора мочи для анализа, ее транспортировка и хранение могут по-разному сказываться на результатах. Поскольку число клеток в моче относительно невелико, для увеличения их количества было предложено перед сбором мочи проводить ПРИ с массажем ПЖ или заменить его тремя ударами по каждой доле ПЖ. На сегодняшний день доказано, что проведение массажа и его характер не влияют на конечную величину уровня экспрессии PCA3, а также чувствительность и специфичность этого метода диагностики и порядка 80% образцов мочи, собранных без предварительного массажа ПЖ, информативны [26]. Тем не менее производители коммерческих тест-систем рекомендуют собирать биоматериал после массажа ПЖ в виде трех ударов по каждой ее доле.
Также, по мнению некоторых исследователей, на диагностическую точность оценки уровня РСА 3 может влиять, во-первых, метод анализа экспрессии генов: в оригинальной тест-системе анализа экспрессии РСА3 Progensa (Hologic) используется транскрипционно-опосредованная амплификация, другие авторы применяют ОТ-ПЦР-РВ [27, 28]. Во-вторых, немаловажным фактором служит этап пробоподготовки, т.е. способ получения того биоматериала, из которого непосредственно выделяют РНК. Набор Progensa предполагает анализ мочи без предварительной подготовки, ее забирают в среду, где проводят лизис клеток и сорбцию исследуемых мРНК со специфичными олигонуклеотидами, иммобилизованными на магнитных шариках [27]. При другом подходе РНК выделяют из осадка мочи после центрифугирования [28], ряд авторов перед взятием мочи проводит массаж ПЖ в целях увеличения доли клеток из ПЖ в осадке мочи [29, 30].
Информация о том, связан ли уровень PCA3 с агрессивностью опухоли, противоречива. В ближайшем будущем несколько молекулярных диагностических анализов, возможно, будут использоваться в комплексе, например, для обнаружения гибридных генов TMPRSS2-erg, специфических для РПЖ, в осадке мочи после массажа [31, 32].
При РПЖ установлено генетическое нарушение, вовлекающее регулируемый андрогенами ген TMPRSS2 и гены транскрипционных факторов ETS, ERG и ETV1. Ген ERG из семейства ETS относится к числу онкогенов, который достоверно высоко экспрессируется при РПЖ (более 70% случаев) [33]. При РПЖ ERG может быть слитным с геном ТМРRSS2, который кодирует сериновую протеазу, секретируемую эпителием ПЖ в ответ на действие андрогенов. Такая генная перестройка приводит к слитному транскрипту ТМРRSS2-ETS, через который ERG экспрессируется на повышенном уровне под контролем андрогенов. Определение химерного гена TMPRSS22-ERG в ткани демонстрирует высокую специфичность (до 99%) и чувствительность (до 86%) при РПЖ [34].
Слияние генов TMPRSS2 и ERG наблюдается примерно в 50–70% случаев РПЖ и не обнаруживается в нормальной ткани ПЖ и при доброкачественной гиперплазии предстательной железы (ДГПЖ), специфичность определения продукта этого новообразованного гена в ткани иммуногистохимическим методом составляет 85%, чувствительность – 100% [35].
Неинвазивное определение продукта слияния генов TMPRSS2 и ERG или ETV1 возможно в моче методом ПЦР-РВ, специфичность при этом составляет 94% для РПЖ, чувствительность же составляет 37%, однако при комбинации с определением PCA3 чувствительность повышается до 73%. При этом продукт TMPRSS2‑ERG обладает также прогностической ценностью и позволяет предсказывать индекс Глисона и клиническую стадию РПЖ, чего не хватает оценке PCA3 [36]. TMPRSS2‑ERG коррелирует с индексом Глисона и объемом опухоли, а в совокупности с PCA3 предсказательная способность наличия РПЖ при биопсии повышается и позволяет использовать комбинацию этих маркеров для стратификации РПЖ по группам риска [8, 37–39]. Было показано, что большинство ложноотрицательных результатов по PCA3 корректируется определением TMPRSS2‑ERG [40].
Ожидается, что предиктивный маркер, химерный ген TMPRSS2‑ERG, сделает реальным предсказание реакции пациентов с кастрационнорезистентным РПЖ на новые лекарственные препараты [41].
Таким образом, клинические исследования показали, что высокий уровень экспрессии PCA3 в моче пациента коррелирует с вероятностью обнаружения у него РПЖ по результатам биопсии в большей степени, чем высокие значения ПСА в крови. Значения позитивной и негативной прогностических ценностей теста на PCA3 выше, чем теста на ПСА. Эти данные многократно подтверждены исследованиями, проведенными в разных клиниках [22].
В связи с этим следует сделать однозначный вывод, согласно которому внедрение метода количественного определения PCA3 в клиническую практику может существенно повышать эффективность диагностики РПЖ и сокращать число ненужных биопсий.
Диагностические системы на определение уровня РСА3 могут быть особенно полезными в наиболее затруднительных для врача ситуациях, а именно: 1) постоянно повышающийся уровень ПСА при негативных результатах одной или нескольких биопсий; 2) уже диагностированный у пациента хронический простатит; 3) низкий уровень ПСА у пациентов, у которых обнаружили РПЖ или 4) у которых в роду наблюдали случаи этого онкологического заболевания (мониторинг потенциальных больных).
Между тем определение РСА3 имеет и ряд недостатков, о которых необходимо упомянуть. Так, было показано, что уровень экспрессии РСА3 в моче коррелирует не только с вероятностью обнаружения РПЖ по результатам биопсии, но и с параметрами, отражающими агрессивность заболевания (объем опухоли, стадия заболевания, экстракапсулярное распространение, сумма баллов по шкале Глисона). Другие исследователи этой корреляции не обнаружили [42]. Кроме того, на данный момент не существует некоей унифицированной методики сбора мочи и методики проведения массажа ПЖ перед ее сбором. Это затрудняет прямое сравнение разных клинических исследований по использованию диагностической системы определения уровня экспрессии РСА3 в качестве неинвазивного метода диагностики РПЖ. Стоит также отметить, что пока мало данных о том, как влияет прием различных лекарственных препаратов на уровень экспрессии РСА3 клетками ПЖ, а потому этот вопрос требует дальнейших исследований [43].



