Одной из центральных проблем современной клинической медицины является оказание помощи коморбидным пациентам. Вариантов сочетания разных заболеваний у одного пациента огромное количество, и вряд ли целесообразно рассматривать их путем перебора. Наибольшую актуальность имеют ситуации, когда одно заболевание налагает существенные ограничения на лечение другого.
Современная урология развивается по пути совершенствования высокотехнологичных малоинвазивных методик, позволяющих оперировать пациентов, которым ранее оперативное вмешательство выполнялось только по жизненным показаниям. Да и сами пациенты изменились. Например, в общей клинической практике сейчас нередко встречаются реципиенты почечного и печеночного трансплантата. Качественный подбор органа и адекватно проводимая иммуносупрессивная терапия позволяют таким пациентам достигать высокой степени реабилитации на протяжении многих лет, а иногда и десятилетий. Однако сопутствующие заболевания, в том числе и урологической сферы, актуальность свою у них не теряют.
Урологическая помощь пациентам трансплантологического профиля несомненно имеет свои особенности, незнание которых иногда вынуждает хирурга вовсе отказаться от планового вмешательства из-за страха перед осложнениями.
В литературе эти вопросы оказания урологической помощи пациентам с иммунодефицитом, в том числе и после трансплантации органов, освещены недостаточно и несколько однобоко. Имеется довольно обширный пласт статей, посвященных урологическим осложнениям трансплантации почки, прежде всего реконструктивно-пластическим операциям при некрозе или стриктуре мочеточника трансплантата [1–3]. Практически все эти вмешательства проводятся на базе трансплантологических клиник, где есть собственное отделение гемодиализа, а также возможность лабораторной оценки концентрации циклоспорина и такролимуса, что недоступно большинству урологических клиник. Однако вопросы урологических вмешательств в отношении реципиентов печеночного или легочного трансплантата практически не рассмотрены [4, 5]. Потому представляет определенный научный и практический интерес клиническое наблюдение успешного оперативного лечения нефролитиаза у пациента, ранее перенесшего трансплантацию печени.
Множество частных вопросов, касающихся оперативного лечения нефролитиаза у реципиента печеночного трансплантата можно свести к трем основным:
1. Какие могут быть ограничения и противопоказания к оперативному лечению нефролитиаза со стороны печеночного трансплантата?
2. Каковы особенности выбора методики удаления конкремента с учетом печеночного трансплантата и медикаментозно индуцированного иммунодефицита?
3. Какова тактика медикаментозной терапии?
Попытаемся дать развернутые ответы на эти вопросы, анализируя представленное ниже клиническое наблюдение. В 2021 г. во 2-е урологическое отделение ГКБ им. Д. Д. Плетнёва ДЗМ был госпитализирован пациент С. 63 лет, предъявивший жалобы на постоянные тянущие боли в поясничной области справа. Из анамнеза известно, что в декабре 2019 г. пациенту выполнена ортотопическая трансплантация печени (ОТП) по поводу цирроза печени в исходе хронического вирусного гепатита B и гепатоцеллюлярной карциномы печени T2N0M0, BCLC A, II стадии. Пациент на постоянной основе получал иммуносупрессивную и противовирусную терапию по схеме: Такролимус по 0,5 мг 1 раз в сутки, Эверолимус по 1 мг 2 раза в сутки, Энтекавир по 0,5 мг 1 раз в сутки. Также пациент принимал Метформин 850 мг по 1 таблетке 2 раза в сутки по поводу сахарного диабета 2 типа, развившегося после ОТП. Больному проведено стандартное предоперационное комплексное клинико-лабораторное обследование. При обследовании показатели общего анализа крови, общего анализа мочи, а также основные биохимические показатели крови в пределах нормы. Признаков печеночной недостаточности выявлено не было (билирубин общий – 4,5 мкмоль/л, альбумин – 31 г/л, АЛТ – 33 ЕД/л, АСТ – 27 ЕД/л, щелочная фосфатаза – 44 ЕД/л). Показатели свертывания крови без патологических изменений (АЧТВ – 35 с, фибриноген – 3,74 г/л, МНО – 0,96, протромбиновое время – 11,1 с, тромбоциты – 187х10*9/л). При посеве мочи данных за бактериурию не получено. Также исключен биохимический рецидив рака печени (альфа-фетопротеин – 5,2 МЕ/мл).
По результатам ультразвукового исследования (УЗИ) мочевыводящих путей и мультиспиральной компьютерной томографии почек с внутривенным контрастированием в лоханке правой почки выявлен конкремент размером до 2,5 см, плотностью 500 ЕД по Хаунсфилду, нарушавший отток мочи из почки (рис. 1).

На основании жалоб, данных анамнеза заболевания, лабораторных и инструментальных методов исследования пациенту установлен диагноз: мочекаменная болезнь, камень правой почки, хронический пиелонефрит (ремиссия), состояние после ОТП от 06.12.2019 по поводу цирроза печени в исходе хронического гепатита В, гепатоцеллюлярная карцинома печени T2N0M0, BCLC A, II стадия, bridge-терапия (ТАХЭ+сорафениб), сахарный диабет 2 типа.
Перед оперативным вмешательством с целью антибактериальной профилактики назначен ципрофлоксацин по 400 мг 2 раза в сутки внутривенно. В качестве профилактики послеоперационных тромбоэмболических осложнений выбран эноксапарин натрия по 4000 Анти-ХА МЕ (0,4 мл) подкожно 1 раз в сутки.
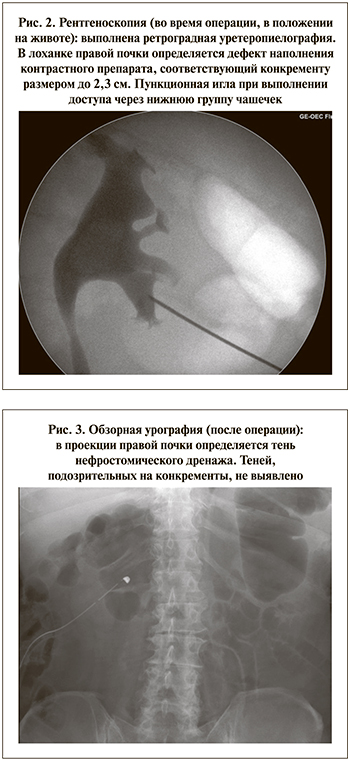
Перкутанная нефролитотрипсия (ПНЛ) выполнена в рентгеноперационной под эндотрахеальным наркозом. После цистоскопии и ретроградной катетеризации почки мочеточниковым катетером № 6 F на стороне планируемого оперативного вмешательства произведена ретроградная уретеропиелография, при которой в лоханке правой почки выявлен дефект наполнения, соответствующий расположению и размеру камня. Далее в положении на животе выполнена пункция чашечно-лоханочной системы (ЧЛС) под контролем электронно-оптического преобразователя через нижнюю группу чашечек (рис. 2). По струне-проводнику произведено бужирование пункционного хода тефлоновыми бужами до размера 24 F, установлен кожух Amplatz. При ревизии в лоханке правой почки выявлен единичный конкремент размером до 2,5 см, подверженный ультразвуковой литотрипсии и литоэкстракции. При контрольной рентгеноскопии и панорамной нефроскопии резидуальных фрагментов не выявлено. Интраоперационная кровопотеря была минимальной. Правая почка дренирована нефростомическим дренажем № 20 F c баллоном на 5 мл. Мочеточниковый катетер также был оставлен в правой почке. Время операции составило 35 мин.
Послеоперационный период протекал гладко. На 1-е сутки после операции выполнена контрольная обзорная урография, по данным которой теней, подозрительных на резидуальные фрагменты конкрементов, выявлено не было (рис. 3). Мочеточниковый и уретральный катетеры удалены на 1-е сутки. На 2-е сутки после операции пациенту взяты контрольные анализы крови, которые показали отсутствие воспалительной реакции. На 3-и сутки пациенту начато дробное пережатие нефростомического дренажа. Осложнений отмечено не было, в связи с чем нефростомический дренаж был удален. Достигнуто полное заживление нефростомического свища. При контрольном ультразвуковом исследовании нарушения оттока мочи, резидуальных фрагментов выявлено не было. На 4-е сутки послеоперационного периода пациент в удовлетворительном состоянии был выписан из стационара под амбулаторное наблюдение врачом-урологом.
Рецидивирующий болевой синдром по типу почечной колики и вялотекущий пиелонефрит служат абсолютным показанием к оперативному лечению нефролитиаза. Поэтому обсуждаться может лишь выбор операции – перкутанной или трансуретральной контактной нефролитотрипсии, дистанционной ударно-волновой литотрипсии, лапароскопической/ретроперитонеоскопической пиелолитотомии? Столь обширный выбор методик можно существенно упростить, если обратить внимание, что одни позволяют одномоментно извлекать конкремент из просвета чашечно-лоханочной системы, но сопровождаются механической травмой почки, другие предполагают разрушение камня без механической травмы почки, но сопровождаются повышенным риском частичного блока почки и обструктивного пиелонефрита на фоне миграции фрагментов конкремента. При иммунодефиците любой этиологии, в том числе и медикаментозно индуцированном, одномоментная нетяжелая травма почки существенно менее опасна по сравнению с инфекционно-воспалительными осложнениями, которые у таких пациентов закономерно протекают тяжелее, чем у пациентов с условно-сохранной иммунной системой. По тем же соображениям многоэтапное лечение в данной ситуации уступает одноэтапному, но более травматичному. Нетяжелая механическая травма почки (а оперативная травма почки по определению не может быть тяжелой, иначе лечение станет опасней болезни) практически никогда не дает посттравматической нефропатии, тем более прогрессирующего интестициального фиброза.
Дистанционная литотрипсия является наименее инвазивным способом оперативного лечения нефролитиаза, однако данный метод часто сопряжен с необходимостью выполнения повторных сеансов (что может провоцировать образование гематом почки), а также формированием «каменной дорожки» в мочеточнике, предрасполагающей к развитию почечных колик и атак пиелонефрита, что весьма нежелательно для пациентов, находящихся на иммуносупрессии [6–8].
При трансуретральной нефролитотрипсии всегда повышен риск воспалительных осложнений за счет резкого повышения внутрилоханочного давления при использовании принудительной активной ирригации в процессе вмешательства [9].
Стандартным методом оперативного удаления камней почек размером более 2 см, согласно рекомендациям Европейским Ассоциации урологов, является перкутанная нефролитотрипсия. Гибкая уретерореноскопия также применима при конкрементах подобного размера, однако вероятность дополнительных вмешательств и стентирования выше, чем при ПНЛ [10]. Исходя из этих рассуждений, пациенту выполнена перкутанная нефролитотрипсия, позволившая удалить камень одномоментно.
Нормально функционирующий печеночный трансплантат никаких ограничений на урологическую тактику не налагает. Проблемы начинаются, если функция трансплантата снижена. Отсюда следует обязательность предоперационной оценки уровня билирубина, альбумина сыворотки крови, коагулограммы (включая международное нормализованное отношение [МНО]) (это показатели адекватности функции трансплантата), трансаминаз (показатели цитолиза и активности гепатита), щелочной фосфатазы (показатель холестаза). Для оценки риска оперативного вмешательства в отношении пациентов с нарушенной функцией печени разработаны шкалы, основанные на интегральной оценке клинических и лабораторных показателей. Шкалы Child–Turcotte и Child– Turcotte–Pugh (Чайлд–Тюркотт и Чайлд–Тюркотт–Пью) включают оценку пяти показателей: билирубин, альбумин, протромбиновое время, выраженность асцита, стадия печеночной энцефалопатии. В зависимости от выраженности изменений каждый показатель оценивается от 1 до 3 баллов. Сумма баллов менее 6 по Чайлд–Тюркотт–Пью, что полностью соответствует группе A по Чайлд–Тюркотт, свидетельствует о компенсации печеночной недостаточности и сохранности белково-синтетической функции печени. Таким пациентам может быть выполнено плановое оперативное лечение нефролитиаза.
Несколько менее известна в общей клинической практике, но широко применяется при трансплантации печени шкала MELD (Model for End Stage Liver Disease), представляющая математическую формулу, включающую три показателя – билирубин, креатинин, МНО. Индекс MELD, составляющий 10–19, примерно соответствует группе A по Чайлд–Тюркотт. При больших значениях индекса MELD пациента планово оперировать по поводу нефролитиаза нежелательно.
Трансплантация печени предполагает пожизненную иммуносупрессивную терапию, которая в большинстве случаев трехкомпонентна и включает ингибитор кальцинейрина (циклоспорин, такролимус), микофенолат и глюкокортикоид (обычно метилпреднизолон). Первый компонент обладает узким терапевтическим интервалом, что в сочетании с печеночным метаболизмом, системой цитохрома P-450 и обилием лекарственных взаимодействий делает его потенциально опасным. Передозировка чревата многочисленными побочными действиями, наибольшую значимость среди которых имеет нефротоксичность. Недостаток угрожает развитием реакции отторжения транспланатата. Такие риски вынуждают регулярно конт-ролировать сывороточную концентрацию этих препаратов с коррекцией дозировки при необходимости. В настоящее время подавляющее большинство пациентов получает такролимус, что связано с его лучшим профилем безопасности по сравнению с циклоспорином. Нормальной считается сывороточная концентрация такролимуса 6–8 нг/мл. Целесообразно проконтролировать ее на этапе предоперационного обследования, так как это некоторая гарантия нормальной функции трансплантата в послеоперационном периоде. Разумеется, нельзя произвольно изменять схему иммуносупрессии, даже при развитии у пациента инфекционно-воспалительных осложнений.
Фармакологические особенности ингибиторов кальцинейрина делают крайне нежелательным назначение лекарственных средств, конкурирующих с ними за ферментные системы метаболизма. Среди противомикробных средств это макролиды и азолы. С точки зрения органической химии такролимус вообще может быть классифицирован как макролид, так как является полициклическим лактоном. Однако ни азолы, ни макролиды не являются препаратами выбора для профилактики и лечения послеоперационного пиелонефрита, потому ограничения представляются формальными.
Выраженность иммуносупрессии у пациентов, получающих поддерживающую терапию (но не индукционную или антикризовую), весьма умеренна. Поэтому никаких редких и экзотических возбудителей инфекционно-воспалительных заболеваний органов мочеполовой системы, встречающихся при тяжелом иммунодефиците, опасаться не следует. Антибактериальная профилактика должна проводиться теми же препаратами, что и пациентам с условно-сохранной иммунной системой. Разумеется, в данной ситуации очень желателен бактериологический анализ мочи с антибиотикограммой, что позволит минимизировать риск неудачи.
Однако два ограничения все же есть: нецелесообразно назначение цефотаксима и цефоперазона. Первый из них проходит печеночный метаболизм с образованием активного метаболита. При адекватно функционирующем печеночном трансплантате официального запрета на использование этого препарата нет, однако в изучаемой клинической ситуации невозможно предсказать, какой процент введенного лекарственного средства трансформируется в активную форму. Кроме того, это дополнительная нагрузка на трансплантат, которую вполне можно избегать. Второй – единственный из цефалоспоринов, имеющий практически полностью печеночный путь выведения, а также он способен потенцировать эффекты антикоагулянтов. Официального запрета на его назначение реципиентам печеночного трансплантата нет, однако это тоже дополнительная нагрузка на трансплантат и ненужный риск геморрагических осложнений.
В заключение несколько практических рекомендаций:
При иммунодефиците, по нашему мнению, бояться следует не травмы почки, а атак пиелонефрита, особенно повторных. Предпочтительнее одномоментная операция с большей механической травмой, чем многоэтапное лечение с меньшей механической травмой, но большим риском обструктивного пиелонефрита.
На этапе предоперационного обследования необходимо убедиться в адекватности функции трансплантата – отсутствии печеночной недостаточности, отсутствии активности вирусного гепатита и адекватности иммуносупрессивной терапии, которую затем без крайней необходимости не изменяют.
Антибактериальную профилактику желательно проводить согласно антибиотикограмме. Предпочтение отдается препаратам, имеющим почечный путь выведения и не проходящим печеночный метаболизм.



