Патологические состояния, характеризующиеся нарушением функции нижних мочевыводящих путей (НМП), весьма многообразны. Самый частый из них – симптомокомплекс, называемый гиперактивным мочевым пузырем (ГАМП). Это состояние широко распространено в мире и считается не только социальной, но и экономической проблемой. На сегодняшний день патогенез ГАМП до конца все еще не изучен. Существуют различные теории его возникновения, находящиеся на стадии исследования. Вследствие того что порой выявить причину возникновения ГАМП весьма трудно, чаще всего его рассматривают как идиопатический. Не так давно было высказано предположение о наличии нескольких подтипов ГАМП [1, 2]. В настоящей лекции представлены обновленные данные, касающиеся нейроанатомии, физиологии НМП и патогенеза развития ГАМП.
Субкортикальный контроль наполнения и опорожнения мочевого пузыря
Основная задача НМП заключается в обеспечении двух противоположных процессов – наполнения и опорожнения мочевого пузыря. Оба процессы напрямую зависят от скоординированной работы резервуара (мочевого пузыря) и зоны выведения (шейка, уретра, наружный сфинктер). Взаимодействие этих структур обеспечивается слаженной работой головного мозга, спинного мозга и периферических нервов.
Эфферентная иннервация НМП
Контроль над удержанием мочи в большей степени обеспечивает спинной мозг, в то время как опорожнение мочевого пузыря инициируется только при правильной работе соответствующих зон головного мозга [3]. Все указанные структуры, участвующие в процессе мочеиспускания, иннервируются тремя типами периферических нервов: крестцовыми парасимпатическими волокнами (тазовое сплетение), грудо-поясничными симпатическими волокнами (гипогастральный нерв) и крестцовыми соматическими волокнами (половой нерв).
Сакральные парасимпатические волокна
Именно сакральная парасимпатическая иннервация вносит основной вклад в возбуждение детрузора и обеспечивает акт мочеиспускания. Главный медиатор парасимпатических нервов – ацетилхолин (АХ). Холинергические преганглионарные нейроны, расположенные в боковых рогах сакрального отдела спинного мозга [4], посылают аксоны через тазовое сплетение непосредственно в стенку мочевого пузыря. Интересно, что при повреждении тазового сплетения, например, у пациентов с травмой конского хвоста не происходит полной денервации благодаря системе интрамуральных ганглиев. Клетки ганглиев высвобождают ацетилхолин и другие биологически активные вещества, например АТФ. Это приводит к возбуждению детрузора, а также к ингибированию активности гладкой мускулатуры уретры посредством выделения оксида азота [5].
Грудо-поясничные симпатические волокна
Влиянием симпатической иннервации на НМП объясняется расслабление мышц детрузора, возбуждение шейки мочевого пузыря и проксимального отдела уретры [5]. Симпатические волокна, иннервирующие НМП, берут начало в области пояснично-крестцовых ганглиев симпатического ствола, а также в превертебральных узлах нижнего брыжеечного сплетения. В мочевой пузырь они попадают в составе гипогастрального нерва [6] и тазовых нервов [7]. Интересно, что гипогастральный нерв в области малого таза проходит по его заднебоковой поверхности на 1–2 см ниже и медиальнее мочеточников.
M. Walters et al. [8] подчеркивают, что это именно та зона («крестцово-маточные связки»), куда накладывают лигатуры при реконструктивных операциях по поводу пролапса женских половых органов, что зачастую приводит к возникновению синдрома хронической тазовой боли в послеоперационном периоде.
Сакральные соматические волокна
Иннервация поперечно-полосатых мышц наружного сфинктера уретры осуществляется из скопления нервных клеток в области передних рогов сакрального отдела спинного мозга, носящих название «ядра Онуфа». Аксоны этих мотонейронов проходят в составе волокон полового нерва и возбуждают поперечно-полосатый уретральный сфинктер, продуцируя ацетилхолин [9].
Холинергический контроль деятельности НМП
Принято считать, что наиболее важными для осуществления сокращения детрузора являются М3-холинорецепторы [10]. Эти мускариновые рецепторы наиболее многочисленные как в детрузоре, так и в уротелии. Однако помимо М3-холинорецепторов остается класс рецепторов, роль которых не настолько очевидна. Речь идет о М2-холинорецепторах. Было высказано предположение, будто активность этих рецепторов увеличивается именно при развитии обструкции или гиперактивности мочевого пузыря [11]. В последующих исследованиях установлено, что в образцах ткани мочевого пузыря пациентов с ГАМП преобладающим типом рецепторов являются М2-холинорецепторы [12]. Авторы пришли к следующему выводу: в то время, как физиологические сокращения детрузора обеспечиваются М3-холинорецепторами, у пациентов с дисфункцией мочевого пузыря спонтанная активность может быть опосредована М-холинорецепторами второго типа.
Адренергический контроль деятельности НМП
Иннервация тела мочевого пузыря адренергическими нервами минимальна. Плотная адренергическая иннервация наблюдается только в области шейки, особенно у мужчин [13]. В детрузоре человека доминируют β3-адренорецепторы, обеспечивающие расслабление мочевого пузыря под влиянием норадреналина. Степень влияния данного механизма на накопление мочи остается предметом дискуссий. Например, K. E. Andersson в своих исследованиях показал, что симпатэктомия, или блокада β-адренорецепторов, не оказывала значимого влияния на фазу наполнения мочевого пузыря [14]. Несмотря на это, предложена медикаментозная терапия ГАМП, направленная на активацию адренергического механизма расслабления мочевого пузыря, которая показала свою эффективность [15].
Афферентная иннервация НМП
Афферентные нейроны тазовых и половых нервов берут начало на уровне сакральных спинальных ганглиев, в то время как волокна гипогастрального нерва располагаются в поясничном отделе. Центральные аксоны нейронов спинальных ганглиев несут сенсорную информацию от НМП к нейронам второго порядка в спинном мозге [16]. Эти нейроны обеспечивают формирование спинальных рефлексов и передачу информации по восходящим проекциям в участки головного мозга, отвечающие за контроль мочеиспускания. Наиболее важные афферентные волокна те, которые идут в составе тазовых нервов. Именно они контролируют объем наполнения мочевого пузыря и амплитуду его сокращений. Эти афференты представляют собой миелинизированные (Aδ) и немиелинизированные (C) волокна, воспринимающие информацию от рецепторов в стенке мочевого пузыря [17]. Необходимо отметить, что переключение с фазы наполнения на фазу опорожнения мочевого пузыря начинается именно благодаря сенсорным сигналам афферентных нервных волокон, которые также отвечают за восприятие болевых ощущений. Важно, что нарушение функции афферентных нервов приводит к появлению симптомов гиперсенсорности мочевого пузыря. Недавние предположения, будто именно расстройства афферентной иннервации могут играть значимую роль в возникновении симптомов накопления, потенциально способны модифицировать точки приложения терапии дисфункции НМП.
Спинальный контроль НМП
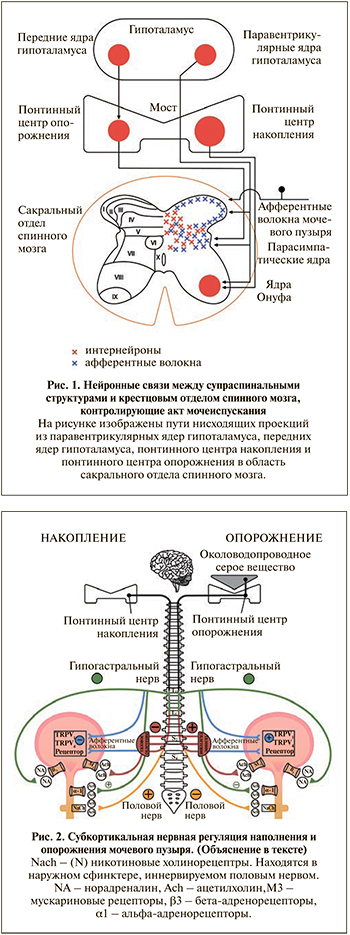 Спинальный контроль НМП представлен четырьмя основными компонентами: первичными афферентными волокнами, вставочными нейронами (интернейронами), эфферентными нейронами и проекциями нейронов головного мозга. Спинной мозг получает афферентную информацию от чувствительных аксонов тазовых нервов и гипогастральных нервов на уровне S2–S4 и Th11–L2 соответственно. На вершине задних рогов спинного мозга афферентные волокна тазовых нервов входят в зону Лиссауэра и вместе с коллатералями направляются в ростокаудальном направлении через поверхностный слой задних рогов (пластина I) в более глубокие слои (пластины V–VII и X; рис. 1). Далее эти нейроны посредством синапсов соединяются с интернейронами, несущими информацию в головной мозг, либо с интернейронами, участвующими в полисинаптической активности в нижних отделах спинного мозга [18]. Интересно, что на уровне задней спайки афферентные волокна от мочевого пузыря и от уретры образуют перекрест, что может являться важным участком соматовисцеральных интеграций, координирующих работу мочевого пузыря и уретрального сфинктера [18]. Интернейроны, направляющиеся в головной мозг, доставляют информацию в важнейшие центры, отвечающие за контроль мочеиспускания. Речь идет об околоводопроводном сером веществе (ОВСВ), понтинном центре накопления мочи, понтинном центре опорожнения, гипоталамусе и таламусе (рис. 1) [19, 20].
Спинальный контроль НМП представлен четырьмя основными компонентами: первичными афферентными волокнами, вставочными нейронами (интернейронами), эфферентными нейронами и проекциями нейронов головного мозга. Спинной мозг получает афферентную информацию от чувствительных аксонов тазовых нервов и гипогастральных нервов на уровне S2–S4 и Th11–L2 соответственно. На вершине задних рогов спинного мозга афферентные волокна тазовых нервов входят в зону Лиссауэра и вместе с коллатералями направляются в ростокаудальном направлении через поверхностный слой задних рогов (пластина I) в более глубокие слои (пластины V–VII и X; рис. 1). Далее эти нейроны посредством синапсов соединяются с интернейронами, несущими информацию в головной мозг, либо с интернейронами, участвующими в полисинаптической активности в нижних отделах спинного мозга [18]. Интересно, что на уровне задней спайки афферентные волокна от мочевого пузыря и от уретры образуют перекрест, что может являться важным участком соматовисцеральных интеграций, координирующих работу мочевого пузыря и уретрального сфинктера [18]. Интернейроны, направляющиеся в головной мозг, доставляют информацию в важнейшие центры, отвечающие за контроль мочеиспускания. Речь идет об околоводопроводном сером веществе (ОВСВ), понтинном центре накопления мочи, понтинном центре опорожнения, гипоталамусе и таламусе (рис. 1) [19, 20].
Таким образом, только благодаря слаженной работе всех представленных анатомических структур осуществляется физиологическое накопление и выведение мочи.
Нейрональный механизм наполнения и опорожнения мочевого пузыря
В физиологических условиях в фазу наполнения мочевого пузыря афферентная активность по тазовым нервным волокнам минимальна, что рефлекторно активирует симпатические и соматические нейроны, иннервирующие шейку и уретральный сфинктер [21]. Принято считать, что эти афферентные взаимодействия являются основой фазы наполнения мочевого пузыря [22]. Кроме того, в фазу наполнения стимуляция полового нерва (ядер Онуфа в сакральном отделе позвоночника) осуществляется из уже упомянутого участка моста мозга – понтинного центра хранения мочи, также известного как L-зона (см. рис. 1). Это название обусловлено анатомическим расположением, а именно более латеральным, чем соседний понтинный центр опорожнения, названный M-зоной (ядра Баррингтона), находящейся, соответственно, медиально. Таким образом, процесс подавления парасимпатических влияний симпатической и соматической нервной системой, обеспечивающий накопление мочи в мочевом пузыре, носит название «защитный рефлекс».
Противоположным ему является рефлекс опорожнения, который инициируется при заполнении мочевого пузыря, растяжении его стенки и активации афферентных нервных волокон, идущих в составе тазовых нервов в задние рога спинного мозга. Поступившая информация о достаточном для мочеиспускания объеме мочи направляется в мост головного мозга – в понтинный центр опорожнения [23]. Оттуда сигнал о готовности совершить мочеиспускание идет в ОВСВ. Его роль в реализации мочеиспускания подтверждена не только на лабораторных животных в исследованиях B. Blok et al. [24], но и на людях с использованием позитронно-эмиссионной томографии и функциональной магнитной томографии [25]. Околоводопроводное серое вещество передает по нисходящим проекциям сигнал в понтинный центр опорожнения, что приводит к активации уретровезикального рефлекса, обеспечивающего расслабление гладкой мускулатуры проксимального отдела уретры и раскрытие мочеиспускательного канала [26]. Одновременное снижение подавляющего влияния префронтальной коры (если мочеиспускание социально приемлемо) способствует расслаблению поперечно-полосатого сфинктера уретры, что является триггерным компонентом произвольного процесса начала акта мочеиспускания.
Как видно на рис. 2, во время фазы наполнения чувствительные к растяжению ванилодидные рецепторы (Transient Receptor Potential Vanilloid-1,4/TRPV1,4) передают информацию по афферентным Aδ-волокнам (показаны синим) об отсутствии мочи в мочевом пузыре в понтинный центр накопления. Его активация приводит к усилению влияний симпатической нервной системы, которая представлена гипогастральным нервом (показан зеленым), секретирующим норадреналин, связывающийся с β3-адренорецепторами в шейке мочевого пузыря, что приводит к ее расслаблению. Кроме того, волокна гипогастрального нерва, проходящие в составе тазового сплетения, возбуждают зону пузырно-уретрального сегмента посредством связывания норадреналина с α1-адренорецепторами. Помимо симпатической нервной системы вклад в «защитный рефлекс» вносит соматический половой нерв (показан желтым), секретирующий ацетилхолин, связывающийся с никотиновыми рецепторами в наружном сфинктере уретры.
Переход к опорожнению мочевого пузыря также осуществляется посредством механочувствительных ванилоидных рецепторов, транслирующих информацию о наполнении в понтинный центр опорожнения по афферентным волокнам тазового сплетения, проходящим через спинной мозг. В этом процессе задействовано также ОВСВ, в котором, как считается, находится релейный механизм, отвечающий за переключение на фазу опорожнения. Информация из моста приводит к подавлению активности симпатической нервной системы парасимпатической. Активируются эфферентные нервы тазового сплетения (показаны красным), секретируя ацетилхолин. В свою очередь соматические волокна полового нерва, наоборот, расслабляются, что приводит к раскрытию поперечно-полосатого наружного сфинктера уретры. Происходит физиологический акт мочеиспускания.
Современные теории развития гиперактивности мочевого пузыря
На сегодняшний день существует несколько теорий патогенеза ГАМП. Каждая из них по-своему объясняет механизмы возникновения спонтанных сокращений мочевого пузыря, воспринимаемых человеком как неконтролируемый позыв на мочеиспускание. Важно отметить, что в здоровом мочевом пузыре сокращения стенки также имеют место и служат для создания общего тонуса органа. Однако они минимальны и не приводят к активации афферентных волокон тазовых нервов. Интересным открытием последних лет стали результаты экспериментов на изолированной ткани мочевого пузыря, подтверждающие наличие спонтанной активности не только в детрузоре, но и в уротелии и субуротелиальном слое клеток. Помимо этого обсуждается роль рецепторов уретро-везикального сегмента в формировании ургентности. Все это привело к формулировке нескольких не взаимоисключающих теорий развития ГАМП.
Миогенная теория развития ГАМП
Согласно ранним исследованиям, посвященным миогенной теории, спонтанные сокращения детрузора связаны с денервацией мочевого пузыря [27]. Однако в более поздних работах [28] высказано предположение, будто гиперактивность детрузора может быть вызвана гистологическими изменениями мышечной ткани. Эти изменения заключаются в аномально близком расположении гладкомышечных клеток друг к другу. При таком близком контакте слабые в норме физиологические сокращения стенки мочевого пузыря сливаются и обусловливают более выраженную спонтанную активность [29]. На сегодняшний день миогенная теория считается наиболее вероятной.
Уротелиальная теория развития ГАМП
Согласно этой теории, патологическое высвобождение медиаторов и других биологически активных веществ в уротелии в ответ на растяжение стенки мочевого пузыря может приводить к частым позывам на мочеиспускание [30]. Кроме того, растет число доказательств роли афферентных волокон в формировании ургентности, обусловленной дисфункцией уротелия или субуротелиального слоя интерстициальных клеток [31–33]. Интересно, что данный вид ургентности в большей степени проявляется не в виде гиперактивности детрузора, а как гиперсенсорность мочевого пузыря.
Наряду с уротелием было установлено влияние самой слизистой оболочки на формирование ургентности [34]. Необходимо отметить, что эти влияния достаточно малы, однако они могут вносить определенный вклад в формирование патологических позывов. Данные, полученные в отношении влияния уротелия на возникновение ГАМП, противоречивы и требуют дальнейших подтверждений.
Уретрогенная теория развития ГАМП
В начале XX в. F.J.F. Barrington описал различные способы провокации мочеиспускания у кошек [35]. Один из них заключался в раздражении водой мочеиспускательного канала, что приводило к интенсивным сокращениям мочевого пузыря посредством активации афферентных парасимпатических нервных волокон. Позднее эти результаты были подтверждены на здоровых людях-добровольцах, а данный рефлекс был назван уретровезикальным [36]. Многие пациенты испытывают ощущение ургентности при переходе из лежачего или сидячего положения в вертикальное. Именно этот клинический признак был постулирован как ГАМП, имеющий уретральное происхождение [37]. Эта группа пациентов может не демонстрировать паттерны детрузорной гиперактивности во время уродинамического исследования, так как обычно оно проводится в положении сидя и катетер может частично перекрывать область шейки мочевого пузыря. Для выявления ГАМП в данном случае принято проводить пробу Вальсальвы [38].
У пациенток с пролапсом органов малого таза в рамках интегральной теории описано, что ургентность может быть вызвана активирующимся уретровезикальным рефлексом, опосредованным возбуждением рецепторов растяжения в данной зоне. Этим может объясняться регресс симптомов ГАМП у пациенток после хирургической реконструкции тазового дна [39].
Теория центрального генеза развития ГАМП
Центральный нейрональный контроль мочеиспускания интенсивно изучался на протяжении последних десятилетий. В результате было высказано предположение о существовании патогенетического механизма развития ГАМП, заключающегося в снижении супраспинального тормозного контроля рефлекса опорожнения [40]. Развитие технологий визуализации и накопившиеся данные подтвердили наличие двух вариантов ГАМП центрального генеза: с гиперактивностью детрузора и без нее [41]. Островковая доля и передняя поясная извилина отвечают за развитие ГАМП без детрузорной гиперактивности, в то время как за ее наличие, по-видимому, отвечает префронтальная кора [41]. Разница в работе супраспинальных структур у пациентов с гиперактивностью детрузора и без нее подтверждена в исследованиях S. D. Tadic et al. [42]. Установлено, что у пациентов с гиперактивностью детрузора большее повреждение белого вещества прямо пропорционально степени функциональных нарушений мочеиспускания. Предположительно поражения белого вещества могут быть анатомическим субстратом для развития ГАМП с гиперактивностью детрузора вследствие лобной гипоперфузии [43]. Для лечения данной группы пациентов D. Griffiths et al. рекомендовали использовать поведенческую терапию, оказавшуюся действенной, как полагают авторы, из-за переобучения супраспинальных нейронных сетей [44].
Как свидетельствуют данные, представленные в первой части лекции, мочеиспускание – сложнейший процесс, находящийся под контролем центральной и периферической нервной системы. Некоторые механизмы все еще находятся на стадии изучения и требуют проведения дополнительных исследований. Авторы убеждены, что только до конца поняв патогенез ГАМП, можно будет разработать новые эффективные методы лечения. Это понимание может быть достигнуто только посредством трансляционных исследований. Именно такое сотрудничество клинической и фундаментальной медицины послужило вдохновением для создания данной лекции.



