Наряду с болевым синдромом нарушения мочеиспускания являются наиболее частым проявлением урологических заболеваний. До недавнего времени для обозначения любых нарушений мочеиспускания в отечественной литературе применялся термин «дизурия», который подразумевал различные расстройства мочеиспускания, выражающиеся его учащением, болезненностью, затруднением и т.д. с перечислением соответствующих терминов [1, 2]. Однако такой подход не позволял в достаточной мере формировать целостную картину нарушений мочеиспускания у конкретного пациента и полноценно их интерпретировать, поскольку клиническая терминология практически не была привязана к нормальной физиологии и патофизиологии мочевого пузыря, не отражала единства нарушений его трех основных функций: 1) наполнения (накопления); 2) опорожнения (эвакуации); 3) удержания мочи. Очевидно, по этой причине эксперты Европейского общества урологов еще в 2002 г. ввели в обиход новую терминологию для обозначения нарушений мочеиспускания – Low Urinary Tract Symptoms (LUTS) [3]. В настоящее время данная терминология принята и в российской урологической литературе в виде эквивалентного русскоязычного термина «симптомы нижних мочевыводящих путей» (СНМП).
Согласно рекомендациям Европейского общества урологов (EAU) (2022) и резолюции по итогам российского Экспертного совета по проблемам дифференцированного подхода к терапии СНМП (2019), СНМП принято делить на три основные группы симптомов: опорожнения, накопления и постмикционные симптомы. К симптомам опорожнения относятся затрудненное начало мочеиспускания, прерывистое мочеиспускание, слабая струя мочи, разбрызгивание струи мочи, необходимость натуживаться при мочеиспускании, капельное выделение мочи в конце мочеиспускания. Симптомами наполнения являются ургентность, недержание мочи, учащенное мочеиспускание (поллакиурия), в том числе в ночное время (ноктурия). К постмикционным симптомам относят чувство неполного опорожнения мочевого пузыря и подкапывание мочи после мочеиспускания [4, 5]. Несмотря на то что такое деление СНМП в определенной мере условно, тем не менее данная методология существенно помогает врачу выявить превалирующую симптоматику при первичном осмотре и правильно выбрать симптоматическую фармакотерапию для получения положительного клинического ответа.
Эпидемиология и этиология СНМП у мужчин
Истинная частота СНМП в мировой популяции мужчин доподлинно остается неизвестной, так как распространенность СНМП в разных регионах мира разная, она зависит от географических, расово-этнических, культурных и других особенностей [6, 7]. Кроме того, далеко не все пациенты с СНМП подлежат медицинскому учету, поскольку не обращаются за медицинской помощью с официальным оформлением медицинской документации. Однако хорошо известно, что все СНМП характеризуются неуклонным прогрессированием в связи с возрастом. Так, если частота однократной ноктурии у молодых мужчин 20–40 лет составляет в среднем 11–35,2%, двукратной – 2–16,6%, то у мужчин старше 70 лет частота однократной ноктурии составляет уже 35–93%, двукратной – 29–59,3% [8].
Cистематический обзор литературы за период с 2000 по 2017 г. о распространенности и тяжести СНМП у мужчин в возрасте 50 лет и старше, а также о медицинском лечении и альтернативных немедицинских подходах к СНМП показал, что СНМП широко распространены в мировой популяции в целом и в 2018 г. затронули 2,3 млрд человек, из которых 44,7% составляли мужчины [9]. Последние страдают не только от СНМП (прежде всего от ноктурии и ургентных позывов), но и от неблагоприятных психологических последствий (тревоги и депрессии) и финансового бремени, связанного с лечением СНМП. Современные методы лечения клинически эффективны, но их эффективность снижается из-за побочных эффектов и низкого уровня соблюдения рекомендаций пациентами. Альтернативные немедицинские методы лечения СНМП также были востребованы во всем мире. Существуют доказательства того, что изменения образа жизни, такие как упражнения для мышц таза и мочевого пузыря, физическая активность, изменение рациона питания и пищевые добавки, могут облегчать СНМП и улучшать качество жизни пациентов. Однако фактические данные, основанные на строгой методологии, остаются минимальными и не могут быть обобщены для всех групп населения. Эксперты пришли к следующему выводу: хотя поведенческое лечение служит многообещающим подходом к облегчению СНМП, особенно в сочетании с медикаментозным лечением, по-прежнему необходимы хорошо спланированные рандомизированные контролируемые и продольные клинические исследования поведенческого лечения СНМП. Малоинвазивные процедуры и нейромодуляционная терапия также показывают положительные результаты в облегчении СНМП, но требуют дальнейших исследований [9]. C другой стороны, в настоящее время появляется все больше доказательных публикаций, свидетельствующих о существенном омоложении популяции мужчин с любыми СНМП [10]. Более того, наличие любого неурологического заболевания может оказывать существенное негативное влияние как на сроки развития СНМП, так и на скорость их прогрессирования [11–13]. В частности, хорошо известны корреляции между СНМП, метаболическим синдромом и сердечно-сосудистыми заболеваниями, которые даже предлагалось рассматривать в качестве потенциального фактора риска как прогрессирования, так и тяжести СНМП. Систематический поиск литературы с использованием PubMed, Google Scholar и Scopus включил 477 статей (63 712 мужчин), из которых в 5 исследованиях сообщалось о распространенности неблагоприятных сердечно-сосудистых событий (НССС) у пациентов со среднетяжелыми и тяжелыми СНМП по сравнению с пациентами с легкой формой СНМП или без нее, и в 10 исследованиях сообщалось о наличии этих событий в анамнезе. Наличие СНМП средней и тяжелой степеней достоверно увеличивало риск сообщений о НССС в анамнезе (р<0,001). Мета-регрессионный анализ показал, что риск НССС был ниже у пожилых пациентов и выше у пациентов с сахарным диабетом. Связь между НССС, связанными с СНМП, и сахарным диабетом подтверждена в модели многомерного регресса после корректировки по возрасту (скорректированный r=0,498; p<0,0001) [14]. Следует помнить, что СНМП весьма разнообразны, неспецифичны и встречаются в клинической практике многих специалистов, не только врачей-урологов. Однако в рутинной клинической практике все пациенты с СНМП, как правило, сразу направляются к урологу. Это происходит, по нашему мнению, в определенной степени по причине бытующего до сих пор мнения у врачей неурологического профиля, что СНМП имеют исключительно урологические причины. Отчасти это так [15] (рис. 1).

Как видно на рис. 1, среди возможных причин СНМП есть пункт «Другие причины», который, к сожалению, часто игнорируется урологами и в отсутствие патологических изменений мочевого пузыря и предстательной железы дальнейший диагностический поиск по установлению причин СНМП не проводится, а пациент не получает эффективного лечения или консультации смежного специалиста. С другой стороны, сегодня уже ясно, что СНМП полиэтиологичны, мультифакторны и могут быть вследствие не только заболеваний мочеполового тракта у пациентов обоих полов, но и ряда общих системных факторов, участвующих в регуляции всех функций нижних мочевыводящих путей, независимо от гендерных особенностей. Об этом свидетельствует, например, высокая частота СНМП у женщин, увеличивающаяся, как и у мужчин, с возрастом, хотя у них отсутствуют наиболее частые и «традиционные» для мужчин причины для их развития (заболевания предстательной железы). Так, по данным мета-анализа 2022 г., распространенность СНМП у женщин составила 11,8–88,5%. При этом распространенность симптомов накопления составила 23,6–79%, симптомов опорожнения – 1,8–51, постмикционных симптомов – 0,3–46% соответственно [16]. Частота любых видов недержания мочи наблюдалась у 5,8–45,8% женщин, а большинство пациенток страдали от стрессового недержания мочи (1,9–31,8%). Распространенность ургентного и смешанного недержания мочи составила 0,7–24,4 и 2,1–12% соответственно. Распространенность СНМП у женщин увеличивается, особенно в связи с возрастом [16].
В связи с вышесказанным с высокой долей достоверности можно утверждать, что СНМП у мужчин сегодня не являются только клиническим проявлением заболеваний нижних мочевыводящих путей и предстательной железы, но могут рассматриваться в качестве такого же неотъемлемого универсального атрибута старения в рамках возрастассоциированных патологических изменений в организме современного человека, таких как системное субклиническое хроническое воспаление, инсулинорезистентность, сахарный диабет 2 типа, дислипидемия, эндотелиальная дисфункция, метаболический синдром, возрастной дефицит половых гормонов (возрастной гипогонадизм у мужчин). Последние связаны с СНМП и между собой едиными патогенетическими механизмами, способны к взаимному отягощению [17, 18].
СНМП у мужчин как клиническая маска эндокринологических заболеваний
Факт зависимости анатомо-функционального состояния нижних мочевыводящих путей и предстательной железы от сохранности и адекватности гормональных сигнальных путей у мужчин и женщин установлен давно и сегодня ни у кого не вызывает сомнений [19]. К настоящему времени показано, что в нижних отделах урогенитального тракта и предстательной железе экспрессируются рецепторы к половым стероидным гормонам (прогестерону, тестостерону, эстрогенам), витамину (гормону) D, пролактину, гормону роста, инсулину, йодтиронинам, глюкокортикоидам, вазопрессину (антидиуретическому гормону, АДГ), окситоцину [20]. Эпителий предстательной железы имеет мощные ферментные системы 5-α-редуктаз, под влиянием которых происходит биотрансформация поступающего тестостерона в 5-α-дигидротестостерон (5-α-ДГТ) – основной простатический андроген. В строме предстательной железы работает ферментная система стромальных ароматаз, способных конвертировать тестостерон в эстрогены. Кроме того, предстательная железа способна к захвату из системного кровотока циркулирующего дегидроэпиандростерона (ДГЭА) надпочечников и самостоятельному интракринному синтезу тестостерона и эстрогенов непосредственно в своей ткани. Также показано, что клетки APUD-системы базального слоя простатического эпителия вырабатывают местные простатические гормоны (кальцитонин, серотонин, мелатонин) [20].
Гормональный дефицит неизбежно прогрессирует с возрастом, что совпадает по времени и динамике с прогрессированием СНМП на фоне как ДГПЖ, так и без нее.
Иными словами, СНМП необязательно и далеко не всегда ассоциируются с ДГПЖ. Этот факт безусловно привносит в патогенетические механизмы СНМП наряду с традиционными урологическими причинами дополнительные гормональные механизмы, которые следует учитывать при диагностике и планировании фармакотерапии СНМП. Однако в практической работе мы зачастую забываем этот известный факт [21] (рис. 2).
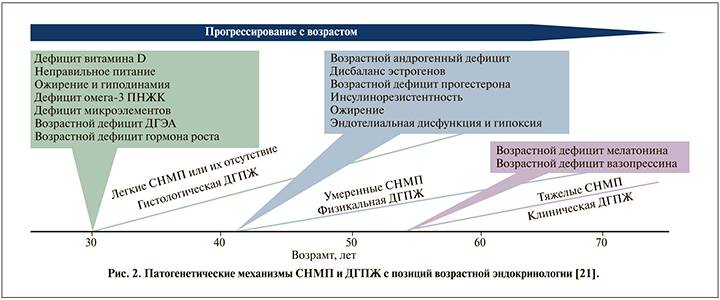
Одними из ключевых полифункциональных гормонов у мужчин безусловно являются андрогены. Практически все клетки мужского организма в разной степени экспрессируют андрогеновые рецепторы, посредством которых андрогены реализуют свои специфические клеточные эффекты, в том числе в нижних отделах мужского урогенитального тракта и предстательной железе [22]. Начиная с 35 лет у мужчин уровень андрогенов (прежде всего общего и свободного тестостерона) постепенно снижается вплоть до формирования в определенном (для всех мужчин различном) возрасте возрастного андрогенного дефицита, при этом частота и выраженность любых СНМП у мужчин также прогрессируют с возрастом [23, 24]. Эти известные эпидемиологические корреляции позволяют утверждать, что дефицит тестостерона однозначно вовлечен в мультифакторный патогенез СНМП у мужчин, в рамках которого он может оказывать свое негативное влияние на анатомофункциональное состояние нижних отделов урогенитального тракта посредством различных механизмов, многие из которых уже установлены, другие продолжают активно изучаться [25–27] (рис. 3).
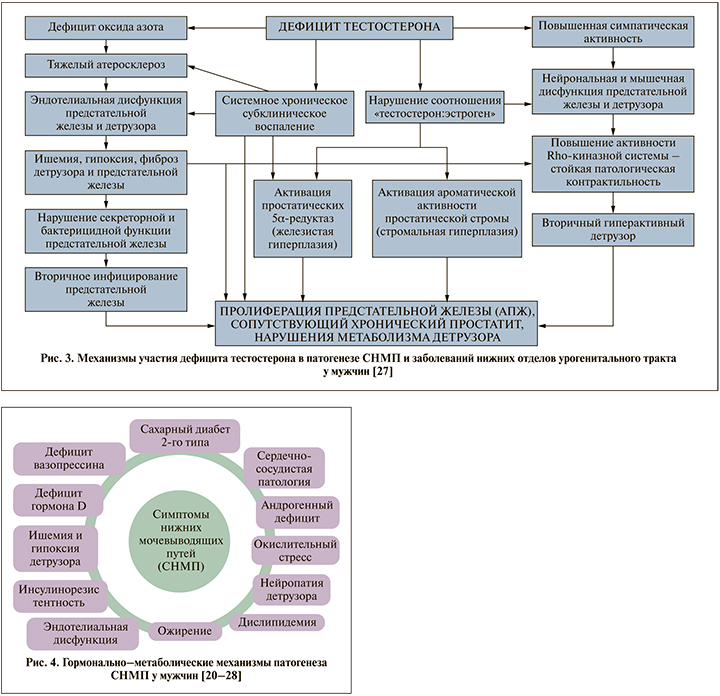
Возрастной гипогонадизм является независимым фактором риска как СНМП, так и заболеваний предстательной железы, своеобразным ключевым связующим механизмом, позволяющим утверждать, что не только и не столько ДГПЖ является главной причиной СНМП у стареющих мужчин. Вопреки ранее бытовавшей догме о том, что рост предстательной железы прямо пропорционален уровню тестостерона, последние исследования показали, что недостаток тестостерона может быть фактором риска развития как СНМП, так и ДГПЖ. Имеющиеся в настоящее время мета-анализы свидетельствуют: тестостерон-заместительная терапия (ТЗТ) не только не ухудшает СНМП, но и сам по себе возрастной гипогонадизм служит важным фактором риска развития СНМП/ДГПЖ [28]. В связи с этим становится очевидным, что раздел причин СНМП у мужчин под названием «Другие причины» на ранее представленном рис. 1 включает потенциально огромное разнообразие неурологических причин нарушений мочеиспускания у мужчин, начиная от медикаментозно-индуцированных СНМП до СНМП вследствие недиагностированного и, соответственно, нелеченого эндокринологического заболевания, прежде всего возрастного гипогонадизма, что отражает явно междисциплинарный характер данной актуальной медикосоциальной проблемы [20–28] (рис. 4).
Тестостерон-заместительная терапия (ТЗТ) и СНМП: доказательная база эффективности и безопасности
В недавнем прошлом клиницисты высказывали много опасений по поводу повышения риска СНМП/ДГПЖ и острой задержки мочи (ОЗМ) на фоне ТЗТ. Однако уже ранние исследования по данной тематике показали, что это не так. На модели животных показано, что ТЗТ уменьшает проявления СНМП, способствует увеличению емкости мочевого пузыря и уменьшает детрузорное давление при максимальной скорости потока мочи. Так, S. Karazindiyanoğlu и S. Cayan (2008) также сообщали, что ТЗТ позволила значительно увеличить среднюю емкость и скорость опорожнения мочевого пузыря, тогда как среднее детрузорное давление уменьшалось в начале и после лечения [29]. А. Haider et al. (2009) при лечении гипогонадных мужчин с СНМП (средний возраст – 59,5 лет) тестостероном выявили существенное уменьшение балла симптоматики СНМП по шкале IPSS-QL и объема остаточной мочи после 9 мес. терапии [30]. S. Kalinchenko et al. (2008) оценили результаты 26-недельной ТЗТ 30 мужчин (средний возраст – 51 год) с гипогонадизмом и СНМП и установили существенное уменьшение дизурии (по шкале IPSS-QL) к концу курса [31]. T. Amano et al. (2010) установили, что ТЗТ в течение 3 мес. эффективна в отношении не только эректильной дисфункции и симптомов дефицита тестостерона, но и СНМП у гипогонадных мужчин [32]. Современные данные убедительно свидетельствуют: ТЗТ не только не ухудшает течения легких и умеренных СНМП, но улучшает их, а сам гипогонадизм служит важным независимым фактором риска развития СНМП и ДГПЖ, поэтому ТЗТ должна быть рассмотрена в отношении всех гипогонадных пациентов с необструктивными СНМП/ДГПЖ [33]. Следует также напомнить, что долгие годы тяжелые СНМП (суммарный балл по шкале IPSS >19) рассматривались как абсолютное противопоказание к проведению ТЗТ. Однако нынешние руководящие принципы ТЗТ Европейской ассоциации урологов (EAU), отраженные в рекомендациях 2020 г., больше не рассматривают тяжелые СНМП как абсолютное противопоказание к ТЗТ, а как относительное противопоказание. В руководящих принципах отмечается, что этот парадокс еще не подкреплен убедительными клиническими доказательствами, но, если тяжелые СНМП лечить надлежащим образом, это больше не является противопоказанием к ТЗТ [34]. Аналогичной точки зрения придерживается сегодня и Европейская Академия андрологии [35].
Наши ранние представления о СНМП, длительное время считавшихся проявлением исключительно урологических заболеваний, в настоящее время претерпевают существенный методологический метаморфоз и эволюцию, превратившись из узкопрофильной урологической жалобы в междисциплинарную комплексную медико-социальную проблему современной клинической медицины. Это стало возможным благодаря фундаментальным исследованиям последних десятилетий, убедительно показавшим важную роль системных гормонально-метаболических нарушений в мультифакторном патогенезе СНМП у мужчин. В контексте данных нарушений чрезвычайно важная роль в обеспечении нормального функционирования мужского урогенитального тракта отводится тестостерону как важнейшему половому стероиду у мужчин. Доказанная андрогенозависимость нижних мочевыводящих путей и предстательной железы у мужчин позволила шире подойти к пониманию патофизиологической сущности СНМП, во многом основанной на критической роли гормональных сигналов тестостерона в мужском урогенитальном тракте. С учетом этого факта становится понятной важная независимая самостоятельная роль возрастного дефицита тестостерона в патогенезе СНМП у мужчин, что позволило расширить традиционные показания к ТЗТ у них. Современные исследования убедительно продемонстрировали не только безопасность ТЗТ при лечении гипогонадных мужчин с различной степенью выраженности СНМП, но и ее профилактический эффект с точки зрения предотвращения дальнейшего прогрессирования нарушений мочеиспускания, существенно снижающих качество и продолжительность жизни современных мужчин.



