Хирургическое лечение пациентов с опухолевым тромбом в нижней полой вене (НПВ) II–III уровней, исходящим из почечной вены, подразумевает выполнение тромбэктомии из НПВ, радикальной нефрэктомии и ипсилатеральной лимфаденэктомии. В большинстве случаев это выполняется в ходе большой открытой операции, требующей широкого рассечения мышц живота, иногда даже торако-абдоминального разреза для получения адекватного доступа и контроля кровотока по основным магистральным сосудам и их ветвям [1, 2]. Среди пациентов без метастазов радикальное хирургическое лечение позволяет достигать 5-летней канцерспецифической выживаемости около 65% [2, 3]. При этом послеоперационные осложнения развиваются у 38% пациентов, периоперационная смертность составляет 4–10% [4].
Только за последние несколько лет минимально инвазивные методы, широко применяемые в урологической практике, получили определенное развитие при тромбэктомии опухолевых тромбов из НПВ [5]. В первой декаде нового столетия появились первые сообщения о лапароскопических операциях по удалению тромбов I–II уровней из НВП [6]. Причем в отличие от многих других методик в течение длительного периода опубликовано очень немного сообщений по этой теме. Робот-ассистированные операции при опухолевых тромбах описаны лишь в 2011–2015 гг. [7, 8], лапароскопичеcкая тромбэктомия при тромбе IV уровня впервые была выполнена в 2015 г. [9]. Тем не менее идет активное накопление опыта лапароскопических радикальных правосторонних нефрэктомий с тромбэктомией. Однако о проведении подобных операций при тромбах в НПВ, исходящих их левой почки, сообщили лишь несколько центров [5, 10].
Опираясь на алгоритм действий, используемый в нашей клинике при выполнении открытых радикальных нефрэктомий с тромбэктомией из НПВ по поводу опухоли левой почки, а также опираясь на уже имеющийся опыт лапароскопических операций при тромбах, исходящих из правой почки, мы попытались пошагово воспроизвести все отработанные технические приемы при полностью лапароскопических вмешательствах слева.
Лапароскопическая радикальная нефрэктомия с тромбэктомией из НПВ выполнена трем пациентам с почечно-клеточным раком и опухолевым тромбом в НПВ II–III уровней, исходящим из левой почечной вены.
 Методика операции. В основу предлагаемой лапароскопической методики положен принцип, хорошо отработанный в открытой хирургии: «сначала тромб, затем – почка». При любой локализации опухоли пациента укладывали на левый бок с легким разгибанием в поясничной области. Порты устанавливали как при правосторонней нефрэктомии: один (12 мм) – в правом подреберье по среднеключичной линии, второй (10 мм – для камеры) – параумбиликально, третий (12 мм) – в правой подвздошной области, четвертый (5 мм – для ретракции печени) – под мечевидным отростком.
Методика операции. В основу предлагаемой лапароскопической методики положен принцип, хорошо отработанный в открытой хирургии: «сначала тромб, затем – почка». При любой локализации опухоли пациента укладывали на левый бок с легким разгибанием в поясничной области. Порты устанавливали как при правосторонней нефрэктомии: один (12 мм) – в правом подреберье по среднеключичной линии, второй (10 мм – для камеры) – параумбиликально, третий (12 мм) – в правой подвздошной области, четвертый (5 мм – для ретракции печени) – под мечевидным отростком.
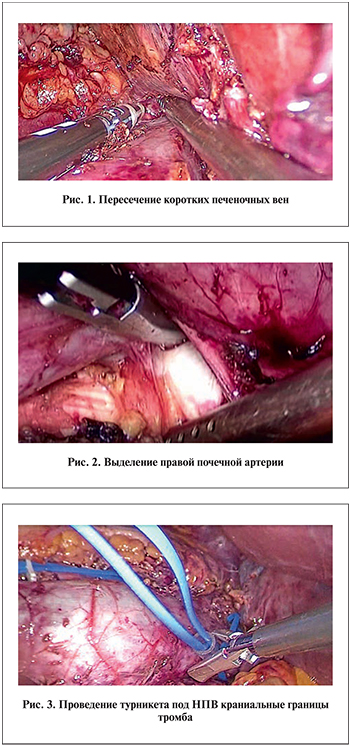
После мобилизации восходящей ободочной и двенадцатиперстной кишки визуализировали НПВ и выполняли лимфодиссекцию в аортокавальной зоне. Параллельно лигировали и пересекали аппаратом LigaSure правую гонадную вену и все поясничные вены в интересующей области. Таким же образом лигировали и пересекали правую надпочечниковую вену и 3–4 короткие печеночные вены (рис. 1).
Визуализировали, выделяли правую почечную артерию и подводили под нее пластиковый турникет (рис. 2). После контроля протяженности тромба с помощью лапароскопического ультразвукового датчика циркулярно мобилизовали НПВ дистальнее и проксимальнее опухолевого тромба и подводили под нее пластиковые турникеты с формированием петли. Концы турникетов проводили через отрезки уретрального катетера Нелатон длиной 1,5–2 см (20 Ch) и фиксировали клипсами Hem-o-Lock (рис. 3).
Последовательно осторожно выделяли переднюю и заднюю поверхности левой почечной вены. Мобилизовали, клиппировали и пересекали левую почечную артерию.
После пережатия правой почечной артерии зажимом «бульдог» последовательно затягивали и фиксировали клипсами турникеты на НПВ дистальнее и проксимальнее тромба. Для предотвращения диссеминации клеток опухолевого тромба, а также ретроградного кровотечения из почки левую почечную вену вблизи устья лигировали и пересекали степлером Endo-GIA (рис. 4). Нижнюю полую вену рассекали ножницами продольно, опухолевый тромб удаляли (рис. 5), иссекали устье левой почечной вены с металлическими скрепками и участки стенки НПВ в местах фиксации тромба. Препараты помещали в полиэтиленовый контейнер.
Стенку НПВ восстанавливали непрерывным полипропиленовым или политетрафторэтиленовым 4/0 швом (рис. 6). Последовательно срезая турникеты, распускали сосудистые петли, контролирующие кровоток по НПВ. При необходимости накладывали дополнительные швы на стенку НПВ. После этого снимали «бульдог» с правой почечной артерии. Кровоток в правой почке контролировали допплер-картированием с помощью лапароскопического датчика. Рабочие порты удаляли, дефекты ушивали.
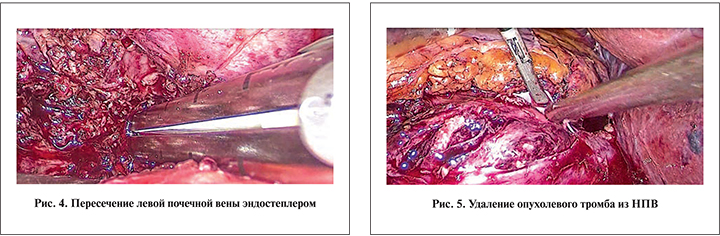
Пациента репозиционировали на правый бок. Под контролем лапароскопа дополнительно вводили еще два рабочих порта: в подреберной и подвздошной областях слева. После рассечения париетального листка брюшины по линии Тольдта проводили мобилизацию левой половины ободочной кишки, выполняли парааортальную лимфодиссекцию. При этом визуализировали и отделяли из окружающих тканей ранее лигированные и пересеченные концы левой почечной артерии и вены (рис. 7). Левую почку мобилизовали обычным образом с окружающей клетчаткой и прилегающим листком фасции (рис. 8). Мочеточник и гонадную вену пересекали LigaSure.
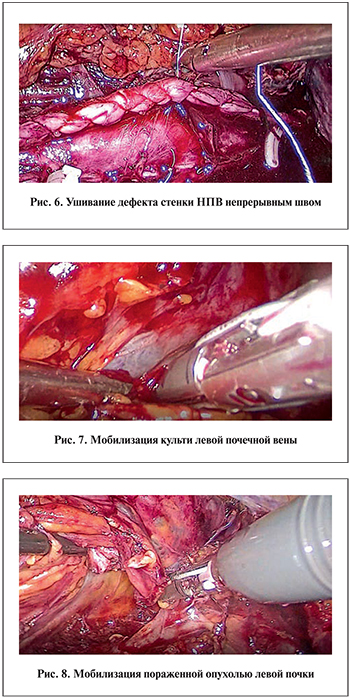 Пациенту с распространением опухолевого процесса на хвост поджелудочной железы выполнена резекция последнего. Фрагмент поджелудочной железы и селезеночные сосуды отсечены степлером Endo-GIA единым блоком с селезенкой. Весь удаленный комплекс помещали в полиэтиленовый пакет для экстракции. Контейнеры с препаратами удаляли через небольшой надлонный разрез. Дренаж оставляли в ретроперитонеальной зоне слева и выводили через апертуру одного из портов.
Пациенту с распространением опухолевого процесса на хвост поджелудочной железы выполнена резекция последнего. Фрагмент поджелудочной железы и селезеночные сосуды отсечены степлером Endo-GIA единым блоком с селезенкой. Весь удаленный комплекс помещали в полиэтиленовый пакет для экстракции. Контейнеры с препаратами удаляли через небольшой надлонный разрез. Дренаж оставляли в ретроперитонеальной зоне слева и выводили через апертуру одного из портов.
С целью профилактики тромботических осложнений в периоперационном периоде прибегали к стандартной компрессии нижних конечностей эластичными чулками до активизации пациента. За 8–12 ч до начала вмешательства начинали подкожное введение препаратов низкомолекулярных гепаринов (40 мг эноксапарина натрия), которое продолжали ежедневно до выписки пациента из стационара и далее амбулаторно в течение 1 мес. Контрольную КТ выполняли через 3, 6, 12 мес.
Все операции были закончены лапароскопически. Конверсий не было. У двух пациентов опухолевый тромб был II уровня, у одного – III (по классификации клиники Мейо). Максимальные размеры опухоли варьировались от 5 до 16 см. Протяженность опухолевого тромба в НПВ составляла 2,4–7 см (табл. 1). У одного пациента обнаружены положительные парааортальные лимфоузлы и прорастание опухоли в хвост поджелудочной железы.
Общая продолжительность операции составила 360–600 мин, объем кровопотери – 300–2500 мл. Одному пациенту в послеоперационном периоде потребовались гемотрансфузии. Серьезных осложнений в ближайшем послеоперационном периоде не отмечено. У одного пациента после резекции поджелудочной железы в течение недели после операции отмечено до 400 мл отделяемого по дренажу с высоким содержанием амилазы. Концентрация последней прогрессивно снижалась на фоне терапии октреотидом в течение 5 дней с 1500 до 36 ммоль/л. При этом концентрация фермента в плазме оставалась нормальной (за исключением первых послеоперационных суток). Период госпитализации составил 8–15 дней. Послеоперационное стадирование приведено в табл. 2. Период наблюдения составляет 4–26 мес. после операции.
В настоящее время двое пациентов живы без признаков прогрессии. Один пациент умер от прогрессирования заболевания через 5 мес. после операции.
Открытые операции по поводу опухолевого тромба в НПВ II–III уровней все еще остаются сложным вмешательством, сопровождающимся высокой частотой серьезных осложнений (около 38%) и показателями периоперационной смертности (4–10%) [5, 10]. С учетом высокого риска интраоперационных осложнений очевидно, что безопасность, техническая воспроизводимость и онкологическая эффективность лапароскопического доступа должны быть в достаточной степени оценены для рекомендации метода к широкому клиническому использованию.

Отличная визуализация благодаря большому увеличению и прецизионное выделение с использованием миниатюрных эндоскопических инструментов обеспечивают профилактику осложнений и способствуют снижению объема кровопотери [3].
Отсутствие помощи ассистента при лапароскопических вмешательствах по сравнению с открытыми в определенной степени увеличивает нагрузку на оперирующего хирурга. Тщательное выделение сосудов и прецизионный гемостаз, в частности, в отношении множественных расширенных венозных коллатералей снижают риск повреждения крупных сосудов и компенсируют «нехватку» рук ассистента в случае кровотечения. Основной мерой защиты от эмболии опухолевым тромбом является минимизация манипуляций непосредственно с пораженным сегментом НПВ. Преимущественным направлением диссекции должно быть отделение окружающих тканей от НПВ, а не вены от тканей.

Первым ключевым моментом является последовательное лигирование и пересечение в пораженной и прилегающих зонах НВП всех притоков, включая поясничные, гонадные и короткие печеночные вены, что позволяет снижать риск эмболии и объем кровопотери после вскрытия просвета на этапе удаления тромба. Выделенный сегмент должен при необходимости абсолютно свободно ротироваться вокруг продольной оси.
Следующим важным этапом является подведение под НПВ турникетов (они должны быть достаточно эластичными) каудальнее и краниальнее тромба. Для четкого контроля границ тромба мы обязательно используем лапароскопический ультразвуковой датчик.
Третьим условием снижения риска эмболии и объема кровопотери служит контроль кровотока из контралатеральной почечной вены. Для этого целесообразно подвести турникет под левую почечную вену (в случае тромба, исходящего из правой почки) или под правую почечную артерию (в случае тромба, исходящего из левой почки). Непосредственно перед рассечением стенки НПВ турникеты затягивают в следующей последовательности: каудальный на НПВ, затем – турникет на левой почечной вене или зажим «бульдог» на правую почечную артерию (при тромбе, исходящем из левой почечной вены), последним – краниальный турникет на НПВ. Удобнее всего затягивать турникет путем наложения пластиковых клипс над удерживающей трубкой. Использование последней позволяет достаточно туго затянуть турникет до полного прекращения кровотока, но без риска повреждения стенки вены. Применение эластичных турникетов гораздо удобнее, чем сосудистых зажимов «бульдог». Во-первых, для них требуется меньшее пространство, во-вторых, при их использовании выделенный сегмент НПВ легче ротировать и, в-третьих, при затягивании петли непосредственно над головкой тромба последний можно слегка «отжать» каудальнее, в то время как сосудистый зажим может его ущемить.
Непосредственно перед восстановлением кровотока турникеты распускаются в обратной последовательности. Для этого безопаснее одно колено петли пересекать между трубкой и клипсой. При необходимости повторного прекращения кровотока по НПВ можно вновь быстро затянуть турникет, наложив пластиковую клипсу под трубкой.
Следующим ключевым моментом является отсечение почечной вены с пораженной стороны степлером GIA. Это, во-первых, позволяет предотвратить диссеминацию клеток опухолевого тромба, во-вторых, фиксировать его оставшуюся часть к стенке НПВ и тем самым снизить риск эмболии, в-третьих, блокирует ретроградный кровоток из почечной вены, уменьшая кровопотерю и существенно улучшая визуализацию при выполнении тромбэктомии.
Однако главный принцип удаления опухолевого тромба, исходящего из левой почки, состоит в строгой последовательности проведения основных манипуляций [11]. Операцию необходимо начинать с удаления опухолевого тромба, для чего нужно полностью контролировать кровоток по НПВ, временно пережимая ее проксимальнее и дистальнее тромба. С той же целью приходится временно пережимать правую почечную артерию, что позволяет в достаточной мере снижать ретроградный кровоток из правой почечной вены.
После прекращения кровотока и вскрытия просвета НПВ выполняли тромбэктомию, поместив тромб в контейнер, ушивали дефект вены и восстанавливали кровоток в НПВ и правой почке. Только после этого приступали ко второму этапу – собственно левосторонней радикальной нефрэктомии. Такая последовательность действий обусловлена необходимостью максимального снижения риска эмболии и диссеминации опухолевых клеток, что обусловливает ее целесообразность как при открытых, так и при лапароскопических операциях.
Здесь следует отметить два главных отличия левосторонней радикальной нефрэктомии с тромбэктомией от правосторонней. Первое – операцию начинают с контралатеральной стороны. Если в открытой хирургии это не имеет большого значения для выбора доступа (обычно это срединная лапаротомия или «шеврон»), то при лапароскопических операциях требуется изменение доступа и, соответственно, позиции пациента на операционном столе. В связи с этим для выполнения первого этапа на НПВ удобно располагать порты так же, как при правосторонней нефрэктомии, в положении пациента на левом боку. Для выполнения второго этапа пациента приходится репозиционировать в позицию на правом боку, переместив рабочий монитор на противоположную сторону. Все это сопряжено с определенными хлопотами для персонала, однако с избытком окупается основными преимуществами эндоскопических вмешательств: отличная визуализация за счет многократного увеличения, существенное снижение кровопотери и травматичности для пациента.
Второе существенное отличие заключается в необходимости временного пережатия правой почечной артерии с целью контроля кровотока из правой почечной вены для выполнения тромбэктомии. Здесь мы сталкиваемся с достаточно жестким ограничением продолжительности всего этого этапа вплоть до восстановления кровотока, так как он сопровождается ишемией теперь уже единственной правой почки. До недавнего времени это представляло определенную проблему, связанную со значительно большим временем, требовавшимся для ушивания дефекта НПВ при лапароскопических операциях по сравнению с открытыми. Однако по мере совершенствования навыков и расширения спектра лапароскопических манипуляций скорость их выполнения максимально приблизилась к таковой при открытых вмешательствах. В представленных нами наблюдениях продолжительность ишемии правой почки не превышала 25–55 мин. При этом вероятность положительного хирургического края уменьшается за счет многократного увеличения и использования миниатюрных инструментов [9].
Несмотря на появление в литературе последних лет ряда исследований по лапароскопическим тромбэктомиям при опухолевых тромбах в НПВ, представленные серии в абсолютном большинстве имеют очень ограниченное количество наблюдений [5, 9]. Встречаются описания лишь отдельных пациентов с тромбами, исходящими из левой почечной вены, продолжительность последующего наблюдения которых редко превышает 12 месяцев [10]. В связи с этим наш опыт выполнения трех левосторонних лапароскопических радикальных нефрэктомий с тромбэктомией из НПВ может представлять определенный интерес.
Безусловно, небольшое число пациентов и относительно непродолжительное последующее наблюдение (4–26 мес.) не позволяют пока дать оценку онкологических результатов по сравнению с традиционными открытыми операциями. Более того, не представляется достаточно корректным сравнение результатов между группами пациентов с тромбом в НПВ, исходящим из левой и правой почек, так как когорта первых нередко может включать пациентов соматически более тяжелых и с распространенными стадиями заболевания. При этом как лапароскопические, так и открытые операции при левосторонней локализации сопряжены, как правило, с большими техническими трудностями, большей продолжительностью и сопровождаются той или степенью ишемического повреждения единственной оставшейся правой почки.
Начальный опыт выполнения лапароскопической радикальной нефрэктомии с тромбэктомией из НПВ опухолевого тромба, исходящего из левой почки, дает основание говорить о воспроизводимости и относительной безопасности предлагаемой методики, позволяющей соблюсти основные принципы онкологии и сосудистой хирургии. Операция не приводит к серьезным периоперационным осложнениям, существенной кровопотере и сопровождается довольно благоприятным течением ближайшего послеоперационного периода. Для оценки онкологической эффективности методики необходимо накопление большего числа наблюдений.



