Введение. Мочекаменная болезнь (МКБ) – проблема, затрагивающая население всех географических регионов. Эта патология может выступать причиной острых состояний, но, как правило, протекает как хроническое заболевание, которое может приводить к терминальной стадии почечной недостаточности. Распространенность МКБ связывают с экологическими причинами и генетической предрасположенностью, кроме того, к факторам риска относят обезвоживание, диету с высоким содержанием жиров, животных белков и соли, ожирение. В среднем почечными камнями страдают 6% женщин и 12% мужчин. Частота рецидивов нефролитиаза составляет 70–80% у мужчин и 47–60% у женщин, причем в 80% случаев рецидивируют камни из оксалата кальция [1].
Основным химическим компонентом камней в почках является оксалат кальция (50–70%), который может быть либо единственным фактором камнеобразования (30%), либо выступать в этой роли совместно с фосфатом кальция (40%) [2]. На процесс роста и адгезии кристаллов влияют многие химические соединения и факторы окружающей среды, которые могут оказывать как стимулирующее, так и подавляющее воздействие. Нарушения кальциевого метаболизма – одна из ведущих причин возникновения и развития МКБ, поскольку большинство почечных камней формируется с участием солей кальция. При этом цитрат, магний, пирофосфаты и нефрокальцины являются факторами-ингибиторами, препятствующими образованию кристаллов оксалата кальция [3]. Кроме того, в научной литературе описан еще один потенциальный ингибитор образования оксалата кальция в почках – растворимый белок остеопонтин (OPN) [4], который может продуцироваться почти всеми тканями и является одним из наиболее важных фосфорилированных и гликированных белков, участвующих в процессе кальцификации при кальций-оксалатном нефролитиазе [5, 6]. Многочисленные исследования показали, что остеопонтин предотвращает образование, рост и агрегацию кристаллов оксалата кальция [7, 8].
Связь между витамином D и образованием кальциевых камней – частый предмет исследования, так как витамин D принимает участие в гомеостазе кальция и является важным регулятором кальциевого метаболизма в почках. Показаны широкая распространенность дефицита витамина D среди лиц с МКБ, связь между мочевыми камнями и гипервитаминозом витамина D [9, 10].
Паратиреоидный гормон-родственный протеин (ПТГрП), белок из семейства паратиреоидного гормона (ПТГ), участвует в регуляции кальциевого и костного гомеостаза, а также в процессах гисто- и органогенеза. Доказано, что ПТГрП влияет на функционирование выделительной системы, например, за счет паракринного эффекта регуляции транспорта кальция в почках, а также то, что повышение уровня данного белка может приводить к гиперкальциемии при злокачественных новообразованиях (предстательной железы и др. [11–13]).
Таким образом, причиной развития и рецидивирования камней являются комплексные физико-химические и биохимические процессы, происходящие в организме на системном уровне и локально в почках. Несмотря на использование новых методов хирургического лечения нефролитиаза и терапевтических воздействий, распространенность МКБ остается на высоком уровне.
Цель исследования: выявить взаимосвязь различных параметров кальциевого обмена и особенностей течения МКБ у пациентов с кальций-оксалатным нефролитиазом.
Материалы и методы. Проведено проспективное исследование, в которое включены 100 человек. Первую группу составили пациенты с впервые диагностированным кальций-оксалатным нефролитиазом (n=41) (средний возраст – 42,3±9,5 лет); 2-ю группу – пациенты с кальций-оксалатным рецидивным нефролитиазом (n=39) (средний возраст – 39,7±10,5 лет); 3-ю группу – условно здоровые добровольцы (n=20), средний возраст которых составил 28,7±5,3 года. Женщин в 1-й группе было 27 (65,85%), во 2-й – 18 (46,2%), в 3-й – 8 (40%). Во 2-й группе средняя продолжительность заболевания МКБ составила 14,7±7,3 года. Плотность конкрементов у пациентов 1-й и 2-й групп составила 841–1056 HU. Пациенты подписывали информированное согласие перед включением в исследование. Протокол исследования одобрен локальным этическим комитетом КубГМУ. Критерии исключения: уратный, фосфатный и цистиновый уролитиаз; соблюдение диеты в течение последних 6 мес.; системное заболевание, влияющее на метаболизм кальция; прием лекарств, влияющих на метаболизм кальция и уровни кальция, оксалата, цитрата и pH мочи; беременность.
Всем пациентам было проведено плановое эндоскопическое хирургическое удаление конкрементов. На фотометрическом биохимическом анализаторе Rayto Super Z (Китай) определяли содержание креатинина, мочевины, общего кальция в сыворотке крови. Концентрацию ПТГ определяли на иммунохемилюминисцентном анализаторе ADVIA Centaur (Siemens). Скорость клубочковой фильтрации (СКФ) рассчитывали по формуле MDRD [14]. Перед операцией выполняли забор крови для определения концентрации маркеров кальциевого метаболизма – остеопонтина (тест-система Human Osteopontin), ПТГрП (тест-система Cloud-Clone Corp, США), витамина D – иммуноферментным методом ELISA. Уровни исследуемых аналитов были найдены на основании калибровочной кривой, построенной с использованием значений оптической плотности для стандартных растворов исследуемых веществ.
Статистическую обработку полученных результатов проводили с помощью программ Microsoft Excel 2016 и Statsoft. При математической обработке данные, распределение которых отличалось от нормального, представляли как медиану со значениями верхнего и нижнего квартиля [Me (Q1–Q3)], в случае нормального распределения значений использовали среднюю арифметическую и ее стандартную ошибку (M±m). Для выявления различий показателей в группах использовали непараметрический U-критерий Манна–Уитни. Корреляционный анализ проводился при помощи коэффициента корреляции Спирмена. Во всех процедурах статистического анализа уровень р принимали как значимый при значениях <0,05.
Результаты. Сравнение показателей возраста и средних значений индекса массы тела (ИМТ) не выявило статистически значимой разницы между группами пациентов с нефролитиазом (табл. 1). Анализ биохимических показателей крови показал, что средний уровень креатинина в 2-й группе был на 9,7% выше, чем в 1-й, и на 28,9% выше показателя 3-й группы. Уровень мочевины в 1-й и 2-й группах статистически значимо не различался, но был выше значений в 3-й группе на 24,6 и 21,9% соответственно. Показатели СКФ в группах нефролитиаза были сопоставимыми, а в 3-й группе на 20,7 и 12,1% выше, чем в 2-й и 1-й соответственно (см. табл. 1).

При проведении сравнительного анализа групп по показателям кальциевого обмена выявлено, что пациенты с первичным нефролитиазом имели различный исходный уровень остеопонтина (p<0,05). Это послужило основанием выделить в 1-й группе подгруппу 1А с низким содержанием остеопонтина (n=23) и подгруппу 1В с высоким (в 2,36 раза выше) уровнем данного белка (n=18). При этом в ходе дальнейшей обработки данных выявлено, что средний уровень общего кальция плазмы крови, ПТГ и ПТГрП в сыворотке крови в подгруппе 1B также был выше (на 32,8, 240,0 и 27,6% соответственно), чем в подгруппе 1А, и значимо не отличался от 2-й группы (p>0,05; табл. 2). Совокупность полученных показателей в подгруппе 1В может быть маркером рецидивирования МКБ на стадии первичного кальций-оксалатного нефролитиаза.

В исследовании установлено, что у пациентов с рецидивным нефролитиазом (2-я группа) уровень ПТГрП в сыворотке крови был в 3,7 раза выше, чем у условно здоровых лиц; при этом уровень остеопонтина увеличивался более чем в 1,5 раза. Также у этих больных в предоперационном периоде в сыворотке крови было повышено содержание остеопонтина (на 50,0–254,1%) и ПТГрП (на 40,7–79,6%) по сравнению с пациентами, у которых впервые была диагностирована МКБ.
У всех больных нефролитиазом имелся дефицит витамина D и ПТГ, причем их уровни не зависели от характера процесса: первичный или рецидивный (рис. 1).
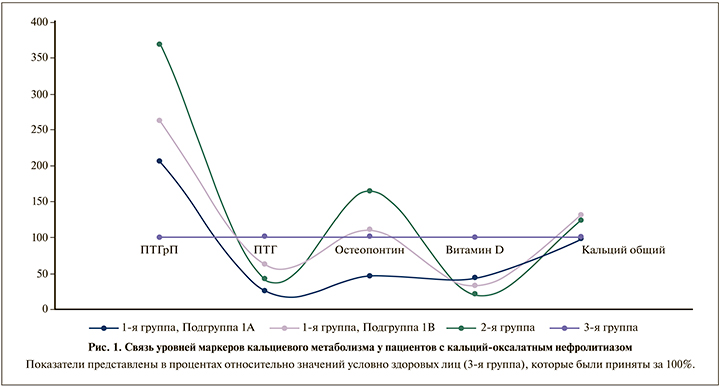
Проведенная в дальнейшем статистическая обработка полученных данных была направлена на поиск корреляционных связей между маркерами развития МКБ: ПТГрП, ПТГ, витамина D, остеопонтина и уровнем кальция крови у пациентов с первичным и рецидивным нефролитиазом. При анализе полученных результатов выявлено, что у пациентов с первичным нефролитиазом уровень кальция крови не коррелировал с таковым ПТГрП в крови (r=-0,0173, p>0,05). При этом выявлена статистически значимая положительная корреляционная связь между концентрацией ПТГ и уровнем кальция крови (r=0,5308, p>0,05) и отрицательная корреляционная связь общего кальция крови и уровня витамина D (r=-0,3811, p>0,05), а также слабая положительная корреляция содержания общего кальция крови с уровнем остеопонтина (r=0,1830, p>0,05; рис. 2).

При анализе данных группы пациентов с рецидивным нефролитиазом было выявлено, что уровень кальция крови также не коррелировал с таковым ПТГрП (r=0,0223, p>0,05), хотя содержание ПТГ положительно коррелировало с уровнем кальция крови (r=0,4246, p>0,05). Кроме того, показано, что у лиц с рецидивирующим нефролитиазом витамин D и остеопонтин крови значимо не коррелировали с уровнем кальция крови (r=-0,0728, p>0,05 и r=-0,0734, p>0,05 соответственно; рис. 3).
Обсуждение. Выявленная в ходе исследования выраженная неоднородность распределения концентрации остеопонтина в крови в группе пациентов с первичным нефролитиазом, возможно, связана с мутациями и полиморфизмами гена OPN, обнаруженными у значительного числа пациентов с МКБ по сравнению с лицами без нефролитиаза [15].
В то же время у пациентов с рецидивным нефролитиазом в предоперационном периоде уровень остеопонтина и ПТГрП в сыворотке крови был выше, чем у больных, которым впервые была диагностирована МКБ. Эти показатели могут быть использованы как критерий прогнозирования высокого риска рецидивирования камнеобразования в послеоперационном периоде. Уменьшение концентрации остеопонтина при первичном нефролитиазе по сравнению с показателями условно здоровых добровольцев может быть следствием того, что остеопонтин включается в состав кальций-оксалатных конкрементов. Например, при экспериментальном нефролитиазе у крыс ранее было установлено снижение экспрессии остеопонтина [7].
И хотя известно, что последний проявляет антилитогенный эффект, предотвращая адгезию кристаллов к эпителиальным клеткам почек [2], в нескольких других исследованиях сообщалось, что остеопонтин увеличивает риск образования кальций-оксалатных камней за счет повреждения клеток почечных канальцев и адгезии кристаллов к эпителию [5, 7].
В исследовании показано, что у пациентов с нефролитиазом имеется дефицит витамина D, причем его уровень статистически значимо не различается при первичном и рецидивирующем нефролитиазе. При этом результаты ряда исследований, посвященных оценке связи между уровнем витамина D сыворотки/плазмы крови и нефролитиазом, нередко неоднонаправленные, а их авторы часто противоречат друг другу. Тем не менее показано, что дефицит витамина D часто обнаруживается у больных МКБ, хотя в настоящее время и представлено крайне мало работ, в которых рассматривается проблема дефицита витамина D среди лиц с нефролитиазом и необходимости его коррекции. Полученные в настоящей работе значения биохимических показателей отличаются от таковых других исследований [16–18], что может быть связано с особенностями рациона питания и уровня инсоляции в различных регионах.
Установлено, что уровень кальция крови статистически значимо не связан ПТГрП. Данный факт позволяет предположить, что этот белок имеет другие механизмы влияния на МКБ, в том числе учитывая и полученные сведения о более высоком уровне этого белка у пациентов с первичным и рецидивным нефролитиазом по сравнению с условно здоровыми людьми.
Заключение. Определение уровня ПТГрП и остеопонтина у пациентов с МКБ позволяет прогнозировать риск рецидива образования камней на стадии первичного кальций-оксалатного нефролитиаза. При этом на основании показателя ПТГрП можно прогнозировать риск развития МКБ у условно здоровых лиц, что может быть использовано для направленной профилактики неблагоприятного течения МКБ путем своевременного назначения рациональной терапии и коррекции диеты. В исследовании получены данные, указывающие на то, что уровень ПТГрП не влияет на уровень кальция крови и, возможно, имеет другие механизмы влияния на развитие МКБ в отличие от ПТГ. Требуются дальнейшие исследования для подтверждения роли ПТГрП в патогенезе МКБ.



