Введение. Доброкачественная гиперплазия предстательной железы (ДГПЖ) является одним из наиболее распространенных заболеваний в структуре урологических заболеваний у мужчин старшей возрастной группы. Нарушения мочеиспускания вследствие ДГПЖ являются одним из наиболее частых поводов обращения к врачам. В этом случае консервативное лечение мужчин является первым этапом лечения, однако при его неэффективности, наличии других осложнений заболевания (рецидивирующие острые задержки мочи, рецидивирующие эпизоды макрогематурии и инфекции нижних мочевыводящих путей, камни мочевого пузыря, хроническая задержка мочи) пациентам показано оперативное лечение. Трансуретральная резекция предстательной железы (ТУР ПЖ) – один из наиболее часто применяемых вариантов оперативного лечения мужчин с клинически значимой ДГПЖ. Она заключается в эндоскопическом удалении аденоматозной ткани ПЖ в границах между шейкой мочевого пузыря и семенным бугорком, является «золотым» стандартом оперативного лечения при небольших (объемом от 30 до 80 см3) размерах ПЖ, согласно рекомендациям Европейской ассоциации урологов.
Развитие технологий позволило снизить частоту осложнений и летальность после ТУР ПЖ, однако на сегодняшний день показатели остаются значительными (11,1 и 0,1% соответственно) [1]. Также процент негативных последствий операций может быть связан с сохранением беспокоящих симптомов нижних мочевыводящих путей (СНМП), которое наблюдают у 30% оперированных мужчин [2]. Значительной части пациентов, перенесших ТУР ПЖ, требуется медикаментозное лечение в отдаленном послеоперационном периоде, и в РФ нет стандартных подходов к назначению препаратов этим пациентам [3]. Известно также, что интенсивность воспаления ПЖ коррелирует со степенью выраженности СНМП, что часто служит поводом для обращения к врачам [4]. После ТУР ПЖ могут развиваться инфекционные (воспаление уретры, предстательной железы, яичек), рубцовые (стриктуры уретры и склероз шейки мочевого пузыря), геморрагические (гемотампонада мочевого пузыря, возникающая острая задержка мочеиспускания, необходимость проведения гемотрансфузии) осложнения. Также к осложнениям относят ретроградную эякуляцию и эректильную дисфункцию.
Актуальна оптимизация послеоперационного ведения пациентов с целью улучшения качества жизни и снижения частоты негативных последствий операции. Определенный интерес представляет применение в комплексной терапии препарата бовгиалуронидазы азоксимер (Лонгидаза®). Фермент гиалуронидаза в составе данного препарата оказывает прямое противофиброзное действие, а также обладает проводниковым эффектом, улучшая проникновение в очаг компонентов комплексной лекарственной терапии.
Цель исследования: оценить эффективность применения препарата Лонгидаза® (ректальные суппозитории активностью 3000 МЕ) в составе комплексной терапии с целью профилактики осложнений после ТУР ПЖ.
Материалы и методы. В открытое проспективное мультицентровое сравнительное исследование включены 202 мужчины с клинической формой ДГПЖ после ТУР ПЖ. Исследование проводилось с 2018 по 2020 г. Набор пациентов осуществляли на трех клинических базах кафедры урологии и андрологии ФГАОУ ВО РНИМУ им. Н. И. Пирогова: Городская клиническая больница (ГКБ) № 1 им. Н.И. Пирогова, ГКБ № 29 им. Н. Э. Баумана, ГКБ им. В. В. Виноградова. Предоперационное обследование включало сбор жалоб, анамнеза, заполнение опросника международной системы суммарной оценки симптомов болезней предстательной железы и оценки качества жизни (International prostate system score, IPSS, и Quality of Life, QoL), УЗИ мочевыводящих путей с определением объема предстательной железы и объема остаточной мочи, урофлоуметрию, анализ мочи, посев мочи, исследование уровня общего простатического специфического антигена (ПСА) в сыворотке крови. Ультразвуковые исследования проводили на аппарате Toshiba Aplio 300, урофлоуметрию – на аппарате MMS Flowmaster. Критерии включения в исследование: проведение ТУР ПЖ по поводу ДГПЖ, возраст 50 лет и старше, общий ПСА сыворотки крови менее 10 нг/мл. Также в исследование включали мужчин с цистостомическим дренажем, установленным не более чем за 3 мес. до операции.
Критерии исключения: декомпенсированные хронические заболевания; уровень сывороточного ПСА более 10 нг/мл или уровень сывороточного ПСА от 4 до 10 нг/мл в случаях, когда врач-исследователь не может исключить наличие рака ПЖ; верифицированный рак ПЖ; склероз шейки мочевого пузыря или стриктуры уретры, уретерогид-ронефроз, дивертикулы мочевого пузыря, а также трансуретральные оперативные вмешательства в анамнезе.
До операции все пациенты получали антибактериальные препараты, согласно предоперационному посеву мочи, при наличии цистостомического дренажа, а при стерильном посеве мочи – периоперационную антибиотикопрофилактику фторхинолонами. Операции проводили в условиях эндоскопических операционных под спинальной анестезией с применением стандартных резектоскопов и биполярных электроинструментов. Трансуретральную резекцию ПЖ выполняли по стандартной методике с удалением аденоматозной ткани в пределах от шейки мочевого пузыря до семенного бугорка. Время катетеризации мочевого пузыря составило 3 дня.
В послеоперационном периоде на 1-сутки после удаления уретрального катетера (визит 1) всем пациентам назначали антибактериальную терапию (Левофлоксацин 500 мг внутрь 1 раз в сутки) на 5 дней и α1-адреноблокатор (Силодозин 8 мг внутрь 1 раз в сутки) в течение 1 мес. После подписания информированного добровольного согласия пациентов рандомизировали в одну из групп наблюдения: основную с дополнительным назначением препарата Лонгидаза® в виде свечей № 20 по схеме и контрольную. Схема приема Лонгидазы: по 1 свече ректально на ночь со дня включения в исследование через день № 10, затем по 1 свече на ночь через 2 дня также № 10. Продолжительность курса лечения составила 7 нед.
Наблюдение осуществляли в течение 6 мес. с явками через 20 дней (визит 2), через 2 мес. (визит 3), через 3 мес. (визит 4) и через 6 мес. (визит 5) после операции. Во время визита заполняли опросник IPSS и QoL, проводили лабораторные исследования (общий анализ мочи, посев мочи), трансректальное УЗИ, урофлоуметрию (с определением пиковой скорости потока мочи – Qmax), УЗИ с определением объема остаточной мочи. Наличие рубцового осложнения после ТУР ПЖ (стриктура уретры или склероз шейки мочевого пузыря) подтверждалось жалобами на преимущественно обструктивные СНМП, данными урофлоуметрии с характерной по форме «плато» кривой потока мочи и ретроградной уретрографии. При подтверждении бактериурии, уретрита, эпидидимоорхита, простатита пациентам назначали соответствующую антибактериальную терапию. При бактериурии без острого воспаления мочеполовых органов антибактериальная терапия не проводилась.
Контрольными точками исследования являлись изменение показателей IPSS и QoL, объема предстательной железы, показателей урофлоуметрии, продолжительность лейкоцитурии и бактериурии после операции, частота инфекционных осложнений или повторное назначение антибактериальных препаратов, частота геморрагических осложнений, частота развития рубцовых осложнений (склероз шейки мочевого пузыря или стриктура уретры) в течение 6 мес. после операции.
Статистическую обработку результатов исследования выполняли с использованием программ MS Excel и GraphPad Prism 8. Для проверки нормальности распределения полученных непрерывных переменных применяли критерий Шапиро–Уилка. При нормальном распределении показателей данные представляли в виде среднего арифметического (M) и стандартного отклонения (s) в формате M±s, в остальных случаях – в виде медианы с указанием интерквартильного размаха (Мe [Q1; Q3]). Различия считали статистически значимыми при р<0,05 при использовании t-критерия Стьюдента или U-критерия Манна–Уитни соответственно.
Результаты. В основную группу были включены 96 мужчин, в контрольную – 106, совершили все 5 визитов 91 и 99 мужчин соответственно. Причиной исключения из исследования стали выявление аденокарциномы ПЖ (n=3), невозможность проводить контрольные обследования и отказ от повторных визитов (n=9). Средний возраст мужчин составил 67,7±7,7 (50–88) года, медиана общего ПСА сыворотки крови – 3,1 [1,6; 5,7] нг/мл. Конкременты мочевого пузыря в основной группе выявлены у 21% больных, в контрольной – у 12% (p>0,05). Среднее значение объема предстательной железы составило 71±19 (30–272) см3, медиана балла IPSS – 27 [23; 30], медиана индекса качества жизни – 5 [4; 6], среднее значение Qmax – 7,5±2,5 (1,3–18,7) мл/с.
 До операции группы статистически значимо не различались по следующим показателям: возраст, общий ПСА сыворотки крови, IPSS, индекс качества жизни, объем предстательной железы, Qmax. Также, несмотря на большую частоту наличия цистостомических дренажей в группе контроля (41 против 25 %), не выявлено значимых различий по показателям бактериурии, лейкоцитурии и эритроцитурии (табл. 1).
До операции группы статистически значимо не различались по следующим показателям: возраст, общий ПСА сыворотки крови, IPSS, индекс качества жизни, объем предстательной железы, Qmax. Также, несмотря на большую частоту наличия цистостомических дренажей в группе контроля (41 против 25 %), не выявлено значимых различий по показателям бактериурии, лейкоцитурии и эритроцитурии (табл. 1).
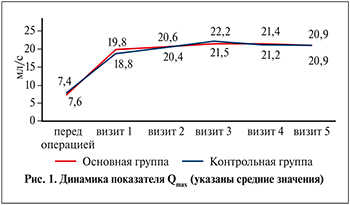
К концу 6-го месяца наблюдения среднее уменьшение балла IPSS составило 85% для основной группы и 83% – для контрольной. Показатель домена качества жизни (QoL) улучшился на 80 и 75% в основной и контрольной группах соответственно. Показатель Qmax вырос до 20,9±7,4 мл/с. Существенных различий по показателям опросника IPSS, QoL, урофлоуметрии и по объему остаточной мочи в группах в течение всего времени наблюдения не выявлено (рис. 1 и 2).

Геморрагические осложнения с гемотампонадой мочевого пузыря развились у 4 мужчин (по 2 из каждой группы). Гемотампонада во всех случаях разрешалась катетеризацией мочевого пузыря катетером Фолея, эвакуацией сгустков, установкой системы орошения мочевого пузыря и последующим удалением уретрального катетера через 2–3 сут. Ни одному из мужчин не потребовалась гемотрансфузия.
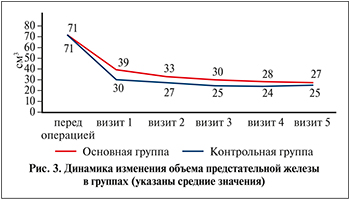 Динамика послеоперационного уменьшения отека предстательной железы в группах различалась. Через 1 мес. после операции в основной группе уменьшение объема предстательной железы составило в среднем 6 см3, в контрольной – 3 см3, еще через 1 мес. – 3 и 2 см3 соответственно. По прошествии 6 мес. после операции на фоне лечения препаратом Лонгидаза® уменьшение объема ПЖ суммарно составило 12 см3 (с 39±14 до 27±9 см3), тогда как в контрольной группе – 5 см3 (с 30±10 до 25±8 см3) (p<0,05; рис. 3).
Динамика послеоперационного уменьшения отека предстательной железы в группах различалась. Через 1 мес. после операции в основной группе уменьшение объема предстательной железы составило в среднем 6 см3, в контрольной – 3 см3, еще через 1 мес. – 3 и 2 см3 соответственно. По прошествии 6 мес. после операции на фоне лечения препаратом Лонгидаза® уменьшение объема ПЖ суммарно составило 12 см3 (с 39±14 до 27±9 см3), тогда как в контрольной группе – 5 см3 (с 30±10 до 25±8 см3) (p<0,05; рис. 3).
Статистически значимые различия между группами отмечены в частоте лейкоцитурии через 3 мес. после операции, а также в частоте лейкоцитурии и бактериурии через 6 мес.
К концу наблюдения лейкоцитурия у мужчин основной группы уменьшилась на 73%, контрольной – на 44%, бактериурия – на 31 и 8% соответственно (табл. 2). Эти сравнения проведены с результатами раннего послеоперационного периода, после удаления уретрального катетера (визит 1). Частота повторного назначения антибактериальных препаратов и инфекционных осложнений в основной группе составила 17,7%, в контрольной – 20,7% (p>0,05).

По результатам наблюдения достоверных различий в частоте формирования стриктур уретры или склероза шейки мочевого пузыря выявлено не было (в основной группе у 7 [7,3%] мужчин, в контрольной – у 8 [7,5%], p>0,05).
Обсуждение. Несмотря на внедрение современных технологий и методик, частота осложнений после ТУР ПЖ сохраняется на довольно высоком уровне. По результатам современных рандомизированных клинических исследований частота инфекций мочевыводящих путей составляет 4,1 (0–22)%, частота гемотампонады – 4,9 (0–39)% [5]. Рубцовые осложнения (в том числе склероз шейки мочевого пузыря) в среднем встречаются в 4,7% случаев, стриктуры уретры – в 3,8% [6]. По данным других авторов, частота рубцовых осложнений может достигать 10–15% [7, 8]. Лечение пациентов со стриктурами уретры после трансуретральных вмешательств зачастую сопряжено с трудностями и требует применения различных реконструктивных методик [10]. К процессам с негативными последствиями после ТУР ПЖ относятся бактериальное инфицирование с формированием биопленок, сохраняющееся воспаление с включением механизмов патологического заживления через избыточную продукцию соединительной ткани и исходом в фиброз, а также отек и нарушение на этом фоне микроциркуляции в тканях предстательной железы.
Гиалуронидазы – группа ферментов, способных расщеплять кислые полисахариды, в частности гликозаминогликаны – основное вещество соединительной ткани. Они открыты в 1928 г. как фактор распространения (англ. spreading factor) вследствие его способности увеличивать скорость распространения вирусных вакцин от места подкожной инъекции. В организме человека идентифицировано несколько типов гиалуронидазы, локализованных как в цитоплазме клеток, так и во внеклеточном матриксе. Согласованная работа этих ферментов способствует поддержанию оптимального баланса гиалуроновой кислоты в соединительной ткани. Модификация свойств гиалуроновой кислоты с помощью гиалуронидазы позволяет эффективно управлять регенераторным потенциалом клеток внеклеточного матрикса и тем самым значительно влиять на течение репаративных процессов в тканях [11]. Этот фермент облегчает циркуляцию жидкостей в межтканевых пространствах, увеличивает проницаемость тканей, замедляет и предотвращает рост соединительной ткани при различных заболеваниях. Благодаря своему действию гиалуронидаза ликвидирует причину гиперплазии соединительной ткани, подавляя воспалительный процесс. Действие гиалуронидазы носит обратимый характер. При снижении ее концентрации вязкость гиалуроновой кислоты восстанавливается. Под действием гиалуронидазы гиалуроновая кислота теряет способность связывать воду, облегчается движение жидкости в межклеточном пространстве, уменьшаются отеки, рассасываются гематомы. Гиалуронидаза снижает вязкость матрикса соединительной ткани, увеличивает проницаемость тканевых барьеров, повышает эластичность тканей. При использовании ректальных свечей это обеспечивает беспрепятственный обмен между сосудами и тканью ПЖ [12].
Препарат Лонгидаза® содержит иммобилизованную гиалуронидазу – конъюгат гиалуронидазы с высокомолекулярным носителем. Она является препаратом, широко применяемым не только в урологической практике (при хронических циститах, простатитах, болезни Пейрони с целью профилактики формирования стриктур уретры и мочеточников после операций), но и в дерматологии, гинекологии, офтальмологии [13–19]. Также существует опыт его применения в сочетании с физиопроцедурами [20]. Отмечена способность Лонгидазы® положительно влиять на систему перекисного окисления липидов, тем самым повышая оплодотворяющую способность эякулята и увеличивая частоту зачатий [21].
Пролонгирование действия достигается ковалентным связыванием фермента с физиологически активным высокомолекулярным носителем (сополимер N-оксида 1,4-этиленпиперазина и (N-карбокси-метил)-1,4-этиленпиперазиний бромид), обладающим собственной фармакологической активностью. Биохимическими, иммунологическими, гистологическими и электронно-микроскопическими исследованиями доказано, что бовгиалуронидаза азоксимер не повреждает нормальную соединительную ткань, но вызывает деструкцию аномальной по составу и структуре соединительной ткани в области фиброза, не оказывает мутагенного, эмбриотоксического, тератогенного и канцерогенного действий.
Преимущества конъюгированной формы гиалуронидазы [22]:
- высокая ферментативная активность (в 1,5 раза выше, чем у нативной гиалуронидазы);
- устойчивость к действию протеаз и ингибиторов сыворотки крови (в 50 раз устойчивее нативной гиалуронидазы, ферментативная активность Лонгидазы сохраняется при нагревании до 37°С в течение 20 сут., нативная гиалуронидаза в тех же условиях утрачивает свою активность в течение 24 ч);
- снижение аллергенности и токсичности (по сравнению с нативной гиалуронидазой);
- противовоспалительная активность (антиоксидантное, хелатирующее и антирадикальное действия). В препарате Лонгидаза® реализовано одновременное локальное присутствие протеолитического фермента гиалуронидазы и носителя, способного связывать освобождающиеся при гидролизе компонентов матрикса ингибиторы фермента и стимуляторы синтеза коллагена (ионы железа, меди, гепарин и др.), таким образом подавляется обратная регуляторная реакция, направленная на синтез компонентов соединительной ткани.
Ферментный препарат Лонгидаза® обладает комплексным эффектом, воздействуя на все этапы патологического воспаления:
- противофиброзное действие: препятствует разрастанию соединительной ткани и уменьшает выраженность уже сформированного фиброза (связывание ионов железа, гидролиз гликозаминогликанов, восстановление микроциркуляции и нормализация тканевого гомеостаза);
- микроциркуляционное действие: уменьшает отек и восстанавливает микроциркуляцию в тканях (гидролиз гликозаминогликанов, снижение вязкости гликозаминогликанов, повышение проницаемости тканей, уменьшение отеков);
- противовоспалительное действие: регуляция выработки медиаторов воспаления – интерлейкина (ИЛ) 1, фактор некроза опухоли α (ФНОα) – ослабление острой фазы воспаления;
- повышение гуморального иммунного ответа и резистентности организма к инфекции.
В связи с вышеизложенным нами проведено проспективное мультицентровое рандомизированное исследование применения препарата Лонгидаза® с целью снижения частоты осложнений после ТУР ПЖ у мужчин в рутинной практике. Качество жизни и качество мочеиспускания у мужчин после операции в нашей работе соответствовало данным других авторов [5]. Так, по сравнению с дооперационными показателями к 6-му месяцу наблюдения среднее уменьшение балла IPSS составило 85 и 83%, показатель домена качества жизни (QoL) улучшился на 80 и 75% в основной и контрольной группах соответственно. Различий в оценке жалоб и качества жизни в группах не выявлено. Пиковая объемная скорость потока мочи у мужчин спустя 6 мес. наблюдения оказалась сопоставимой в обеих группах со средним значением, превышающим 20 мл/с. Таким образом, существенного влияния препарата Лонгидаза® на динамику жалоб мужчин и скорость потока мочи в настоящей работе мы не выявили.
Проблемы инфекционных осложнений после ТУР ПЖ связаны с биологическим статусом микроорганизма, с одной стороны, и с барьером, препятствующим проникновению многих антибиотиков, с другой. Только некоторые препараты в достаточной мере способны проникать в секрет ПЖ [23]. Предположение, что при сочетанном применении с антибактериальными средствами Лонгидаза® повышает их эффективность в отношении бактерий в составе биопленок, увеличивая проникновение антибактериальных средств к клеткам бактерий в биопленке и обеспечивая потенцирование их антибактериального эффекта, нашло свое подтверждение. Доказано, что Лонгидаза®, действуя на бактериальные биопленки E. faecalis, E. coli и S. aureus, снижает их объем более чем наполовину [24]. Такое гидролитическое действие ферментного препарата на матрикс биопленки обеспечивает высвобождение планктонных клеток из ее структуры, что позволяет снижать дозу и повышать безопасность антибактериальных средств при сохранении их эффективности.
В работе Э. А. Баткаева [25] включение в комплексную терапию бактериального простатита протеолитического ферментного препарата Лонгидаза® совместно с антибиотиком позволило добиться более высоких результатов этиологического и клинического излечения по сравнению с группой контроля [25]. Включение в традиционное лечение мужчин после ТУР ПЖ Лонгидазы по сравнению с отсутствием препарата нормализует в крови содержание СD3+-, CD8+-, CD16+-клеток, ФНОα, интерлейкина (ИЛ)-1β, ИЛ-8 повышает НСТ-сп., НСТ-ст., в секрете ПЖ – концентрацию ФНОα. Свечи с Лонгидазой® более эффективно корригируют показатели иммунного статуса в секрете ПЖ [26]. По результатам работы О. В. Теодоровича и соавт. [27] у мужчин с ДГПЖ и хроническим простатитом после ТУР ПЖ на фоне применения свечей Лонгидаза® отмечена меньшая частота инфекционно-воспалительных изменений (17,9 против 32% в контрольной группе). Так, было отмечено снижение в моче таких провоспалительных цитокинов, как ФНОα, ИЛ-1β, -2, -8, С3, повышение противовоспалительного маркера ИЛ-10, изменение маркеров оксидативного стресса. Более того, Лонгидаза® (ректальные свечи) зарекомендовала себя как лекарственное средство, которое можно использовать с целью диагностики латентно-бактериальной формы хронического простатита, поскольку способствует выявлению инфекционного агента и воспаления, снижая частоту абактериального простатита при обследовании мужчин [28].
В нашей работе тезис о том, что применение препарата Лонгидаза® повышает эффективность антибактериальной терапии, способствуя элиминации возбудителей из очага воспаления за счет увеличения биодоступности антибиотиков и других лекарственных средств, также нашел подтверждение. Несмотря на сопоставимую частоту лейкоцитурии и бактериурии в ближайшие месяцы после операции, по прошествии 3 и 6 мес. различия между группами стали существенными. Это обусловило, в частности, тот факт, что в группе Лонгидазы® частота повторного назначения антибактериальных препаратов и инфекционных осложнений оказалась ниже, чем в контрольной группе (17,7 против 20,7%). Таким образом, недостаточное проникновение препаратов в ПЖ, очаг воспаления у больных отрицательно сказываются на результатах лечения. В этом случае антибактериальная терапия не приводит к полному регрессу процесса депонирования коллагена, индуцированного бактериальным воспалением в ПЖ. Можно сделать вывод: клинически важным направлением терапии мужчин после ТУР ПЖ является раннее назначение ферментных препаратов, в частности препарата Лонгидаза®, с целью профилактики и лечения фиброза в ПЖ.
Еще одной из основных задач работы являлась оценка возможности снижения частоты рубцовых осложнений после операции. В нашей работе достоверных различий в частоте склероза шейки мочевого пузыря или стриктуры уретры не выявлено (7% в основной группе и 8% – в контрольной). Частота повторных эндоскопических операций, по данным Европейской ассоциации урологов, постоянна и составляет в среднем 1–2% в год. Отсутствие разницы между исследуемыми группами по частоте рубцовых осложнений можно объяснить отсутствием эффекта препарата Лонгидаза® в профилактике стриктур уретры в ближайшем послеоперационном периоде, однако формирование стриктур уретры может происходить и в отдаленном периоде [29]. В таком случае для оценки их формирования нужно более продолжительное наблюдение и более длительный курс приема препарата Лонгидаза® по сравнению с 7-недельным курсом лечения в настоящей работе. Так, в современных рандомизированных клинических исследованиях, оценивающих частоту повторных операций после ТУР ПЖ, сроки наблюдения составляют от 1 года до 8 лет [30].
К основным терапевтическим эффектам препарата относят подавление способности гликозаминогликанов связывать воду, что уменьшает вязкость экстрацеллюлярного матрикса соединительной ткани. Клинически в настоящей работе выразилось в большей степени уменьшением отека ПЖ. Так, по сравнению с ранними послеоперационными показателями объема ПЖ через 6 мес. на фоне лечения препаратом Лонгидаза® объем ПЖ уменьшился в среднем на 12 см3 против 5 в контрольной группе. Это объясняется снижением отечности, улучшением микроциркуляции, усилением обмена веществ в тканях, облегчением движения жидкости в межклеточном пространстве, рассасыванием воспалительных экссудатов, гематом, инфильтратов.
При использовании препарата Лонгидаза® у исследуемых нами мужчин не отмечено побочных явлений, также не отмечено раздражающего действия суппозиториев на слизистую прямой кишки или послабляющего эффекта. Отказа от приема препарата не было, а завершение всеми пациентами полного курса приема препарата свидетельствует о хорошей приверженности терапии.
Заключение. Наш опыт свидетельствует об эффективности и безопасности применения препарата Лонгидаза® в раннем послеоперационном периоде после ТУР ПЖ. Препарат Лонгидаза® приводит к уменьшению отека ПЖ, снижает частоту повторной бактериурии, лейкоцитурии, что выражается в тенденции к снижению частоты инфекционных осложнений и дополнительного назначения антибактериальных препаратов. Отсутствие каких-либо выраженных побочных явлений за время наблюдения характеризует препарат благоприятным соотношением «польза–риск», что позволяет рекомендовать его использование в широкой клинической практике.



