Введение. Со времени своего зарождения в 1976 г. перкутанная нефролитотрипсия (ПНЛ) остается одним из основных способов оперативного удаления камней почек. Благодаря своей малоинвазивности, низкой частоте осложнений, высокой эффективности ПНЛ нашла широкое распространение во многих урологических стационарах [1].
Развитие оперативной техники ПНЛ неразрывно связано с научно-техническим прогрессом, особенно в последнее десятилетие. Прорыв в совершенствовании медицинского инструментария, оптических систем, методик дезинтеграции конкрементов позволил расширить область применения ПНЛ.
Европейская ассоциация урологов (EAU) на протяжении многих лет считает ПНЛ оптимальным способом удаления камней почек размером более 2 см [2]. Для конкрементов меньшего диаметра предпочтение отдается дистанционной литотрипсии (ДЛТ) как наименее инвазивному способу, а также трансуретральной нефролитотрипсии с возможным использованием гибкого инструментария [3]. В то же время хорошо известны случаи безуспешного применения ДЛТ (в том числе нескольких последовательных сеансов) при плотных камнях, что значительно увеличивает сроки лечения и его затратность [4, 5]. При увеличении числа сеансов дробления растет вероятность образования гематом почки. Возможное формирование «каменных дорожек» в мочеточнике может провоцировать почечные колики, требующие повторных госпитализаций в стационар, выполнения дополнительных процедур, таких как стентирование или нефростомия [6]. Применение трансуретральной нефролитотрипсии помимо высокой стоимости оборудования и расходных материалов главным образом лимитировано необходимостью постоянной ирригации, а при ухудшении эндоскопической видимости – активной принудительной ирригации, что значительно увеличивает риск воспалительных осложнений за счет резкого повышения внутрилоханочного давления в процессе вмешательства, особенно в случае отказа от использования мочеточниковых кожухов [7]. Все вышеперечисленное заставляет искать новый более эффективный и безопасный способ оперативного лечения камней почек, способствующий ранней реабилитации пациентов.
Основным вектором развития методики ПНЛ является прогрессивное уменьшение размеров пункционного доступа и диаметра нефроскопов. Стандартный доступ размером 24–30 F (по шкале Шаррьера) показал себя достаточно эффективным в отношении удаления крупных, в том числе коралловидных, камней. В то же время при данном диаметре нефроскопического кожуха (тубуса нефроскопа) значительно увеличивается риск как интра-, так и послеоперационного кровотечения, который может достигать 18% [8]. Несмотря на то что пункция чашечно-лоханочной системы (ЧЛС), как правило, осуществляется по бессосудистой линии Brodel, возникновение кровотечения чаще всего обусловлено травматичной дилатацией хода бужами возрастающего размера, а также повреждением шеек чашечек при установке кожуха и маневрировании нефроскопом [8]. В связи с этим появилась необходимость поиска новых щадящих методик чрескожного доступа к почке.
Дальнейшая миниатюризация хирургического инструментария оказалась возможной благодаря накоплению и суммированию имеющегося опыта выполнения эндоскопических малоинвазивных операций взрослым и детям [9, 10]. Таким образом, были разработаны и внедрены в клиническую практику методики мини-ПНЛ с размером пункционного доступа 22–14 F и ультрамини-ПНЛ, при которой диаметр хода составляет 13–9 F. При этом удаление раздробленных фрагментов происходит за счет пассивной литоэвакуации с использованием принципа Бернулли [11, 12].
Последующее технологическое развитие чрескожной хирургии нефролитиаза привело к появлению микро-ПНЛ, впервые описанной Bader et al. в 2011 г. [13]. Принципиальной особенностью метода является возможность пункции почки не только под рентгенологическим или ультразвуковым, но и под эндоскопическим контролем, что значительно уменьшает риск повреждения крупных сосудов и соседних органов. При этом размер пункционного доступа составляет 8–4,85 F.
Цель исследования: изучение возможностей микро-ПНЛ и определение ее места в комплексном лечении камней почек.
Материалы и методы. В исследование включены 74 пациента, которым с января 2017 по декабрь 2018 г. выполнено оперативное лечение в объеме лазерной микро-ПНЛ. Все операции проведены сотрудниками Городской клинической больницы им. Д. Д. Плетнева Москвы и клинической больницы Святителя Луки Санкт-Петербурга.
Возраст больных варьировался от 19 лет до 81 года (49,8±16,3 года), при этом пациентов мужского пола было 35, женского – 39. Во всех случаях проводилось стандартное комплексное клинико-лабораторное обследование, начатое со сбора и изучения жалоб и анамнеза, физикального осмотра. Лабораторные исследования включали клинический, биохимический анализ крови, общий анализ мочи, коагулограмму, а также посев мочи с определением чувствительности к антибиотикам. С целью оценки локализации и размера конкрементов выполняли УЗИ, обзорную урографию и КТ. Выполнение мультиспиральной КТ позволило более точно определить расположение камня и изучить его плотность. В послеоперационном периоде проводили контрольные лабораторные анализы, УЗИ, обзорную урографию. Спустя 1 мес. после операции для выявления резидуальных фрагментов выполняли мультиспиральную КТ.
По результатам предоперационного обследования подавляющее большинство составили пациенты с изолированными камнями почек – 64 (86,4%) человека. У остальных пациентов имелось сочетание камней разной локализации: 6 больных с камнями лоханки и нижней чашечки, 3 – с камнями лоханки и средней чашечки и 1 – с сочетанием камня нижней чашечки и лоханочно-мочеточникового сегмента. В группе пациентов с изолированными камнями чаще всего диагностировали одиночные камни лоханки – 33 (51,5%) и камни нижней чашечки – 23 (35,9%). Также были прооперированы пациенты с одиночными камнями средней (n=5) и верхней (n=3) чашечек. Продолжительность оперативного вмешательства помимо локализации конкрементов определяется их размером и плотностью. В работе оценивали наибольший поперечный размер конкремента. При наличии у пациента множественных конкрементов определялся их суммарный размер. Таким образом, в исследование были включены пациенты с размером камней почек от 8 до 35 мм (13,8±5,2 мм), плотностью от 350 до 1500 HU (946,8±264,8 HU).
У 46 (62,1%) пациентов размер камня не превышал 1,5 см, у 28 (37,9%) – был более 1,5 см. При этом 40 (54,0%) больных на момент госпитализации имели установленный внутренний стент со стороны операции в связи с имевшей место в анамнезе почечной коликой либо атакой пиелонефрита.
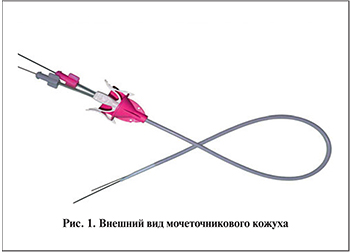 Техника микро-ПНЛ. Оперативные вмешательства проводили под эндотрахеальным наркозом в условиях рентгеноперационной с наличием рентгенотелевизионной С-дуги.
Техника микро-ПНЛ. Оперативные вмешательства проводили под эндотрахеальным наркозом в условиях рентгеноперационной с наличием рентгенотелевизионной С-дуги.
На предварительном этапе всем пациентам осуществляли уретроцистоскопию, катетеризацию почки со стороны предполагаемого оперативного вмешательства. С целью пассивной эвакуации фрагментов конкремента в процессе дробления большинству пациентов с размером камня более 1,5 см, а также ряду престентированных больных под рентгентелевизионным контролем предварительно устанавливали мочеточниковый кожух диаметром 10–12 F по струне-проводнику (рис. 1). Всего мочеточниковый кожух был установлен 42 (56,7%) пациентам. В остальных наблюдениях катетеризацию почки проводили мочеточниковым катетером либо наружным стентом диаметром 5–7 F. Трансуретральная катетеризация почки давала возможность интраоперационного контрастирования и при необходимости – дилатации ЧЛС для прицельной пункции почки, предотвращала миграцию крупных фрагментов конкремента в мочеточник, а также позволяла отмывать мелкие фрагменты камня (до 3 мм) через мочеточниковый кожух.
 Большинство операций (54 [72,9%]) проведено в положении больного на животе, остальные 20 (27,1%) – в положении на спине.
Большинство операций (54 [72,9%]) проведено в положении больного на животе, остальные 20 (27,1%) – в положении на спине.
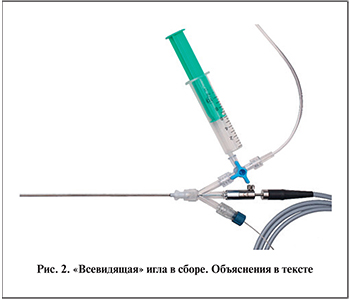
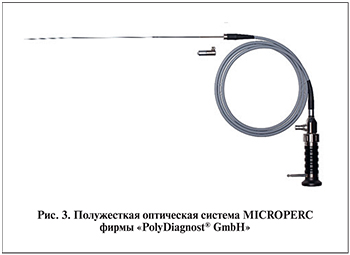
Микро-ПНЛ выполняли с помощью полужесткой оптической системы MICROPERC («PolyDiagnost® GmbH»; рис. 2, 3). Набор для микро-ПНЛ включает 2 вида рабочих тубусов размером 4,85 и 8 F (третий тубус размером 10,5 F по градации относится к ультрамини-ПНЛ). Рабочий тубус 4,85 F совместим с пункционной иглой, которая в комбинации с полужесткой оптикой и устройством фиксации составляет так называемую всевидящую иглу. Перфузионная трубка с трехходовым стопорным краном позволяет использовать ирригацию в процессе пункции и осуществлять при необходимости контрастирование ЧЛС. Полужесткая волоконно-оптическая система имеет толщину 0,9 мм, угол обзора 120 ° и разрешение 10 тыс. пикселей.
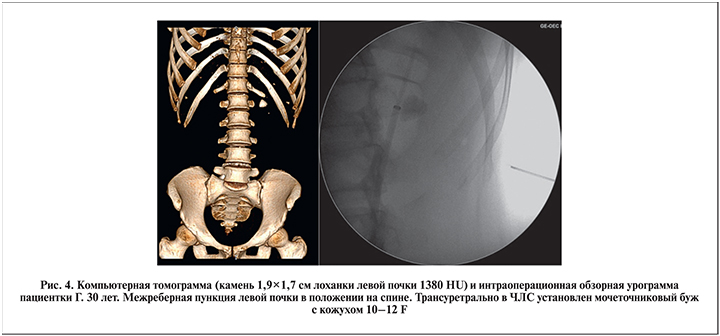
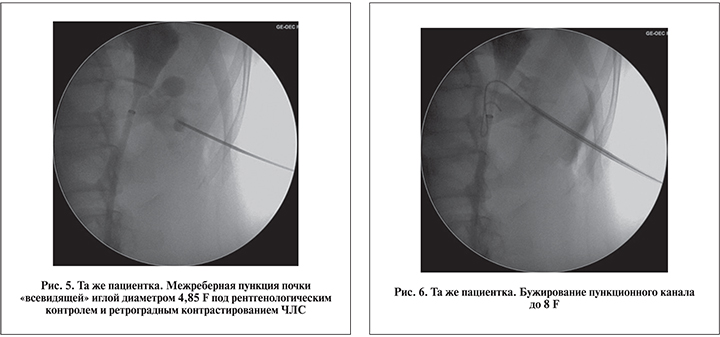
 Пункцию почки осуществляли под совмещенным рентгентелевизионным (ультразвуковым) и прямым эндоскопическим контролем. При этом к пункционной игле с рабочим тубусом 4,85 F напрямую присоединяли оптическую и ирригационную системы. Учитывая ограниченные возможности в манипулировании внутри почки полужестким инструментом диаметром 4,85 F, доступ по возможности формировали непосредственно на камень (высокая хрупкость оптики!). Сочетанная эндоскопическая визуализация с рентгеновским или ультразвуковым наведением позволяла оптимально создавать пункционный доступ для нефроскопического этапа. Достоверным признаком адекватной пункции было поступление мочи по внутреннему просвету иглы, а также собственно визуализация слизистой ЧЛС или камня. Если принималось решение об использовании тубуса 8 F (обычно в ситуациях, когда требовался нефроскопический осмотр чашечек, расположенных под углом к пункционному доступу), в ЧЛС проводили струну-проводник типа Лундерквист с прямым или изогнутым наконечником, по которой осуществляли бужирование пункционного хода до 8 F. После экстракции иглы к тубусу инструмента присоединяли специальный трехпортовый адаптер для подключения ирригационной трубки и проведения лазерного волокна и оптики. Учитывая необходимость активного маневрирования инструментом внутри собирательной системы почки, при камнях размером более 1,5 см в качестве рабочего тубуса чаще использовали более ригидный тубус размером 8 F (рис. 4–6).
Пункцию почки осуществляли под совмещенным рентгентелевизионным (ультразвуковым) и прямым эндоскопическим контролем. При этом к пункционной игле с рабочим тубусом 4,85 F напрямую присоединяли оптическую и ирригационную системы. Учитывая ограниченные возможности в манипулировании внутри почки полужестким инструментом диаметром 4,85 F, доступ по возможности формировали непосредственно на камень (высокая хрупкость оптики!). Сочетанная эндоскопическая визуализация с рентгеновским или ультразвуковым наведением позволяла оптимально создавать пункционный доступ для нефроскопического этапа. Достоверным признаком адекватной пункции было поступление мочи по внутреннему просвету иглы, а также собственно визуализация слизистой ЧЛС или камня. Если принималось решение об использовании тубуса 8 F (обычно в ситуациях, когда требовался нефроскопический осмотр чашечек, расположенных под углом к пункционному доступу), в ЧЛС проводили струну-проводник типа Лундерквист с прямым или изогнутым наконечником, по которой осуществляли бужирование пункционного хода до 8 F. После экстракции иглы к тубусу инструмента присоединяли специальный трехпортовый адаптер для подключения ирригационной трубки и проведения лазерного волокна и оптики. Учитывая необходимость активного маневрирования инструментом внутри собирательной системы почки, при камнях размером более 1,5 см в качестве рабочего тубуса чаще использовали более ригидный тубус размером 8 F (рис. 4–6).
Для дезинтеграции конкрементов применяли гольмиевые лазеры мощностью 50 (Auriga XL, Boston Scientific, США) и 100 Вт («Lumenis», Израиль), а также отечественный инновационный тулиевый волоконный лазер FiberLase U2 («ИРЭ-ПОЛЮС», Россия). Использовали волокна диаметром 200 мкм.
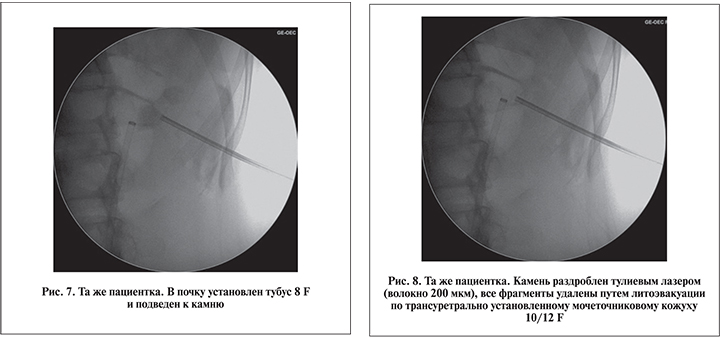
Для полного разрушения конкремента гольмиевым (47 [63,5%]) или тулиевым (27 [36,5%]) лазером использовали комбинацию режимов фрагментации и распыления («дастинга»). Для гольмиевой фрагментации камней в зависимости от модели лазера применяли энергию 0,6–1,2 Дж и частоту 12–40 Гц, для распыления камня – 0,2–0,8 Дж и 18–80 Гц соответственно. При волоконной тулиевой дезинтеграции камней в режиме «дастинга» рабочая пульсовая энергия составляла 0,025–0,5 Дж, частота – 30–100 Гц, в режиме фрагментации – 0,8–1,0 Дж и 6–10 Гц соответственно. В процессе дробления конкрементов изменяли настройки пульсовой энергии и частоты для достижения максимальной эффективности литотрипсии. В ходе операции мелкие фрагменты конкремента (до 3 мм) самопроизвольно вымывались по мочеточниковому кожуху (в тех случаях, когда его устанавливали; рис. 7, 8). При использовании в качестве основного тубуса 4,85 F целью литотрипсии было полное разрушение конкремента «в пыль», при котором не было необходимости в литоэвакуации.
Особенностью отечественного волоконного тулиевого лазерного аппарата (рис. 9) cтала минимальная ретропульсия камня при его дроблении. Высокие показатели литотрипсии достигаются путем распределения пиковой мощности по всей длине импульса, существенно увеличивая эффективность лазерного луча и, соответственно, снижая время операции на 30%. Возможности тулиевого лазера позволяют расширить показания к микро-ПНЛ в сторону камней большего диаметра.
 Результаты дезинтеграции конкремента оценивали интраоперационно нефроскопически и рентгеноскопически. Необходимости в дренировании почки нефростомическим дренажем не было ни в одном из наблюдений.
Результаты дезинтеграции конкремента оценивали интраоперационно нефроскопически и рентгеноскопически. Необходимости в дренировании почки нефростомическим дренажем не было ни в одном из наблюдений.
В подавляющем большинстве случаев в почке оставлялся мочеточниковый катетер или наружный стент. Двадцати четырем (32,4%) пациентам потребовалась установка внутреннего стента во время операции в связи с массой мелких резидуальных фрагментов.
Эффективность проведенного оперативного лечения оценивали по таким характеристикам, как время операции, наличие резидуальных фрагментов, необходимость повторного оперативного вмешательства, частота осложнений, продолжительность послеоперационного койко-дня, а также процент полного освобождения почек от конкрементов.
Результаты. С учетом вариабельности продолжительности этапа катетеризации почки, необходимости перемещения ряда пациентов в положение на животе время операции в исследовании отсчитывали строго от начала пункции ЧЛС и до удаления инструмента. Средняя продолжительность оперативного вмешательства в исследуемой группе составила 30,6±11,6 мин. При этом максимальное время операции составило 72 мин, минимальное – 13 мин. На данный показатель существенно влияли размер конкремента и его плотность. Чем больше был размер камня и чем более плотной была его структура по данным предоперационной КТ, тем больше времени требовалось на его разрушение.
Для оценки эффективности очищения почки от конкрементов в послеоперационном периоде всем больным на 1-е сутки выполняли рентгеновское и ультразвуковое исследование. На основании полученных данных принимали решение об удалении дренажей, а также проводили первичную оценку эффективности очищения почки от конкрементов. Окончательно об эффективности вмешательства судили по результатам бесконтрастной КТ почек, выполненной спустя 1 мес. после операции. Полное освобождение почек от конкрементов после однократно выполненной микро-ПНЛ отмечено у 89,1% больных. При этом эффективность микро-ПНЛ у пациентов с камнями размером менее 1,5 см составила 93,4%, у больных с конкрементами большего диаметра – 82,4%.
Интраоперационно 24 (32,4%) пациентам группы тех, кому микро-ПНЛ проводили без мочеточникового кожуха, был установлен внутренний стент в связи с большим количеством мелких резидуальных фрагментов с риском их миграции. У одного пациента в связи с интраоперационными техническими трудностями (поломка оптики) была выполнена конверсия в мини-ПНЛ. В послеоперационном периоде 2 (2,7%) пациентам потребовалось стентирование почки после удаления мочеточникового катетера по поводу развившихся почечных колик на фоне миграции фрагментов в мочеточник. Одному пациенту понадобилась экстренная госпитализация в связи с почечной коликой, не потребовавшей дренирования почки и купированной консервативно.
У 2 (2,7%) пациентов в послеоперационном периоде возникла гематурия, которая, однако, не сопровождалась выраженным снижением уровня гемоглобина и не потребовала переливания компонентов крови. У 6 (8,1%) прооперированных была зафиксирована лихорадка, регрессировавшая после коррекции антибактериальной терапии. Случаев кровотечения отмечено не было. В 7 (9,4%) наблюдениях понадобилось выполнение ДЛТ в связи с выявленными резидуальными камнями спустя 1 мес. после операции.
В целом малоинвазивный характер микро-ПНЛ, отсутствие необходимости в установке нефростомического дренажа, а также малый процент осложнений и дополнительных манипуляций способствуют ранней выписке больных из стационара с последующей их быстрой реабилитацией. Средний послеоперационный койко-день в исследовании составил 2,8 сут.
Обсуждение. Достижение максимальной эффективности оперативного вмешательства, а именно полное избавление пациента от камней почек за одну операцию при минимальном риске осложнений, остается первостепенной задачей современной перкутанной хирургии нефролитиаза. Последовательная миниатюризация хирургического инструментария привела к появлению минимально инвазивной техники чрескожного удаления камней почек – микро-ПНЛ.
Представленные в литературе публикации, посвященные микро-ПНЛ, характеризуются различным количиством пациентов и разнообразными результатами. Техника оптической пункции ЧЛС при помощи «всевидящей иглы» была впервые описана Bader et al. в 2011 г. [13]. В исследование были включены 15 пациентов, которым провели оптическую пункцию почки перед стандартной чрескожной нефролитотрипсией. Использование «всевидящей иглы» позволило оптимизировать пункционный доступ, тем самым уменьшив риск осложнений.
В нашем исследовании все пункции почки выполнялись под ультразвукэндоскопическим или рентгенэндоскопическим контролем после предварительно выполненной ретроградной пиелографии. При этом планирование доступа непосредственно на каменьсодержащую чашечку пациентов с наличием рентгенпозитивных конкрементов позволило избежать дополнительных движений инструментом внутри почки, что может быть причиной ухудшения качества эндоскопической видимости за счет усиления гематурии.
В большинстве работ микро-ПНЛ осуществлялась в положении больного на животе. В то же время описаны успешные результаты операции и в положении пациента на спине [14]. В нашей работе почти треть (27,1%) вмешательств выполнена в положении на спине. Технических отличий в формировании пункционного доступа в зависимости от особенностей укладки пациента выявлено не было.
При внедрении в клиническую практику стандартным показанием к микро-ПНЛ являлись одиночные камни почек размером не более 1,5 см [15–17]. Использование 8 F рабочего тубуса позволило рассмотреть вопрос о возможности выполнения микро-ПНЛ при камнях большего размера [18]. В литературе имеются данные, согласно которым при выполнении микро-ПНЛ через рабочий тубус 8 F для дезинтеграции камня можно использовать ультразвуковые зонды размером 4,85 F, а для экстракции фрагментов – экстракторы и щипцы размером 1,9–3 F [17, 19]. Интересна описанная Penbegul et al. [20] модификация микро-ПНЛ у детей, при которой вместо кожуха устанавливался ангиографический катетер размером 6,6 F.
В нашем исследовании у 37,9% пациентов имели место камни размером более 1,5 см. Для достижения максимального эффекта литотрипсии данной категории пациентов предварительно трансуретрально устанавливали мочеточниковый кожух размером 10–12 F, по которому фрагменты конкремента пассивно эвакуировались в ходе дробления. В литературе очень мало указаний на использование мочеточниковых кожухов в ходе микро-ПНЛ [21]. В то же время выполнение нефроскопии через тубус 8 F вместе с использованием мочеточниковых кожухов позволило достичь полного очищения почки от конкрементов у 82,4% пациентов с крупными камнями почек.
Согласно данным литературы, микро-ПНЛ в целом является высокоэффективным способом удаления камней почек. В одной из первых публикаций Desai et al. [22] продемонстрировали 89% успешных случаев полного освобождения почек от конкрементов у 10 пациентов со средним размером камней 14,3 мм. В более крупных исследованиях эффективность микр-ПНЛ была не ниже 82%. Наибольшая эффективность отражена в работах Armagan [18] – 93% (n=30), Karatag [23] – 95,7% (n=70), Sabnis [24] – 97,1% (n=35). В нашем исследовании общая эффективность составила 89,1%, у пациентов с размером камня меньше 1,5 см – 93,4%. Полученные результаты коррелируют с данными мировой литературы. При этом в подавляющем большинстве исследований средний размер конкрементов не превышал 1,5 см.
Самым грозным осложнением ПНЛ является кровотечение, которое может возникать как интраоперационно, так и отсроченно. На частоту развития кровотечения влияют количество пункционных доступов, особенности дилатации пункционного хода, а также собственно его размер [25]. При микро-ПНЛ осуществляют одношаговое бужирование пункционного хода, а максимальный диаметр доступа составляет 8 F, в связи с чем кровотечение возникает крайне редко. Чаще может возникать интраоперационная гематурия, приводящая к ухудшению эндоскопической видимости. Причиной гематурии служит активное манипулирование инструментом в полостной системе почки при попытке найти камень. Прямой доступ «на камень», особенно при его чашечковой локализации, является профилактикой возникновения гематурии. В большинстве исследований кровотечений зафиксировано не было. Hatipoglu et al. [26] указали на один случай кровотечения, потребовавший переливания компонентов крови. Согласно данным [24], легкая гематурия имела место у 5 больных, перенесших микро-ПНЛ. В нашей работе у двух пациентов встречена интраоперационная гематурия, не приведшая к серьезным последствиям.
Самым частым послеоперационным осложнением микро-ПНЛ является формирование «каменных дорожек» в процессе миграции фрагментов конкрементов в мочеточник, что может стать причиной почечной колики и обострения пиелонефрита. Подобные ситуации часто требуют выполнения дополнительных процедур, таких как стентирование почки, нефростомия, уретерореноскопия или ДЛТ. Для профилактики возникновения обструктивных осложнений Hatipoglu et al. [26] рекомендовали обязательную установку внутреннего стента по окончании операции пациентам с крупными (более 2 см) камнями почек, а также при риске миграции фрагментов. В нашем исследовании всего двум пациентам потребовалось послеоперационное стентирование и семи – послеоперационная ДЛТ. Использование для дезинтеграции конкрементов лазеров, в особенности волоконного тулиевого лазера, комбинация режимов фрагментации и «дастинга», предоперационная установка мочеточникового кожуха вместе с использованием 8 F рабочего тубуса для нефроскопии позволяют значительно снизить риск оставления крупных фрагментов в почке и как следствие – их миграции в мочеточник.
Как по результатам нашего исследования, так и по данным литературы, микро-ПНЛ не сопровождается большим числом неприятных последствий и осложнений. Общая частота осложнений в различных работах не превышает 13–14% [18, 26]. В нашем исследовании общее количество неопасных осложнений составило 10,8%. Описаны случаи конверсии микро-ПНЛ в мини-ПНЛ в связи возникновением интраоперационной гематурии либо невозможности визуализации конкремента [18, 22, 27, 28]. В нашей работе конверсия в мини-ПНЛ выполнена лишь в 1 случае из-за поломки оптической системы.
Заключение. Исследование показало высокую эффективность лазерной микро-ПНЛ в лечении камней почек различного размера при малой частоте осложнений. Тщательное планирование пункционного доступа с возможностью его формирования непосредственно на камень значительно упрощает дальнейший этап дробления камня. Предварительная установка мочеточникового кожуха размером 10–12 F способствует пассивной литоэвакуации фрагментов в процессе литотрипсии. Использование рабочего тубуса размером 8 F оправданно при лечении камней размером более 1,5 см. Воздействие на камень при помощи тулиевого волоконного лазера FiberLase U2 позволило максимально быстро и эффективно разрушать камни в условиях хорошей эндоскопической видимости в отсутствие ретропульсии фрагментов, гематурии и повреждения слизистой лазерными импульсами. Метод микро-ПНЛ является практически «бескровным» и может выполняться пациентам с тяжелыми соматическими заболеваниями, в том числе и пациентам с гипокоагуляцией. В то же время особенности микро-ПНЛ, такие как невозможность ультразвуковой литолапаксии, ограниченность литоэкстракции, наличие форсированной ирригации, требуют дальнейших исследований. В перспективе – изучение вопроса о расширении показаний к микро-ПНЛ, возможности его применения при множественных и крупных камнях почек.



