Актуальность. Проблема развития устойчивости к антибактериальным препаратам на сегодняшний день актуальна для любой медицинской организации [1]. Зачастую антибиотикорезистентность обусловливает неадекватный старт антибактериальной терапии, приводит к снижению клинического эффекта назначаемого препарата и пятикратному повышению летальности [2, 3].
В стационарах Российской Федерации тяжелый сепсис с полиорганной недостаточностью (43,8%) и септический шок (12,5%) при нозокомиальной инфекции наблюдаются достоверно чаще по сравнению с внебольничными (соответственно 16,3 и 2,9%) случаями. Актуальные возбудители нозокомиальных инфекций у взрослых характеризуются множественной устойчивостью к антибиотикам. Среди них доля штаммов Klebsiella pneumoniae, Proteus mirabilis и Escherichia coli, не чувствительных к цефалоспоринам III–IV поколений, составляет соответственно 95,1, 78,6 и 60,5% [3].
Особенно важно рационально подходить к выбору стартовой эмпирической антибактериальной терапии в крупных стационарах с высокой операционной активностью, где ежедневно проходит большой поток пациентов, в том числе тяжелых [3, 4]. В связи с этим мониторинг микробного биоценоза в конкретных специализированных отделениях на сегодняшний день становится приоритетной задачей, решение которой в режиме реального времени обеспечивает оптимизацию персонализированной стартовой антибиотикотерапии [5].
Цель исследования: изучить особенности микробиоты у пациентов урологических отделений многопрофильного клинического центра федерального уровня, оптимизировать схемы стартовой антибиотикотерапии.
Материалы и методы. Проанализированы данные микробиологических исследований различных биосубстратов у пациентов урологических отделений больницы, оказывающей высокотехнологичную медицинскую помощь, а также медицинскую помощь в рамках обязательного медицинского страхования, за 2017 г. Клиническая больница № 1 ПОМЦ ФМБА России, где проводилось исследование, – это стационар на 200 коек, оказывающий плановую высокотехнологичную медицинскую помощь, прежде всего пациентам с онкологическими заболеваниями, требующими хирургического лечения. В составе стационара имеется два урологических отделения, в которых с января по декабрь 2017 г. были пролечены 2003 пациента с диагнозом мочекаменной болезни (19,7%), рака мочевого пузыря (15,1%), рака почки (12,5%), гиперплазии предстательной железы (11,9%), гидронефроза (9,7%), рака простаты (9,3%) и пр. За проанализированный период выполнено 1905 оперативных вмешательств, хирургическая активность составила 95,1%.
Дизайн исследования предусматривал идентификацию возбудителей; обработку результатов исследований чувствительности микроорганизмов к антимикробным препаратам с использованием программы WHONET 5.4; применение ПЦР-диагностики; разработку алгоритмов эмпирической антибиотикотерапии с учетом полученных данных.
Для микробиологического исследования были использованы различные биосубстраты: кровь, моча, дренажное и раневое отделяемое, содержимое брюшной и плевральной полостей, мокрота, материал бронхоальвеолярного лаважа, отделяемое полости рта и носа. Посевы жидкости из брюшной полости для микробиологического анализа получали в конце основного этапа операции перед ушиванием раны передней брюшной стенки. Для забора материала использовали герметичный стерильный набор из пластикового зонда с ватным тампоном на конце, который в последующем помещали в пробирку с готовой к применению средой Amies с углем.
Идентификацию возбудителей проводили общепринятыми микробиологическими методиками. Для определения чувствительности использовали диско-диффузионный метод на среде Мюллера–Хинтона с использованием дисков BioRad. MRSA определяли в скрининговом тесте с цефокситином, выявление продукции бета-лактамаз расширенного спектра (БЛРС) проводили фенотипическими методами.
Проведена параллель с результатами исследования методом ПЦР. Осуществляли амплификацию следующих патогенов: E. coli, Enterobacter spp., Klebsiella spp., Proteus spp., Serratia spp., Enterococcus faecalis, Enterococcus faecium, Staphylococcus aureus и Streptococcus spp. Для ПЦР использовали прибор «CFX 96» BioRad в режиме реального времени с наборами «Септоскрин» (ООО НПФ «Литех», Москва). Выделение ДНК из биопроб осуществляли комплектом ДНК-ЭКСПРЕСС-неокрашенный (ООО НПФ «Литех», Москва).
В работе применяли методы статистики с оценкой значимости различий показателей по t-критерию Стьюдента и расчетом погрешностей при помощи программы Microsoft Excel.
Результаты. Всего за 2017 г. по клинической больнице № 1 было выделено 672 штамма этиологически значимых микроорганизмов. В 51% случаев результат микробиологического исследования оказался отрицательным.
В целом моча была наиболее часто исследуемым биоматериалом – в 37%. В 27% случаев на микробиологическое исследование было отправлено дренажное отделяемое, в 24% – отделяемое зева и носа, в 15% – мокрота и бронхоальвеолярный лаваж, в 11% – кровь.
В урологической клинике из различных биологических субстратов выделено 173 этиологически значимых возбудителя, что составило 25,7% от общего количества выявленных возбудителей. В общей структуре преобладали грамотрицательные бактерии – 59,23%. Грамположительные бактерии выделены в 24,4%, грибы – в 16,37% случаев.
В урологических отделениях доля грамположительных возбудителей оказалась несколько выше – 34,3%, доля грамотрицательных бактерий составила 59,89%, значительно реже выделялись грибы – в 5,81% случаев (табл. 1).
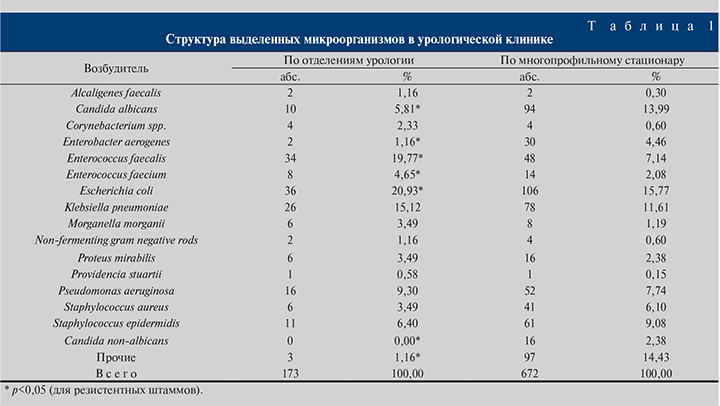
В отделении реанимации и интенсивной терапии доля грамотрицательных микроорганизмов составила 67% (из них Acinetobacter spp. 17%), грибов – 19,1% (из них C. non-albicans до 6,2%); такие пациенты наиболее проблемные для терапии.
Acinetobater spp., C. non-albicans в урологических отделениях выявлены не были. В 77% случаев исследуемым биосубстратом послужила моча, в 9% – послеоперационная рана, в 8% – дренажное отделяемое, в 4% – мокрота и отделяемое бронхоальвеолярного лаважа, в 1% – кровь, в 1% – отделяемое зева и носа.
Из всех проб мочи чаще всего анализу подвергалась свободно выпущенная моча (в 50,4% случаев в урологических отделениях и в 73% – по стационару в целом), исследование стомированной мочи проводилось в 18% случаев (13% по стационару), катетеризированной мочи – в 31,6% (13% по стационару).
Основными патогенами, выделенными из свободно выпущенной мочи, были E. coli (22%), K. pneumoniae (18%), P. aeruginosa (12%), E. faecalis (16%), E. aerogenes (6%), C. albicans (4%), S. aureus (3%).
Структура микробных патогенов, выделенных из стомированной и катетеризированной мочи, существенно не различалась. Преобладали K. pneumonia (22,8%), E. coli (21,2%), C. albicans (17%), P. aeruginosa (11%), E. aerogenes (6%), S. aureus (3%).
В резистентности ведущих возбудителей инфекций мочевыводящих путей катетеризированной/стомированной и свободно выпущенной мочи различия были обнаружены (табл. 2–4). Так, K. pneumoniae, выделенная из катетеризированной/стомированной мочи, продуцировала БЛРС в 75% случаев. Все культуры, выделенные в урологических отделениях, были чувствительными к амикацину и карбапенемам (см. табл. 2).
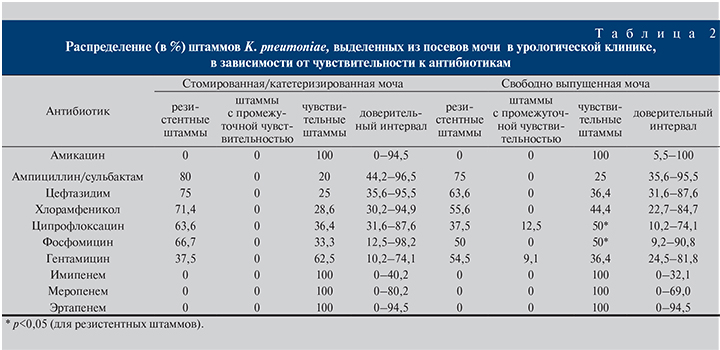
В целом по центру резистентными к амикацину оказались 20% выделенных штаммов, к имипенему – 5,4%. В то же время K. pneumoniae, выделенная из свободно выпущенной мочи, оказалась продуцентом БЛРС только в 56,7% случаев (р<0,05).
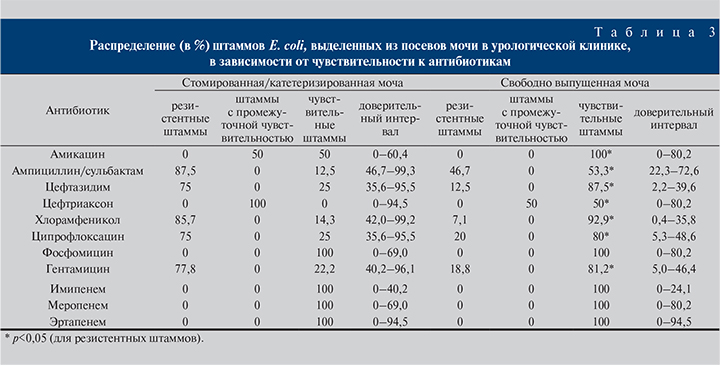
E. coli, выделенная из катетеризированной/стомированной мочи, продуцировала БЛРС в 46,7% случаев. Половина штаммов оказалась чувствительной к амикацину. E. coli, выделенная из свободно выпущенной мочи, продуцировала БЛРС в 24,8% случаев. Все культуры были чувствительными к амикацину и карбапенемам (см. табл. 3).
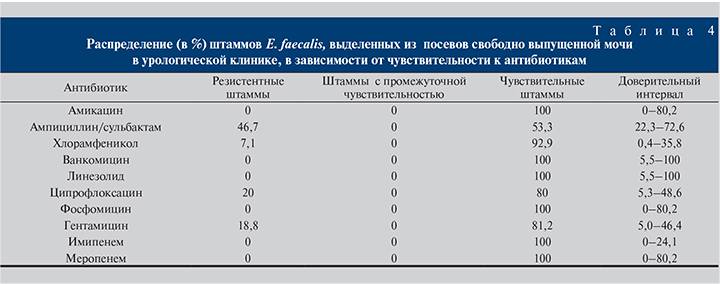
E. faecalis почти всегда выделялся из свободно выпущенной мочи (см. табл. 4). Для лечения инфекций, вызванных этим возбудителем, актуальными остаются аминогликозиды, фторхинолоны, фосфомицин, при необходимости – карбапенемы.
Из стомированной мочи был выделен единичный штамм E. faecalis, оказавшийся устойчивым к ампициллину, аминогликозидам, ципрофлоксацину, но сохранявший чувствительность к карбапенемам.
При изучении профилей резистентности в целом по стационару выяснилось, что среди штаммов K. pneumoniae только четверть не проблемна для назначения терапии. Резистентными к 6 антибактериальным препаратам оказались 5% изолятов, 22% – к 5. Штаммы проявляли устойчивость к защищенным пенициллинам, аминогликозидам, к цефалоспоринам, фторхинолонам, хлорамфениколу, карбапенемам (имипенему), имел место один профиль резистентности.
Источником таких панрезистентных штаммов во всех случаях служило отделение реанимации. Устойчивыми к 4 антибактериальным препаратам оказались 23% выделенных штаммов (при этом имелось 2 различных профиля резистентности), 9% – к 3, 6% – к двум антибиотикам. В 29,7% случаев проблемные штаммы были выделены в отделении реанимации, в 24,3% – в отделениях урологии.
Биосубстратами в отделении реанимации были кровь, бронхоальвеолярный лаваж, мокрота, рана, моча, в то время как в урологических отделениях в подавляющем большинстве проблемные возбудители выделялись из мочи.
При анализе профилей резистентности E. coli выяснилось, что к 5 антибиотикам устойчивы 17% выделенных штаммов (с одним профилем резистентности; возбудители были устойчивыми к защищенным пенициллинам, аминогликозидам, цефалоспоринам, фторхинолонам, хлорамфениколу), к 4 – 12% (выявлено три профиля резистентности), к 3 – 14%, к 2 – 10% выделенных штаммов. Половина полирезистентных штаммов выделялась в отделении реанимации, примерно по 25% – в урологических и хирургических отделениях соответственно. К карбапенемам были чувствительными все штаммы.
E. faecalis оказался не столь проблемным для терапии. Лишь около 10% штаммов проявили устойчивость к двум антибактериальным препаратам (гентамицину и ципрофлоксацину); 36% штаммов оказались устойчивыми к одному антибактериальному препарату.
Методика ПЦР-диагностики начала применяться в стационаре с IV квартала 2017 г., причем параллельно с данным анализом проводилось и микробиологическое исследование. Методом ПЦР выявлено 37 возбудителей инфекций, выделенные микроорганизмы были такими же, как при микробиологическом исследовании, однако в 25% случаев отмечено выделение следовых количеств стрептококков, что свидетельствует в пользу большей чувствительности метода.
Таким образом, в урологических отделениях, как и в целом по многопрофильному стационару, преобладает грамотрицательная микрофлора. Однако в урологических отделениях грамположительные микроорганизмы выделялись чаще, а грибы реже.
При выделении K. pneumoniae в большей части случаев можно думать о неблагоприятном профиле устойчивости независимо от биосубстрата. Достоверных различий в профиле устойчивости при анализе штаммов, выделенных из свободно выпущенной и катетеризированной/стомированной мочи, не получено. Однако отмечена тенденция к большей чувствительности к гентамицину у штаммов, выделенных из катетеризированной/стомированной мочи, что, вероятно, объясняется большей частотой применения данного препарата на догоспитальном этапе у более тяжелой категории пациентов.
В то же время E. coli, выделенная из катетеризированной/стомированной мочи, также имела неблагоприятный профиль устойчивости. Пациенты без стом/катетеров оказались менее проблемными для эффективной стартовой антибактериальной терапии.
Пребывание в отделении реанимации связано с риском обсеменения полирезистентными штаммами и неудачей эмпирической терапии даже после перевода из реанимационного отделения.
В нашей урологической клинике включение в схему стартовой антибиотикотерапии цефалоспоринов для лечения инфекций мочевыводящих путей нельзя считать оправданным. Более актуальным с учетом данных локального микробиологического мониторинга оказалось применение аминогликозидов, фторхинолонов, в ряде случаев неизбежной стала терапия карбапенемами.
С учетом значительной экономии времени при применении методики ПЦР можно рекомендовать ее одновременное использование параллельно с микробиологическим исследованием. Так как ПЦР-диагностика позволяет получать результат в течение рабочего дня, это дает возможность назначать пациенту стартовую эмпирическую терапию уже в первые сутки заболевания. Стандартное время получения результата микробиологического исследования – около 3–4 сут., из крови – до 10. Безусловно, данная временная экономия может оказаться критичной для клинического исхода и профилактики гнойно-инфекционных осложнений раннего послеоперационного периода.
Стартовая терапия цефалоспоринами имеет высокий риск неудачи, поскольку к данной группе препаратов наиболее часто выделяемые штаммы демонстрируют высокий уровень устойчивости. При выделении K. pneumoniae можно рекомендовать в качестве стартовой терапии аминогликозиды, фосфомицин (при неосложненных инфекциях или в комбинациях), применение фторхинолонов и защищенных пенициллинов возможно только после получения положительных результатов микробиологического исследования. В тяжелых случаях (уросепсис) оправданна стартовая терапия карбапенемами. Предпочтительно назначать лечение эртапенемом как препаратом, не имеющим антисинегнойной активности. Однако, если пациент переведен из отделения реанимации, нельзя гарантировать успех карбапенемов во всех случаях. При выделении панрезистентных штаммов, продуцирующих карбапенемазы, необходима смена терапии на тигециклин и цефтазидим/авибактам (при наличии метало-бета-лактамаз в комбинации с азтреонамом). С учетом фармакокинетики тигециклина первый вариант становится менее оправданным. Возможны комбинации с фосфомицином, полимиксином, однако последний имеет ограничение в применении в урологической клинике в связи с его нефротоксическим действием.
При выделении E. coli схема стартовой антибиотикотерапии зависела от источника: если штамм получен из катетеризированной/стомированной мочи, то клинического успеха достигали при применении амикацина, ципрофлоксацина, фосфомицина (в комбинациях); в случае выделения из свободно выпущенной мочи – амикацина и гентамицина, ципрофлоксацина, фосфомицина. Во всех случаях актуальными остаются карбапенемы. При выделении E. coli в отношении пациентов, не имеющих стом/катетеров, возможно также применение гентамицина, фторхинолонов, даже цефалоспоринов III поколения. Однако использование последних возможно лишь в высоких терапевтических дозах, поскольку половина штаммов E. coli обладает промежуточной чувствительностью (см. табл. 3).
Поскольку E. faecalis в половине случаев оказался не чувствительным к ампициллину, нельзя рекомендовать его в качестве стартовой терапии. Смена препарата на ампициллин возможна после получения результатов бактериологического исследования. При выделении E. faecalis пациентам, не имеющим стом/катетеров, целесообразно терапию начинать с фторхинолонов, аминогликозидов, возможно, ванкомицина, линезолида. Карбапенемы также не оптимальны в данном случае.
Обсуждение. Проблема своевременной диагностики и трудности лечения инфекции урогенитального тракта в связи с повышением оперативной активности в урологии, в том числе с активным использованием стентов, катетеров, дренажей, сфинктеров, протезов, спиралей, с формированием антибиотикорезистенных штаммов и биопленочной инфекции, освещены в клинических рекомендациях [4, 6].
В настоящее время государственную политику в сфере предупреждения и ограничения распространения устойчивости микроорганизмов к противомикробным препаратам, а также к химическим и биологическим средствам в стране определяет утвержденная на правительственном уровне Стратегия предупреждения распространения антимикробной резистентности в Российской Федерации на период до 2030 г. [7]. Аналогично международным стандартам с 2013 г. в различных регионах России создана и функционирует Национальная ассоциация специалистов по контролю инфекций, связанных с оказанием медицинской помощи (НП НАСКИ) [8, 9].
Антибиотикорезистентность – не только общенациональная, но и общемировая проблема. Выделяют несколько уровней устойчивости – глобальный, региональный и локальный (стационар или отделение) [3]. Особенно актуальным становится знание локального уровня резистентности (в стационаре и отделении) в динамике, что позволяет спрогнозировать успех или неудачу стартовой антибиотикотерапии и оптимизировать схемы лечения на том этапе, когда нет данных антибиотикограммы [5].
В настоящее время имеется достаточное количество работ, посвященных анализу микробного пейзажа отделений и стационаров, поскольку инфекционные осложнения, вызванные полирезистентной флорой, ухудшают результаты оперативных вмешательств [10–13].
Именно своевременная и адекватная антибиотикотерапия является жизнесохраняющей, особенно для тяжелых пациентов [14]. Общепринятые схемы антибактериальной терапии освещены в рекомендациях [4]. Однако все больше говорится о необходимости персонализированного подхода, позволяющего оптимизировать общепринятые схемы в рамках конкретной лечебно-профилактической организации, а также специализированного отделения [5].
В настоящее время ПЦР-диагностика широко используется на амбулаторно-поликлиническом этапе, однако использование ее в госпитальном секторе открывает новые возможности для оптимизации антибактериальной терапии. Внедрение инновационных технологий тестирования возбудителя значительно сокращает время анализа, что позволяет клиницистам принимать своевременные и обоснованные решения [15].
Заключение. Как показали результаты микробиологического мониторинга, в урологической клинике преобладает грамотрицательная флора с достаточно высоким уровнем БЛРС-продуцентов. К факторам риска появления полирезистентной флоры относятся пребывание в отделении реанимации, наличие стом/катетеров. Метод ПЦР, проводимый параллельно с рутинным микробиологическим исследованием и регулярным анализом общего микробного пейзажа, позволяет оптимизировать стартовую антибиотикотерапию уже с первых суток заболевания или сразу после оперативного вмешательства. Применение цефалоспоринов не оправданно в большинстве случаев. Актуальными остаются аминогликозиды, фторхинолоны. Применение защищенных пенициллинов, фосфомицина возможно только после получения результатов микробиологического исследования. При назначении карбапенемов риск неудачи особенно высок для пациентов, имеющих стомы/катетеры и переведенных из реанимационного отделения.



