Любая из сфер жизнедеятельности человека в современном мире невозможна без использования современных достижений науки и техники. Для применения передовых технологий требуются отличные знания множества фундаментальных наук, но зачастую это не представляется возможным для одного человека. В связи с этим работа современного специалиста в любой из отраслей жизни человека не обходится без тесного взаимодействия и кооперации между людьми различных специальностей для достижения положительных результатов своего труда. Так, на сегодняшний день большинство специальностей в медицине не может обходиться без высокотехнологичных методов диагностики, в значительной степени способствующих выявлению многих заболеваний на ранних стадиях в организме человека. В разное время врачи для получения информации об анатомической структуре всего организма человека и отдельных органов и систем в частности, применяли различные визуализирующие технологии. Развитие визуализирующих методов исследования соответствовало характеру технологической научной мысли каждого временного отрезка в мире.
Впервые возможность получения изображений человеческого тела стала реальной после открытия, которое в 1895 г. совершил немецкий физик нобелевский лауреат Вильгельм Конрад Рентген, описавший «Х-лучи» в научной статье, где в качестве иллюстрации прикрепил рентгенограмму кисти жены с обручальным кольцом.
В дальнейшем на протяжении многих лет с целью визуализации в урологии основными методами диагностики были рентгенологические.
Следующим важным этапом в развитии методов визуализации в медицине стало изобретение компьютерной томографии в 1972 г., за которое английский инженер-физик Годфри Хаунсфилд и американский физик Аллан Кормак были удостоены Нобелевской премии.
В широкой медицинской практике методика компьютерной томографии стала применяться с 1992 г., когда на мировом рынке медицинских приборов были выпущены первые мультиспиральные компьютерные томографы «Elscint CT Twin» фирмы «Elscint Со». Дальнейшим большим прорывом в улучшении интерпретации существующих методов лучевой диагностики в последние десятилетия XX в. и начала нового XXI столетия стало применение компьютерных технологий для обработки получаемых данных визуализации. Современные компьютерные томографы за счет использования нескольких рядов детекторов позволяют за более короткое время получить изображение тела человека и объемный виртуальный образ патологического процесса (3D-модели, от англ. 3 Dimensions – три измерения) за счет программ трехмерной компьютерной графики. Не каждый человек сможет мысленно представить и воспроизвести объемную 3D-модель предмета из полученных его изображений в 2D-формате. Но, если этот человек – врач, присутствие такого качества воображения в разы важнее для сферы его деятельности, если этот врач еще и хирург, отсутствие такого свойства ума не позволит ему получить положительный результат планируемого оперативного вмешательства. Современные компьютерные технологии смогут решить эту проблему с легкостью.
Для выполнения 3D-моделирования и реконструкции в медицинских целях используется более 70 компьютерных программ. Основным протоколом для передачи цифровой информации, полученной при визуализации, в медицине служит формат «Dicom» (the digital imaging and communications in medicine). Протокол был разработан и стал использоваться в здравоохранении с 1993 г. [1]. Формат «Dicom» применяется для захвата, обмена и архивирования данных изображений в системах хранения данных и системах связи между пользователями.
Часть программного обеспечения находится в свободном доступе в Интернете и не требует приобретения лицензии для использования. Самыми известными доступными 3D-редакторами являются программы «OsiriX», «MicroView», «MIPAV» и др. [2]. Самое большое применение 3D-моделирования патологического процесса из отраслей медицины принадлежит ортопедии, стоматологии, пластической хирургии. В этих медицинских сферах моделируемые области в большей степени статичны, не подвержены большим смещениям в ходе визуализации за счет работы дыхательной и сердечно-сосудистой систем. И на стадии становления визуализирующих методов обследования мультиспиральной компьютерной (МСКТ) и магнито-резонансной томографии (МРТ) не было больших сложностей в преобразовании получаемых данных в формате 3D. По мере совершенствования компьютерного моделирования и получения положительных результатов от его использования методику компьютерного моделирования стали применять и врачи других специальностей.
Применительно к урологии первый опыт использования в мире 3D-моделирования в лечении больных относится к началу 2000-х гг. Первым мировым сообщением является работа Coll et al. (2000), которые привели данные об использовании 3D-моделирования в отношении 60 больных с опухолью почки в предоперационном периоде при планировании ее резекции. Построение 3D-моделей было произведено после выполненной МСКТ на стандартном программном обеспечении томографа (Silicon Graphics) [3]. В большинстве своем первые работы о 3D-моделировании в урологии связаны с использованием метода в хирургическом лечении больных с образованиями почки [4–6]. Основные моменты применения 3D-построений МСКТ были связаны с изучением сосудистой анатомии почки, характеристиками самой опухоли, ее взаимоотношениями с элементами чашечно-лоханочной системы почки, а при наличии местнораспространенного опухолевого процесса – возможностями оценки инвазии опухоли в нижнюю полую вену [7, 8]. В России самой первой работой по использованию виртуальных технологий в хирургии считается исследование, проведенное в Институте хирургии им. А. В. Вишневского в 2003 г. – среди 349 пациентов с различными заболеваниями органов брюшной полости 16 из них операции выполнены по поводу образований почки [9]. В настоящее время в России самым большим многолетним опытом применения трехмерной виртуальной обработки данных МСКТ с контрастированием при операциях на почке обладает коллектив клиники урологии Сеченовского Университета [10–12]. Родоначальником данного направления в работе клиники является член-корреспондент РАН профессор Ю. Г. Аляев. Результатом работы коллектива клиники стала масса научных трудов, в том числе диссертаций на соискание ученой степени доктора медицинских наук таких сотрудников клиники, как Д. Н. Фиев (2015), Е. В. Шпоть (2017) и Е. С. Сирота (2018). В работе клиники урологии традиционно применяется программа 3D-моделирования «Amira 5.4» (лицензионное соглашение № 257813956).
Возможности графического редактора «Amira 5.4» позволяют создавать объемную графическую модель почки с окрашиванием анатомических элементов почки в цвета, принятые для обозначения этих структур в печатных анатомических атласах (рис. 1).

При анализе литературных данных имеются различные подходы к выполнению графической обработки полученных данных исследования для создания 3D-моделей. Так, в работе Laser et al. (2012) на этапе компьютерной обработки, выполненной МСКТ, привлекались сторонние коммерческие компании по медицинскому компьютерному моделированию [13]. Напротив, в ряде других работ на данном этапе работает команда из двух участников: врача-уролога и врача лучевой диагностики [14–16].
В нашей клинике в работе по созданию 3D-модели патологического процесса задействована команда из трех основных специалистов: врача-уролога, врача лучевой диагностики, специалиста по программному обеспеченью (рис. 2).
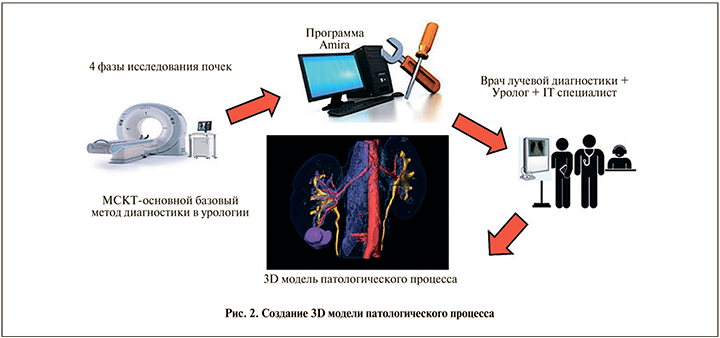
Кооперация этих трех участников позволяет получать полноценный виртуальный образ патологического процесса больного хирургическим заболеванием почек. Установление качественной и оптимальной коммуникации между всеми членами команды гарантирует благоприятный исход лечения заболевания, а хорошее общение – это совместная ответственность за результат лечения. Главенствующая роль в работе команды принадлежит врачу-урологу. За каждым членом команды закреплены определенные функциональные обязанности по выполнению построения 3D-модели. Первично после знакомства с пациентом и выполнения основных требуемых методов обследования врач-уролог получает информацию о характере заболевания пациента. Следующим шагом уролога служит уточнение полученных данных при помощи МСКТ или МРТ-диагностики с постановкой задач перед врачом лучевой диагностики в зависимости от полученных первичных данных о характере заболевания больного. В ходе выполнения МСКТ при необходимости врач-уролог может присутствовать на процедуре или врач лучевой диагностики, выполняющий исследование, при выявлении элементов нормальной и патологической анатомии, которые имеют большое отклонение от данных, полученных при первичном обследовании больного в заинтересованной области исследования, согласовывает тактику протокола дальнейшего МСКТ посредством различных видов связи с врачом-урологом. В большинстве своем такое взаимодействие позволяет получать полную информацию о заболевании пациента. Затем к работе подключается программист, который производит графическое построение 3D-моделей патологического процесса также при тесном сотрудничестве с врачом-урологом. Построение 3D-модели производится согласно предварительному плану проведения оперативного вмешательства. Для координации работы айти-специалиста врач-уролог делает акценты на основных моментах, которые потребуются в дальнейшем при планировании и навигации оперативного пособия.
В современной плановой хирургии предоперационному обследованию больного придается большое значение. Перед началом операции у хирурга не должно оставаться пробелов в понимании топографо-анатомических особенностей области планируемого пособия, патологической хирургической анатомии органа, подвергаемого вмешательству, с прогнозированием всех возможных технических и анатомических сложностей операции и вариантов их решения. По своей сути проведение операции сегодня можно сравнить с работой пилота в кабине современного авиалайнера, где тот контролирует работу всей системы самолета с заложенной информацией о взлете, маршруте следования и посадке. Так и у современного хирурга операция начинается с хирургического доступа, хирургических приемов выполняемого пособия по заранее намеченному плану и этапа завершения вмешательства. Поэтому детальное изучение трехмерной анатомии помогает не только предвидеть технические сложности, которые могут возникать при выполнении операции, но и многократно многовариантно выполнять ее виртуально, тем самым определяя наиболее оптимальный доступ к интересуемой области, оптимальный вид, а также перечень и последовательность хирургических манипуляций.
Несмотря на видимые преимущества 3D-визуализации патологического процесса на экране монитора компьютера, хирургу по-прежнему необходимо уметь интерпретировать визуальную информацию, чтобы предусмотреть 3D-геометрию для выполнения качественного оперативного вмешательства. В настоящее время для этого появилось новое направление медицины – 3D-печать, в основе которой лежит воссоздание на основании проведенных визуализирующих методов диагностики 3D-объемных моделей органов и систем организма человека. Исторически первым врачом в мире, предложившим в 1979 г. идею создания осязаемой анатомической модели органов на основании выполняемой компьютерной томографии, был итальянский доктор Alberti [17].
3D-печать в настоящее время используется в различных сферах жизнедеятельности человека: от создания домов до печати живых органов и тканей. При этом материалы, используемые для работы 3D-принтеров, также различны: от бумаги и пластмасс до керамических и металлических порошков и живых клеток. Современные технологии в данное время позволяют проводить 3D-печать одновременно несколькими материалами, что позволяет создавать сложные функциональные механические и живые 3D-объекты, например встроенные электронные датчики или полноценные органы и ткани живых организмов [18, 19].
При анализе мировых публикаций появляется все больше сообщений об использовании 3D-печати в урологии [20–29]. При этом не только 3D-печать органов мочевыделительной системы, но и исследования по 3D-печати расходных материалов для выполнения оперативных вмешательств (катетер-стенты, клипсы, троакары) [30–32]. Конечно же, это пока будущее хирургии, но использование 3D-печати позволило бы создавать персонифицированные инструменты и расходные материалы во время выполнения операций в самом операционном блоке при возникновении потребности в них [32].
Исследования по использованию 3D-печати в лечении больных образованиями почки в Клинике урологии Сеченовского Университета проводятся с 2010 г. Первично при помощи 3D-печати в клинике была разработана методика интраоперационной навигации при интрапаренхиматозной локализации опухоли почки для выполнения резекций почки из открытого хирургического доступа за счет применения навигационных шаблонов. Данные шаблоны изготавливались на основании данных 3D-моделирования пациентов при помощи стереолитографии [11, 33]. По данной методике был получен патент на изобретение «Способ оперативного лечения больных опухолью почки» № 2492816. В дальнейшем в клинике при помощи стереолитографии были изготовлены прозрачные 3D-печатные модели почек с опухолью, которые использовались для планирования операций пациентов с образованиями почки и для обучающих программ. Эти 3D-модели были выполнены из прозрачного материала, при этом все элементы внутренней нормальной и патологической анатомии почки были окрашены в различные цвета. Это позволяло хирургу на этапе планирования и осуществления операции оценить глубину расположения опухоли в паренхиме почки и соотношение опухоли с анатомическими структурами почки. Тем самым имелась возможность прогнозирования вероятности повреждения ЧЛС почки и планирования вариантов осуществления временного гемостаза при выполнении резекции. Кроме того, были напечатаны 3D-модели с вариантами выполнения резекции почки, что позволяло оценить раневую поверхность паренхимы почки после резекции. Одним из недостатков этих 3D-печатных моделей почки является невозможность их использования для проведения предоперационного тренинга за счет плотности материала, применяемого для 3D-печати методом стереолитографии. В связи с этим в клинике при совместном участие с IT-специалистами была разработана и используется для работы технология принтинга 3D-мягких моделей почки с патологическими образованиями.
При создании данных моделей почки были применены различные материалы для качественного визуального отличия внутренних структур почки. Помимо различных материалов каждая внутренняя структура имела определенную идентифицирующую окраску. Паренхима модели была произведена из полупрозрачного, эластичного, схожего по мягкости с нативной почкой термопластичного материала. Аналогичный материал использовался и для изготовления опухоли, однако для лучшей визуализации был использован темно-коричневый краситель. Чашечно-лоханочные системы (ЧЛС) и сосуды изготовлены из более жесткого PLA-пластика. Цветовой индикатор ЧЛС – желтый; сосудов (артерии и вены) – красный и синий соответственно (рис. 3).

Физические свойства материалов, использованных нами для 3D-печати моделей почек, были высоко оценены хирургами, которые осуществляли лапароскопический тренинг. По их мнению, такие параметры, как эластичность и плотность, практически не отличались от интраоперационных ощущений при проведении реальной операции. Имитация приближенной к реальной почечной ткани позволяет врачу приобретать необходимые тактильные навыки во время проводимого тренинга вне операционной на 3D-мягких печатных моделях с опухолью. Другим преимуществом изготовленных нами 3D-мягких печатных моделей, по нашему мнению, является возможность их многоразового использования для отработки навыков высокотехнологичных методов оперативного вмешательства.
Для решения проблемы освоения высокотехнологичных методик хирургического лечения пациентов с мочекаменной болезнью (МКБ) в Клинике урологии Сеченовского Университета создана небиологическая 3D-печатная модель почки для тренинга чрескожной нефролитотрипсии (ЧНЛТ). Основной задачей данной полезной модели служит ее использование с целью тренинга всех основных этапов операции в объеме ЧНЛТ под рентгенологическим и ультразвуковым контролем. Для полной имитации выполняемого тренинга ЧНЛТ модель состоит из двух основных частей. Первая из которых – воспроизведенная анатомически 3D-мягкая печатная модель почки человека с созданной реалистичной сосудистой и полой собирательной системой почки с возможностью имитации (размещения) конкрементов каждого больного в ЧЛС. Вторая часть – воспроизведенная при помощи методики 3D-печати модель фрагмента туловища человека с созданием костных ориентиров (позвоночным столбом от уровня 11Th позвонка до уровня L5-S1 позвонков, ребер с 8 по 12, гребнем подвздошной кости таза). В данной части модели должна быть сформирована полость с возможностью размещения 3D печатной мягкой модели почки в своем физиологическом положении и имитацией углов и уровня расположения, соответствующего естественным анатомическим расположениям. Фото небиологической 3D-мягкой печатной модели почки представлено на рис. 4.

По данной разработке было получено два патента: первый – на полезную модель «Небиологическая 3D-мягкая печатная модель почки» № 185706, второй – на изобретение «Симулятор для освоения навыков выполнения операций на почке» № 2691524.
Разработанная и изготовленная нами небиологическая 3D-мягкая печатная модель почки позволяет полностью воспроизводить индивидуальные особенности интерренальных структур конкретного пациента. При проведении тренинга возможно выполнение всех основных этапов ЧНЛТ как под ультразвуковым (УЗИ), так и под рентгенологическим контролем (пункция, расширение тракта, эндоскопический осмотр, литотрипсия). Количество выполненных вариантов перкутанного доступа под УЗИ-наведением не менее 5 раз. Также после проведения тренинга возможна оценки правильности выполнения и формирования доступа к ЧЛС почки.
По мере накопления опыта анализа трехмерной анатомии органов мочевыделительной системы пациента появилась идея использовать данные 3D-построений для оценки продвижения контрастированной крови, а затем и мочи по интраренальным структурам. Таким образом зародилась анатомо-функциональная концепция.
Данная концепция нашла свое применение в урологии по нескольким причинам. По мере освоения программного обеспечения для анализа 3D-анатомии почки происходило накопление данных о характере продвижения контрастного вещества (КВ) по внеи внутрипочечным структурам. Постепенно некоторые особенности оформлялись в закономерности. Совместные усилия урологов, специалистов лучевой диагностики, физика и IT-технолога привели к созданию «нулевой гипотезы», согласно которой, поскольку характер продвижения КВ, используемого в ходе МСКТ с контрастированием (и последующим 3D-моделированием), и радиофармакологический препарат при выполнении радиоизотопного исследования почек, который выделяется преимущественно путем фильтрации в почках, во многом схож, сравнение показателей двух данных методов могло бы иметь не только научный, но и практический интерес.
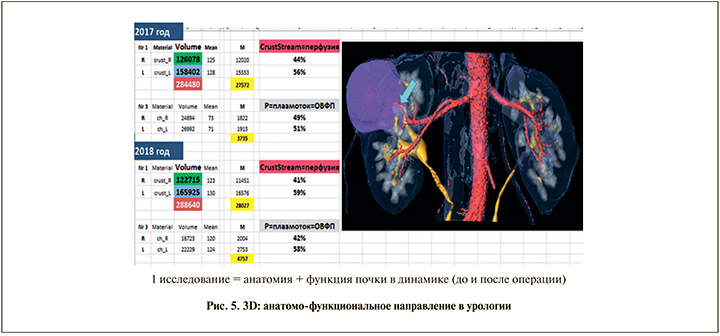
Результатом работы нескольких лет и усилий многих коллег стал алгоритм оценки продвижения контрастированной мочи по интраренальным анатомическим структурам с помощью программы «Amira» для трехмерной виртуальной обработки дынных МСКТ почек с контрастированием (патент на изобретение «Способ исследования функции почек при мультиспиральной компьютерной томографии» № 2673384). В данной работе было наглядно продемонстрировано, что в рамках одного исследования возможно получение достаточно исчерпывающей информации как об анатомии почки, так и о ее функции. А поскольку большинству пациентов урологического стационара так или иначе выполняется МСКТ с контрастированием, данное исследование может позволить снизить стоимость обследования благодаря отсутствию необходимости выполнять радиоизотопное исследование почек, а также снизить лучевую нагрузку по той же причине (рис. 5).
В заключение необходимо отметить перспективность и значимость дальнейшей разработки многих аспектов использования 3D-технологий в диагностике и лечении заболеваний почки. Причем для полноты применения данных технологий требуются глубокие знания ввиду междисциплинарного характера вопроса. Очевидно, что один специалист не в состоянии отвечать подобным требованиям, отчего для решения задач применения 3D-технологий требуются знания и скоординированные усилия одновременно нескольких специалистов: уролога, специалиста лучевой диагностики, физика и IT-специалиста.



