Введение. В настоящее время не достигнут консенсус относительно определения биохимического рецидива у пациентов, подвергшихся HIFU-аблации по поводу рака простаты (РП). За всю историю изучения метода успех HIFU-аблации определялся по самым разнообразным критериям [1]. Так, в ранних исследованиях полный ответ на лечение с помощью данной методики определен как отрицательный результат биопсии и уровень простатспецифического антигена (ПСА) <4 нг/мл [2, 3]. T. Uchida et al. показали, что у пациентов с надиром ПСА от 0 до 0,2 нг/мл частота клинического рецидива после HIFU-аблации была ниже, чем у пациентов с надиром ПСА >0,21 нг/мл [4]. В дальнейшем стали применять более жесткие критерии. A. Gelet et al. расценивали HIFU-аблацию как неудачную при положительном результате биопсии простаты или трех последовательных повышениях уровня ПСА со скоростью 0,75 нг/мл в год и выше [5]. На HIFU-аблацию простаты при локализованном раке стали экстраполировать критерии биохимического рецидива после дистанционной лучевой терапии, предложенные Американским обществом терапевтической радиологии и онкологии (ASTRO), в 2005 г. модифицированные как достижение уровня ПСА, превысившего надир на 2 нг/мл (критерий Phoenix) [6]. Несмотря на то что критерии ASTRO разработаны по результатам анализа выборки пациентов, подвергнутых лучевой терапии, с определенной долей успеха они применялись в отношении пациентов после HIFU-аблации. Первым специфичным определением биохимического рецидива, сформулированным на основе анализа выборки пациентов после HIFU-терапии РП, было определение Stuttgart, согласно которому достижение уровня ПСА, на 1,2 нг/мл превышающего надир, характеризуется максимальной положительной предиктивной ценностью в отношении развития клинического рецидива в будущем [7].
Цель: изучить выживаемость пациентов без биохимического рецидива по критериям Stuttgart и Phoenix в аспекте их корреляции с четырьмя различными значениями надира ПСА в качестве предикторов клинического рецидивирования у пациентов с локализованным раком простаты (РП), перенесших тотальную HIFU-аблацию простаты.
Материалы и методы. Проведено ретроспективное исследование, объектом которго стали пациенты с морфологически доказанным по результатам биопсии локализованным РП. С декабря 2008 по декабрь 2017 г. в НИИ фундаментальной и клинической уронефрологии СарГМУ им. В. И. Разумовского Минздрава РФ и в Институте урологии и репродуктивного здоровья человека ПМГМУ им. И. М. Сеченова. Пациентам проведено лечение РП методом HIFU-аблации на аппарате Ablatherm Integrated Imaging® (EDAP TMS, Франция).
Изучены и проанализированы данные 658 пациентов, удовлетворивших следующим критериям включения:
- срок наблюдения ≥3 лет;
- гистологически подтвержденный локализованный РП стадий T1–Т2;
- сумма баллов по шкале Глисона ≤7;
- исходный уровень ПСА ≤20 нг/мл;
- HIFU-аблация (1–2 сеанса) без неоадъювантной гормональной и лучевой терапии.
Практически всем пациентам, вошедшим в анализ, непосредственно перед сеансом HIFU-терапии выполнена трансуретральная резекция простаты (ТУРП) с целью профилактики развития инфравезикальной обструкции в послеоперационном периоде. ТУРП не выполняли пациентам, исходный объем простаты которых составил ≤20 см3. Объем простаты у всех больных определен накануне оперативного вмешательства. Пациентов стратифицировали в соответствии с категориями риска по D’Аmico [8]. После HIFU-аблации пациентов регулярно наблюдали с интервалом 3 мес. Биопсию резидуальной ткани простаты проводили через 6–12 мес. после HIFU или при признаках биохимического рецидива. Сальважное лечение назначалось в соответствии с клиническим суждением лечащего врача, который учитывал уровень ПСА и результаты гистологического исследования биоптатов.
Далее пациенты были разделены на четыре группы в зависимости от уровня надира ПСА: ≤0,2 нг/мл (1-я группа), 0,21–0,5 нг/мл (2-я группа), 0,51–1 (3-я группа) и >1 нг/мл (4-я группа).
Биохимический рецидив констатировали в соответствии с критериями Stuttgart (надир ПСА+1,2 нг/мл) и Phoenix (надир ПСА+2 нг/мл).
Статистический анализ выполнен с помощью программного пакета SPSS v. 17 (SPSS Inc., США). В зависимости от характера распределения показателей применены параметрические и непараметрические методы статистического анализа. Формат представления данных при нормальном распределении М±σ, при распределении, отличающемся от нормального, – Ме (min-max). Значимость различия оценивали по критерию Стьюдента (нормальное распределение) и по критерию Колмогорова–Смирнова (независимо от распределения). Различия считали статистически значимыми при p<0,05. Кривые выживаемости строили по методу Каплана–Мейера и сравнивали с помощью log-rank-теста. Характеристика групп исследования представлена в табл. 1.

Результаты. Медиана (диапазон) периода наблюдения за пациентами составила 5,3 (3–7) года, средний срок до достижения надира ПСА – 14,5±2,6 нед. Надиры ПСА ≤0,2, 0,21–0,5, 0,51–1,0 и >1 нг/мл констатировали у 231 (35,1%), 132 (20,0%), 105 (15,9%) и 190 (28,8%) пациентов соответственно. Среднее число сеансов HIFU составило 1,35±0,55 при среднем количестве очагов воздействия 695,7±152. Отмечена значимая разница по среднему количеству сеансов HIFU (p=0,036). При этом 498 (75,6%) пациентам проведен один сеанс HIFU-аблации, 160 (24,3%) – два сеанса. Соотношение обработанного объема и объема простаты до операции (индекс обработанной ткани) составило в среднем 1,3±0,9 (р<0,001).
Уровень ПСА до ТУРП и исходный объем простаты были значительно выше у пациентов, достигших надира ПСА >1 нг/мл (4-я группа; p<0,001). Группы статистически значимо различались по количеству пациентов, подвергшихся ТУРП перед HIFU-аблацией (p<0,001). Распределение пациентов в соответствии с группами риска D’Аmico (низкий, промежуточный и высокий) между группами было равномерным. Также не установлено мужгрупповой статистически значимой разницы в количестве пациентов с различной стадией заболевания (T1 и T2).
Лечение общей когорты пациентов и подгрупп с разным надиром ПСА обобщено в табл. 2. Что касается среднего количества зон воздействия за один сеанс HIFU и среднего обработанного объема ткани простаты, между группами не было выявлено никакой значимой разницы.
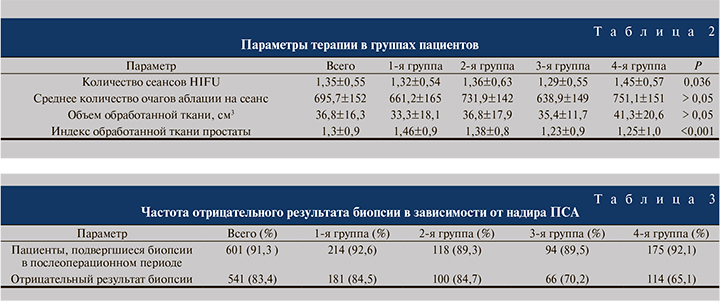
Эффективность проведенного лечения в соответствии с штутгартским определением в группах, выделенных по надиру ПСА, составила 82, 65, 43 и 32% соответственно (p<0,001), в соответствии с определением Phoenix – 94, 74, 66 и 47% (p<0,001) соответственно (см. рисунок).
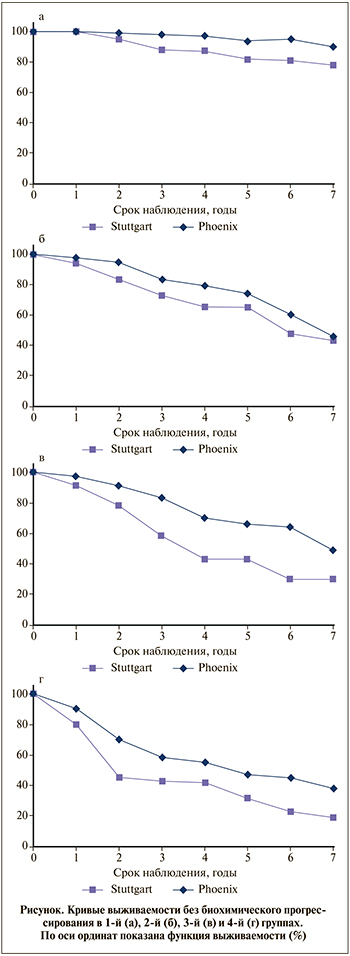 Результаты контрольной биопсии 601 (91,3%) пациентов продемонстрировали, что в 1-й и 2-й группах значительно большее количество пациентов, чем в других группах (примерно 85%), имели отрицательный онкологический статус по результатам морфологического исследования(табл. 3).
Результаты контрольной биопсии 601 (91,3%) пациентов продемонстрировали, что в 1-й и 2-й группах значительно большее количество пациентов, чем в других группах (примерно 85%), имели отрицательный онкологический статус по результатам морфологического исследования(табл. 3).
Обсуждение. Высокоинтенсивный фокусированный ультразвук является активно развивающимся альтернативным вариантом лечения локализованного РП [5, 9, 10–12]. Пятилетняя выживаемость без прогрессирования после применения HIFU составляет около 69–78% [13, 14]. Она сопоставима с выживаемостью при использовании радикальных методов лечения, таких как радикальная простатэктомия (76–84%) и дистанционная лучевая терапия (55–65%), у пациентов с клиническими стадиями T1–T2, хотя в исследованиях по этим видам лечения участвовали и пациенты с суммой Глисона ≥8 [15–19].
Ценность надира ПСА как самостоятельного предиктора исходов после HIFU-аблации оценивали и в других исследованиях [20, 21] Было продемонстрировано, что надир ПСА после HIFU-аблации значимо коррелирует с 5-летней выживаемостью без признаков заболевания, при определении которой ориентировались на критерии Phoenix, в группах пациентов с надиром до 0,2 нг/мл, 0,21–1,0 и выше 1 нг/мл. В настоящем исследовании вторая категория пациентов дополнительно разделена на группы с надиром ПСА 0,21–0,5 и 0,51–1,0 нг/мл.
Надир ПСА после HIFU-терапии при клинически локализованном РП коррелирует с вероятностью развития рецидива [20]. В нашей выборке пациентов, подвергшихся HIFU-аблации, получены похожие результаты; кроме того, установлено, что надир ПСА >1 нг/мл является крайне неблагоприятным прогностическим фактором, ассоциированным со 100%-ной вероятностью развития рецидива.
В проведенном нами исследовании 5-летняя выживаемость без биохимического рецидива после HIFU-аблации оценивалась с использованием двух критериев: Phoenix и Stuttgart. Штутгартское определение, т.е. превышение надира ПСА на 1,2 нг/мл, имеет чувствительность 77,5% и специфичность 79,0%. Чувствительность, специфичность, позитивная предиктивная ценность и негативная предиктивная ценность для критерия Phoenix – 64%, 78, 36 и 92% соответственно [5, 7]. Другой анализ показал, что надир ПСА служит ранним предиктором успешности терапии независимо от того, какое определение используется [22]. Были получены отличные 5-летние показатели выживаемости без биохимического рецидива у 84–94% пациентов с надиром ПСА ≤0,2 нг/мл и у 64–74% – с надиром ПСА 0,21–0,5 нг/мл. Наши данные согласуются с результатами указанных выше работ.
Следует отметить, что ПСА в раннем послеоперационном периоде зачастую поднимается выше надира при использовании таких видов лечения, как HIFU-аблация, брахитерапия и дистанционная лучевая терапия [23]. Поэтому лишь врач может определять, насколько клинически значимо повышение уровня ПСА в раннем периоде после лечения. Тем не менее подъем ПСА на 1,0 нг/мл выше надира в любом случае должен вызывать беспокойство.
В данном анализе мы также оценивали результаты биопсии в зависимости от надира ПСА. В группе с низким надиром (1-я и 2-я группы) частота отрицательного результата контрольной биопсии была значительно выше, чем в группах 3 и 4 (p<0,001). L. Poissonier et al. предоставили результаты HIFU-аблации на аппарате Ablatherm 227 пациентов. В этой работе неудачей лечения считали положительный результат биопсии или уровень ПСА >1 нг/мл с тремя последовательными повышениями [24]. Пациенты со значительным повышением уровня ПСА получали адъювантное лечение, однако 9 (32%) из 28 человек в этой группе имели отрицательный результат биопсии. Авторы сделали вывод, согласно которому результат биопсии не должен служить единственным критерием эффективности или неэффективности лечения. Исходные данные пациентов в нашем исследовании демонстрируют схожие переменные в группах, выделенных по надиру ПСА, за исключением исходного уровня ПСА, объема простаты и частоты выполнения ТУРП. Для достижения надира ПСА <0,2 нг/мл и отличных онкологических результатов чрезвычайно важен грамотный отбор пациентов. Из всех переменных можно управлять только одной – объемом простаты, для чего нужно выполнять ТУРП перед HIFU-аблацией.
Эффект уменьшения простаты можно усилить, выполнив процедуры ТУРП и HIFU-аблации с интервалом в несколько недель [10, 25]. Концепция проведения ТУРП перед HIFU-аблацией была предложена G. Vallancien et al. в 2004 г. [26]. Такой подход позволяет сокращать сроки катетеризации и улучшать функцию мочеиспускания без увеличения частоты осложнений. Результаты настоящего исследования также говорят в пользу того, чтобы HIFU-терапии обязательно предшествовала подготовительная ТУРП.
Заключение. Надир ПСА после HIFU-аблации значимым образом коррелирует с показателями рецидивов и безрецидивной выживаемости. Он достигается через относительно короткое время и может быть использован в повседневной клинической практике как инструмент-предиктор для прогнозирования вероятности развития рецидива и определения потребности в дополнительном лечении. От пациентов с надиром ПСА менее 0,2 нг/мл можно ожидать хорошей безрецидивной выживаемости. Штудгардский критерий и критерий Phoenix, изученные в ходе этого исследования, имеют достаточно большую положительную предиктивную ценность. Однако в дополнение к любому из этих биохимических определений требуется оценка реальной клинической ситуации. Нужно понимать, что после HIFU-аблации, брахитерапии и лучевой терапии часто происходит повышение уровня PSA от надира. Решение, имеет ли подъем уровня PSA клиническое значение, принимает исключительно лечащий врач.



