В настоящее время основным методом лечения рака предстательной железы (РПЖ) по-прежнему является хирургическое вмешательство – радикальная простатэктомия. Несмотря на увеличение доли пациентов с локализованной формой РПЖ, широкое внедрение малоинвазивной хирургии, эволюцию хирургической техники и высокую эффективность радикальной простатэктомии, до 30% пациентов сталкиваются с биохимическим рецидивом (БР) заболевания. Пациенты, у которых выявлен БР, имеют менее благоприятный прогноз [1]. У них достоверно выше вероятность прогрессирования заболевания и летального исхода [2]. Определение и разработка предикторов развития БР являются одной из основополагающих задач, решение которой необходимо для достижения максимально эффективного лечения РПЖ. Разработка многочисленных номограмм, включающих такие параметры, как клиническая стадия, индекс Глисона, инвазия в семенные пузырьки, имеют определенные прикладные преимущества, однако прогностическая ценность этих инструментов остается неудовлетворительной. Одним из активно изучаемых предикторов БР является наличие положительного хирургического края (ПХК). ПХК – наличие опухолевых клеток
на внешней границе прохождения разреза при удалении опухоли, выявляемое при микроскопическом исследовании. Открытие отдельных способов окрашивания тканей гематоксилином и эозином произошло во второй половине XIX в. В 1878 г. Busch объединил эти методы, что позволило создать «золотой» стандарт гистологического исследовании [3]. Оптимальными требованиями к использованию современных методов определения статуса хирургического края следует считать возможность проведения in vivo, минимальный ассортимент дополнительного хирургического оборудования, высокую скорость выполнения исследования (в мин), сокращение времени оперативного вмешательства, высокуючувствительность и специфичность, большую площадь исследуемой зоны предстательной железы (3–5 см3), минимизацию ложноотрицательных и ложноположительных результатов вследствие хирургического вмешательства (в т.ч коагуляции тканей). Наконец, метод должен быть интуитивно понятным и безопасным как для пациента, так и для медицинского персонала, а образец ткани должен быть доставлен в патологоанатомическое отделение минимально поврежденным, чтобы соответствовать стандарту гистологического исследования.
В связи с вышеизложенным актуально проведение обзора современных методов диагностики, статуса хирургического края при выполнении радикальной простатэктомии.
Нами на кафедре урологии и андрологии ЛФ РНИМУ им. Н. И. Пирогова на базе ГКБ № 1 им. Н. И. Пирогова выполнен описательный научный обзор. В сентябре 2021 г. проведен комплексный поиск литературы в базах данных PubMed и Web of Science за 1995–2020 гг., посвященной интраоперационным методам определения статуса хирургического края во время выполнения радикальной простатэктомии. Поиск проводили по ключевым фразам «рак простаты», «хирургический край», «радикальная простатэктомия», «биохимический рецидив», «методы определения хирургического края». На сегодняшний день разработаны и активно изучаются следующие технологии для оценки статуса хирургического края: использование аминолевулиновой кислоты, оптическая когерентная томография, оптическая спектроскопия, конфокальная лазерная микроскопия, 3D-дополненная реальность, 3D-моделирование, исследование свежезамороженныхсрезов.
Экспериментальные методы (пункты 1–5)
1. Использование аминолевулиновой кислоты
δ-Аминолевулиновая кислота (дельтаили 5-аминолевулиновая кислота, или 5-АЛК) – органическая кислота, первичный компонент синтеза тетрапирролов: порфиринов и корринов у животных и хлорофилла у растений. 5-АЛК является эндогенным соединением, одним из промежуточных продуктов синтеза гема. Ее избыточное введение в организм (или в ткани отдельных органов) приводит к ингибированию последнего этапа синтеза гема и накоплению его предшественника – эндогенного протопорфирина IX (ПпIX), преимущественно в опухолевых клетках и очагах воспаления [4]. Использование фотодинамической диагностики (ФДД) с использованием 5-АЛК была описана в ряде медицинских дисциплинах как инновационный метод интраоперационного обнаружения злокачественной ткани. Опубликованы научные работы о целесообразности использования данной методики для диагностики рака яичников, глотки и гортани, глиомы, рака молочный железы и метастазов в лимфатические узлы. Основным направлением использования ФДД в урологии является диагностика поверхностного уротелиального рака мочевого пузыря [5]. Zaak et al. впервые описали избирательное накопление ПпIX в тканях предстательной железы после радикальной простатэктомии [6] (рис. 1).
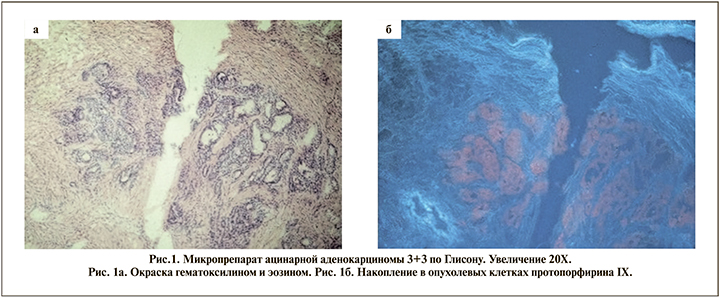
В настоящее время опубликовано несколько научных работ, посвященных применению 5-АЛК в диагностике статуса хирургического края при выполнении РПЭ [7–10]. Так, в исследование Ganzer были включены 24 пациента с локализованной формой рака предстательной железы, которые приняли препарат аминолевулиновой кислоты (перорально 20 мг на 1 кг массы тела) за 3 ч до лапароскопической радикальной простататэктомии с техникой нервосбережения. Интраоперационно на различных этапах простатэктомии была проведена диагностика статуса хирургического края в белом и фотодинамическом (ФДД) режимах. Подозрительные области, найденные на ФДД, были отмечены белыми чернилами для определения чувствительности и специфичности во время окончательного гистологического исследования. По результатам научной работы при эндоскопии в белом свете подозрений на ПХК не возникло. Шесть из восьми ПХК были подтверждены по результатам ФДД. В двух наблюдениях области с подозрением на этапе ФДД оказались отрицательными. В двух других наблюдениях ПХК не был обнаружен при ФДД (1 – шейка мочевого пузыря, 1 – боковая область простаты). Общая чувствительность и специфичность метода составили 75% и 88,2% соответственно. В другом исследовании Fukuhara et al. выполнили радикальную простатэктомию с применением ФДД (позадилонную и лапароскопическую) 52 пациентам с верифицированным раком предстательной железы. По результатам работы у 1 из 52 пациентов обнаружен подозрительный участок по результатам ФДД, который был подтвержден при окончательном гистологическом исследовании. Однако в двух других наблюдениях этой работы ПХК был пропущен при ФДД. Причиной этому, по мнению авторов, является короткая длина положительного края и тепловая дегенерация тканей, которая привела к ложноотрицательным результатам (рис. 2).
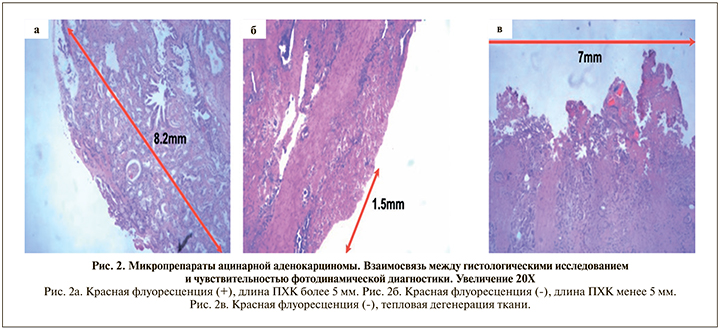
Резюмируя исследования, посвященные применению 5-АЛК в диагностике статуса ХК при выполнении РПЭ, чувствительность метода составила от 75 до 82%, а специфичность – от 68 до 88%.
Основное преимущество метода 5-АЛК:
- Возможность выполнения in vivo (необходимость оборудования).
Основные недостатки метода 5-АЛК:
- Кривая обучения.
- Компрометация тепла (вследствие коагуляции тканей) на результаты.
- Время подготовки.
- Побочные эффекты препарата.
Побочными эффектами введения 5-АЛК являются фотодерматоз, тошнота, рвота, повышение уровня аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ).
2. Оптическая когерентная томография
Оптическая когерентная томография (ОКТ) – это неинвазивный метод визуализации, который позволяет получать изображение микроструктуры тканей в реальном времени [11].Физический принцип действия ОКТ аналогичен ультразвуковому исследованию с той лишь разницей, что в ОКТ для зондирования ткани используется оптическое излучение ближнего инфракрасного диапазона (~1 мкм), а не акустические волны [12]. В исследовании Dangle и соавт. использована ОКТ в группе (n=100) пациентов, перенесших робот-ассистированную простатэктомию [13]. Авторы использовали ОКТ для оценки статуса хирургического края, наличие экстрапростатической инвазии и оценки инвазии опухоли в семенные пузырьки. Во время исследования для каждого случая получено 20 снимков ОКТ (основание семенных пузырьков, верхушка и шейка мочевого пузыря, заднелатеральная область простаты и любой пальпируемый узел). Всего получено 2000 изображений ОКТ. По результатам окончательного гистологического исследования, из 100 пациентов у 85 была стадия рТ2; у 15– рТ3. У 10 пациентов обнаружен ПХК. На основании полученных данных ОКТ (до гистологического заключения) авторы предполагали найти 21 ПХК, из которых 7 действительно оказались положительными, 14 – ложноположительными. Авторы предполагали найти 79 отрицательных ХК, из которых 76 действительно оказались отрицательными, 3 – ложноотрицательными. Чувствительность и специфичность метода в отношении статуса хирургического края составили 70 и 84% соответственно. Положительная и отрицательная прогностическая ценность – 33 и 96% соответственно (рис. 3).
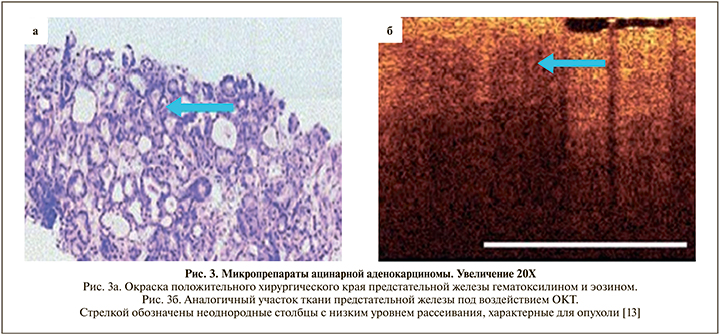
Основные преимущества метода ОКТ:
- Возможность выполнения in vivo (необходимость оборудования).
- Оценка всей поверхности предстательной железы, включая СНП.
- Скорость выполнения (около 5–10 мин). Основные недостатки метода ОКТ:
- Кривая обучения.
- Влияние крови и других тканей на результат.
- Малая площадь визуализации (2,7 мм).
- Незначительно количество научных работ.
3. Оптическая спектроскопия
Метод оптической спектроскопии основан на интерпретации специфических взаимодействий между электромагнитным излучением и тканью. Здоровые и опухолевые клетки характеризуются разными тканевыми свойствами: размер ядра, плотность клеток [14]. Оптическая спектроскопия измеряет интенсивность и спектр отраженного и обратно рассеянного света. В исследованиях, посвященных раку предстательной железы, использовались различные виды спектроскопий: флуоресцентная спектроскопия [15], релеевская (упругая) спектроскопия [14, 16, 17] романовская (неупругая) спектроскопия [18–20].
По данным последнего на данный момент систематического обзора, в который вошли 5 научных работ, суммарная чувствительность и специфичность оптической романовской спектроскопии составляют 0,89 (95% ДИ: 0,87–0,91) и 0,91 (95%ДИ: 0,89–0,93) соответственно [21]. Основные преимущества спектроскопии:
- Однозначный результат.
- Минимальное влияние крови на результат. Основные недостатки спектроскопии:
- Малая площадь визуализации (1 мм).
- Время на обработку данных.
- Не применялась in vivo.
4 Конфокальная лазерная микроскопия
Конфокальная лазерная микроскопия (КЛМ) – разновидность световой оптической микроскопии, обладающей значительным контрастом и пространственным разрешением по сравнению с классической световой микроскопией, что достигается использованием точечной диафрагмы, размещенной в плоскости изображения и ограничивающей поток фонового рассеянного света, излучаемого не из фокальной плоскости объектива [22]. КЛМ — это неинвазивный инструмент визуализации, который позволяет в реальном времени визуализировать клетки и структуры в живые ткани с разрешением, близким к гистологическому. Впервые метод был изобретен в 1957 г. и использовался в исследовательских целях для разработки новых инструментов [23]. КЛМ может выполняться в двух режимах: отражательный и флуоресценции (контрастирования). Метод КЛМ был успешно использован в научной работе, посвященной диагностике рака мочевого пузыря и верхних мочевыводящих путей in vivo [24] (рис. 4).
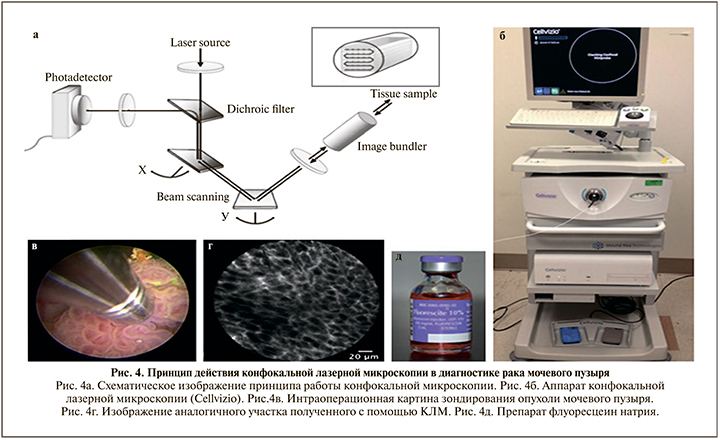
В исследовании Lopez и соавт. метод КЛМ был применен для визуализации рака предстательной железы in vivo и ex vivo [25]. Для КЛМ использовали 488 нм лазер и препарат флуфорор (флуоросцеин натрия), который вводили за 20 мин до оперативного вмешательства. Чувствительность и специфичность метода в работе не указаны. ПХК обнаружен не был. В другой работе Panarello и соавт. на основании собственных данных создали атлас, позволяющий сопоставлять и интерпретировать изображения, полученные с помощью КЛМ, и окончательным гистологическим исследованием. Это позволяет изучить эффективность применения данной технологии в отношении определения статуса хирургического края во время РПЭ [26]. Разновидностью КЛМ является флуоресцентная конфокальная микроскопия (ФКМ). Она сочетает два типа лазера, что позволяет выполнять исследование образцов ткани в двух режимах. Эта технология характеризуется разрешением по вертикали 4 мкм, глубиной проникновения 200 мкм и увеличительной способностью до 550 x. Примечательно, что глубину проникновения можно увеличивать, изменив мощность лазера и/или инкубационный период образца в красителе. Кроме того, цифровая обработка позволяет отправлять полученный результаты в электронном виде патологоанатому. ФКМ применяется в различных медицинских направлениях и показала многообещающие результаты [23]. Данный метод использовали для определения патологоанатомического исследования ткани предстательной железы в реальном времени (ex vivo). Метод показал высокую чувствительность и специфичность – 91 и 93,3% соответственно [27].
5. 3D-дополненная реальность и 3D-моделирование.
Дополненная реальность – результат введения в зрительное поле любых сенсорных данных с целью дополнения сведений об окружении и изменении восприятия окружающей среды. Интерес к использованию проекционных дисплеев в хирургии возник в 1990-х гг. [28, 29]. В настоящее время эта методика зарекомендовала себя во многих медицинских направлениях [30–32]. По данным крупнейшего систематического обзора, на данный момент опубликовано более 25 научных работ, посвященных применению 3D-моделирования/3D-дополненной реальности в лечении рака предстательной железы [33]. Прикладное значение этих технологий можно разделить на три направления: тренажеры, предоперационное планирование, интраоперационная навигация. Так, Ukimura и соавт. создали на основании трансректального ультразвукового исследования/ магнитнорезонансной томографии (ТРУЗИ/МРТ) и данных гистологического заключения биопсии 3D-модель предстательной железы [34]. Этот первоначальный опыт показал, что у 9 из 10 прооперированных пациентов (90%) был достигнут отрицательный хирургический край. Ограничивающим фактором описанной модели является отсутствие возможности наложения 3D-модели на орган in vivо. В настоящий момент в области цифровых технологий позволяет использовать новые модификации дополненной реальности. Porpiglia et al. сообщили об использовании эластичной 3D-модели виртуальной реальности, наложенной во время оперативного вмешательства. Эластичность модели позволяла ее изгибать и растягивать в зависимости от интраоперационной картины. Авторы сообщили, что этот метод позволяет предсказывать экстракапсулярную инвазию в 100% [35].
6. Свежезамороженные срезы
Техника свежезамороженных срезов была введена в конце XIX в., когда William Welch впервые исследовал образец, взятый из ткани молочной железы во время операции. Однако Thomas Cullen был первым, кто опубликовал описание интраоперационной техники в 1895 г. [36]. Методика основана на концепции быстрого замораживания тканей в криостате (от -16 до -20°С), таким образом происходит преобразование водного компонента образца в лед, позволяющее разрезать ткань на несколько образцов. После нарезки тканей выполняется стандартное гистологическое исследование с использованием гематоксилина и эозина [37]. В настоящее время техника свежезамороженных срезов является наиболее распространенным методом оценки статута хирургического края. В таблице приведена краткая информация об опубликованных исследованиях начиная с 2000 г. [38].
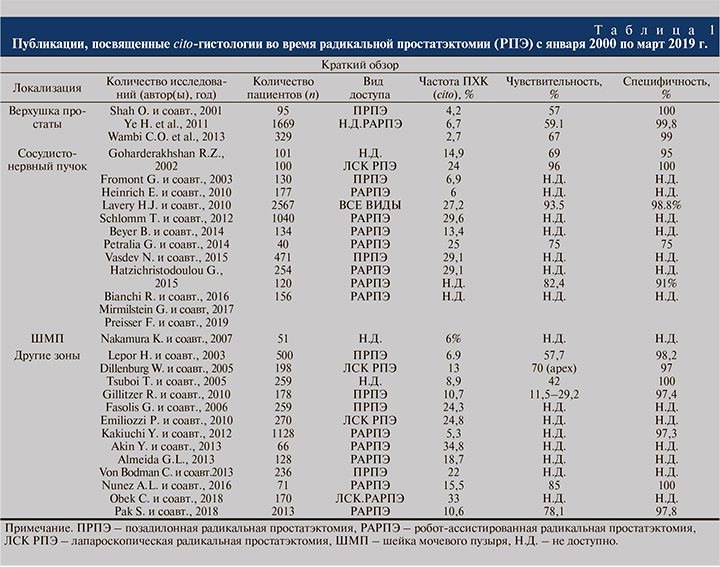
Известно, что простата покрыта фибромускулярной тканью, известной как капсула предстательной железы. Однако капсула покрывает простату неравномерно, истончаясь в некоторых частях предстательной железы, включая верхушку. Это затрудняет рассечение тканей в этой области из-за близости сфинктера уретры, который необходимо сохранить. Культя уретры (верхушка предстательной железы) – один из наиболее распространенных участков положительного хирургического края. Несколько работ посвящено анализу свежезамороженных срезов апикальной части простаты. По данным опубликованных статей, чувствительность и специфичность метода составили в диапазоне от 57 до 67% и от 99 до 100% соответственно [39–41]. Так, Ye H. и соавт. сравнили 5-летнюю безрецидивную выживаемость пациентов с отрицательным и положительным хирургическим краем после повторного иссечения изначально положительного края (по результатам cito-гистологии). В группе отрицательного хирургического края после повторного иссечения 5-летняя БРВ составила 93,75 против 80 % в группе положительного края после повторного иссечения ткани [42]. Вторым наиболее распространенным местом обнаружения положительного хирургического края является заднебоковая поверхность предстательной железы (сосудисто-нервный пучок). С тех пор как Walsh в 1983 г. описал нервосберегающую технику, произошла стандартизация этого метода для пациентов с локализованной формой рака с целью улучшения функциональных результатов. Недавний систематический обзор и мета-анализ показали, что сохранение нервов (одностороннее или двустороннее) не было связано со значительным увеличением риска ПХК у пациентов с pT2 или pT3 стадией [43]. Однако эти выводы остаются дискутабельными. По данным крупнейшего метаанализа, в который было включено 32 когортных исследования с участием 141 тыс. пациентов, выявлено отрицательное прогностическое влияние ПХК на онкологические результаты. По данным авторов, наличие ПХК статистически значимо ухудшает показатели безрецидивной выживаемости (БРВ) (p<0,001), канцерспецифической (p=0,001) и общей выживаемости (ОВ) (р=0,014) [44]. В настоящее время опубликовано значительное количество работ, посвященных исследованию свежезамороженных срезов с заднебоковой поверхности предстательной железы [45–47]. В 2012 г. Schlomm и соавт. в Martini-Klinik (Германия) разработали протокол исследования свежезамороженного участка, прилегающего к сосудисто-нервной структуре (NeuroSAFE – neurovascular structure-adjacent frozen-section examination), который с тех пор был валидизирован собственной когортой пациентов [48]. Авторы предоставили данные о 11 069 случаях открытых и робот-ассистированных простатэктомий, выполненных с помощью NeuroSAFE. Они сообщили об увеличении общего количества нерво-сберегающих простатэктомий с 81 до 97%. Число ПХК снизилось с 22 до 15% среди всех клинический стадий. Эта методика демонстрирует высокую чувствительность и специфичность – 93,5 и 98,8% соответственно. Однако отдаленные онкологические результаты остаются дискутабельными. Так, БРВ в группе NeuroSAFE достоверно не отличалась по сравнению с группой пациентов без выполнения NeuroSAFE. Данная методика получила достаточно широкое распространение в других урологических центрах. В опубликованных работах Beyer и соавт. и Mirmilstein и соавт. сообщается, что применение NeuroSAFE позволило снизить частоту ПХК (с 24 до 16% и с 17,8 до 9,2% соответственно). Помимо этого методика позволила увеличить число нервосберегающих простатэктомий (с 81 до 97% и с 69 до 75,1% соответственно) [49, 50]. Несмотря на это, опубликовано ряд работ, в которых показано, что достижение отрицательного хирургического края при использовании методов свежезамороженных срезов в проекции заднебоковой поверхности предстательной железы не оказывает существенного влияния на БРВ [51, 52]. C другой стороны, работа, посвященная анализу свежезамороженных срезов в области основания простаты (шейки мочевого пузыря), продемонстрировала способность снижать уровень ПХК до 0% [53].
Хирургическое вмешательство по-прежнему является «золотым» стандартом лечения локализованного РПЖ. Одним из способов улучшения онкологических и функциональных результатов является модификация хирургических подходов. Одним из таких подходов является интраоперационное определение статуса хирургического края. Несмотря на то что история исследования свежезамороженных срезов насчитывает более 100 лет, эта методика, несмотря на свои ограничения, остается основным «признанным» методом определения статуса ХК. Современное развитие в смежных с медициной областях позволяет предложить новые методы определения статуса ХК. Многие из этих методов демонстрируют многообещающие результаты. Однако большинство из них экспериментальные и не применяются в клинической практике. Необходимы дальнейшие исследования в этой области.



