Инфекция мочевыводящих путей (ИМП) представляет собой актуальную проблему общественного здравоохранения. В значительной степени это обусловлено ее высокой распространенностью: ежегодно не менее 150 млн человек обращаются за медицинской помощью по поводу ИМП [1]. По данным эпидемиологических исследований, один эпизод ИМП в течение жизни переносят по крайней мере каждая вторая взрослая женщина [2]. Большинство ИМП являются неосложненными, а самая частая нозологическая ее форма - это острый цистит. Чаще всего ИМП регистрируют у женщин в возрасте от 18 до 39 лет, а также старше 65 лет [3]. Значимость ИМП обусловлена не только ее высокой частотой, но и склонностью к рецидивированию. Так, после перенесенного эпизода острого неосложненного цистита (ОНЦ) в течение года у 30% женщин возникает рецидив ИМП, а у 10% он переходит в хроническую рецидивирующую форму [4, 5]. Именно ИМП рассматривают как наиболее частую причину дизурии у женщин [6].
К наиболее часто встречающимся бактериальным возбудителям ИМП относятся представители семейства Enterobacteriacecae. При этом основным уропатогеном вне зависимости от пола, возраста и категории больных (беременные, дети, взрослые) является E. coli. По данным многоцентрового исследования «ДАРМИС-2018» доля представителей Enterobacterales среди возбудителей ИМП составляет около 90%, а частота выделения E. coli в зависимости от субпопуляции пациентов варьирует в диапазоне 70-80% [7]. Рецидивирование ИМП обусловлено наличием у уропатогенов факторов вирулентности, способствующих преодолению врожденного и адаптивного иммунного ответа хозяина и колонизации стенки мочевого пузыря с последующим формированием биопленок и внутриклеточных бактериальных сообществ в уротелии [8].
Основными задачами при лечении ИМП являются эрадикация возбудителя и профилактика рецидивов. Для лечения острого цистита рекомендуется применение эмпирической антибактерильной терапии, а в случае рецидивирующих циститов противомикробные препараты назначаются с учетом чувствительности уропатогенов к антибиотикам [1, 5, 9]. Патогенез ИМП определяет необходимость проведения профилактики рецидивов. Отношение к длительной антибактериальной профилактике в настоящее время неоднозначное. С одной стороны, ее эффективность доказана результатами многочисленных клинических исследований, с другой стороны, достаточно быстро после прекращения даже длительной антибактериальной профилактики практически у половины женщин возникает рецидив ИМП [10]. Необходимость повторного назначения антибиотиков при рецидивирующих ИМП часто приводит к нарушению микробиоты кишечника и влагалища и формированию антибиотикорезистентности уропатогенов. Кроме того, бесконтрольное применение пациентами антибактериальных препаратов с несоблюдением схем дозирования приводит к формированию резистентных штаммов уропатогенов [11]. По этой причине в последние годы все большее внимание уделяется неантибактериальным методам лечения и профилактики ИМП: фито- и иммунотерапии, назначению пре- и пробиотиков, антиадгезинов и ряду других [5, 12, 13, 14].
Антибиотикорезистентность инфекционных агентов признана глобальной проблемой. В 2016 г. Всемирная организация здравоохранения опубликовала «Глобальный план действий по борьбе с устойчивостью к противомикробным препаратам», в котором рекомендовала максимально ограничивать применение антибиотиков и по возможности заменять их неантибиотическими методами терапии. Еще большую значимость данная проблема приобрела в ковидную эпоху. Пандемия COVID-19 привела к экспоненциальному росту использования противомикробных препаратов, что еще больше усугубило проблему антибиотикорезистентности. Следствием массового потребления антибиотиков в условиях пандемии COVID-19 явился дополнительный рост антибиотикорезистентности. Принимая во внимание этот факт, а также вероятность развития аллергических реакций, побочных эффектов и часто недостаточную эффективность антибактериальной терапии, во всем мире отмечается повышение интереса к альтернативным методам лечения и профилактики ИМП.
Одним из таких направлений является фитотерапия — применение с лечебной целью лекарственных препаратов растительного происхождения. Использование растений для лечения различных заболеваний уходит корнями в далекое прошлое. На протяжении многих тысячелетий в качестве лекарственных средств их использовали представители всех известных цивилизаций. Так, народы Древнего мира использовали с этой целью более 21 тыс. видов трав [15]. В современной медицине фитопрепараты не только не утратили своих позиций, но и еще более их укрепили. В США почти половина пациентов используют наряду с рецептурными препаратами различные альтернативные методы лечения хронических заболеваний, главным образом растительного происхождения [16]. В странах Европейского Союза доля фитопрепаратов составляет 10% от общего количества зарегистрированных лекарственных средств, в Российской Федерации — около 25%, а в Японии и странах Юго-Восточной Азии достигает 40% [17]. В России в клинической практике разрешено использовать лекарственные препараты растительного происхождения, только прошедшие государственную регистрацию и включенные в Государственный реестр лекарственных средств.
Лекарственные растения содержат комплексы биологически активных веществ, поэтому они зачастую имеют более широкий спектр действия по сравнению с синтетическими веществами. На эффекте синергизма основано составление фитосборов и многокомпонентных лекарственных средств из растительного сырья, у которых диапазон фармакологического действия еще шире. Нежелательные явления при приеме фитопрепаратов и побочные реакции встречаются примерно в 5 раз реже по сравнению с синтетическими лекарственными средствами [15]. Помимо лучшей переносимости фитопрепараты имеют и другие существенные преимущества по сравнению с химиопрепаратами: они легче включаются в процессы метаболизма, не отторгаются организмом, малотоксичны при длительном приеме, обладают более мягким действием, не вызывают привыкания к ним организма больных [18]. Многие растения богаты веществами с противомикробным действием, такими как терпены, эфирные масла, фенолы и феноловые кислоты, флавоноиды, танины, кумарины, лектины и полипептиды. [19]. Благодаря наличию таких биологически активных веществ в растительном сырье препараты растительного происхождения, как правило, активны в отношении штаммов микроорганизмов и вирусов, уже приобретших устойчивость к антибиотикам [20]. Применение фитопрепаратов в качестве монотерапии эффективно на ранних стадиях патологических процессов, при вялотекущих и хронических заболеваниях. При острых состояниях и тяжело протекающих хронических заболеваниях фитотерапию следует применять как вспомогательный метод, повышающий эффективность и переносимость других методов лечения.
Использование современных технологий (биохимических, биологических, структурно-аналитических) дало возможность выделять действующие вещества лекарственных растений, что обусловливает понимание их механизмов действия как на организм в целом, так и на клеточном и молекулярном уровнях. Важным звеном производства фитопрепаратов является стандартизация растительного сырья. Оно должно быть собрано в период максимальной концентрации активных компонентов, соответствовать нормам экологической безопасности. Для обеспечения высокого качества сырья необходимо правильно выбрать район и место заготовки, а для культивируемых видов — район культуры. Регламентируются сроки и приемы сбора сырья, характер его первичной обработки сырья, условия сушки, сортировки и упаковки. Содержание биологически активных веществ, полученных из дикорастущих растений или выращенных в нестандартизированных условиях, может различаться от 2 до 4 раз. Применение инновационных и запатентованных технологий (низкотемпературная вакуумная экстракция, автоматизация производственных процессов, лабораторный контроль биохимического состава экстракта на каждой стадии производственного процесса и др.) позволяют получать готовые специальные экстракты, отличающиеся высоким содержанием биологически активных веществ лекарственных растений с постоянным соблюдением их пропорций и концентрации независимо от партии и года сбора урожая [21]. Растительные препараты фабричного производства соответствуют этим требованиям. Фитотерапия при инфекционно-воспалительных заболеваниях почек и мочевыводящих путей должна оказывать комплексное воздействие: диуретическое, антибактериальное, противовоспалительное и спазмолитическое [20]. Растительные препараты необходимо назначать минимум на 3—4 недели. Несоблюдение этого правила чаще всего обусловливает неуспешность фитотерапии.
Фитопрепараты широко используются в лечении ИМП [13, 20, 22].В 2018 г. были опубликованы результаты опроса практикующих врачей-урологов, проведенного в нескольких лечебных учреждениях нашей страны и посвященного роли фитотерапии в лечении ИМП [23]. Специально разработанную анкету заполнил 161 уролог. Анализ ответов показал, что 93,8% врачей убеждены в необходимости назначения антибактериальной терапии совместно с фитопрепаратами, при этом 12,4% врачей начинают эмпирическую терапию острого неосложненного цистита с лекарственных средств растительного происхождения.
Одним из наиболее известных фитопрепаратов для лечения ИМП является Фитолизин в форме пасты. На отечественном фармацевтическом рынке он присутствует с 1996 г. — уже более четверти века. За прошедшее время неоднократно были подтверждены высокая эффективность и хорошая переносимость Фитолизина. Патогенетическая обоснованность и клиническая эффективность Фитолизина обеспечивается сбалансированным составов его компонентов, обладающих широким спектром фармакологической активности. В 100 г пасты Фитолизина содержится 67,2 г экстракта смеси трав — шелухи лука репчатого, корневища пырея, листьев березы, семян пажитника, корня петрушки, травы золотарника, травы хвоща полевого, травы птичьего горца, корня любистока, а также апельсиновое, сосновое и шалфейное масло, масло из перечной мяты и вспомогательные вещества: агар-агар, этилпарагидроксибензоат, крахмал пшеничный, ванилин, глицерол (глицерин). Входящие в состав препарата биологически активные вещества оказывают разнонаправленные эффекты, усиливающие друг друга, что в результате позволило получить препарат с комплексным действием на почки и мочевыводящие пути — спазмолитическим, диуретическим, и противовоспалительным. Фитолизин относится к фармакологической группе — диуретическое средство растительного происхождения. Показаниями к его применению служат инфекционно-воспалительные заболевания мочевыводящих путей (в составе комплексной терапии) и нефроуролитиаз (в составе комплексной терапии). Фитолизин выпускается в виде пасты для приготовления суспензии для приема внутрь, а также в виде капсул. Паста Фитолизин зелено-коричневого цвета мягкой консистенции со специфическим запахом, обусловленным наличием растительных компонентов и эфирных масел в качестве вспомогательных веществ. Взрослым назначают внутрь по 1 чайной ложке пасты, растворенной в 1/2 стакана теплой сладкой воды, 3—4 раза в сутки после еды. Противопоказаниями к применению препарата являются повышенная чувствительность к компонентам препарата, почечная недостаточность, сердечная недостаточность, гломерулонефрит, фосфатный уролитиаз, возраст до 18 лет [24]. Фитолизин может применяться в комплексном лечении ИМП вместе с антибиотиками или после их применения на этапе противорецидивной терапии. Курс терапии Фитолизином составляет 2—6 недель и при необходимости может быть продлен.
В 2022 г. на аптечном рынке появляется новая лекарственная форма Фитолизин в виде мягких желатиновых капсул. Капсулы и паста имеют идентичный состав. В фармацевтической промышленности для производства биологически активных добавок на основе растительных веществ, витаминов и лекарственных средств используются мягкие и твердые желатиновые капсулы. В мягкие желатиновые капсулы можно инкапсулировать активные вещества в форме масел, масляных суспензий или паст. Мягкие желатиновые капсулы — это наиболее точно дозированная форма из всех твердых пероральных лекарственных форм [25]. Герметичность капсул защищает растительные компоненты от окисления, а непрозрачность оболочки обеспечивают защиту фоточувствительной продукции. Оболочка мягких капсул маскирует органолептические свойства активных ингредиентов, после проглатывания оболочка растворяется в течение 3—5 мин, быстро высвобождая активное содержимое. Эта лекарственная форма растительного препарата имеет еще ряд преимуществ: наполнитель герметично удерживается в желатиновой оболочке, при производстве достигается точность дозирования активных компонентов наполнителя, производство таких капсул полностью автоматизировано. Мягкие желатиновые капсулы легко глотаются благодаря мягкой, гладкой, скользящей оболочке и обтекаемой форме, что особенно важно для пациентов, испытывающих трудности при проглатывании. Указанная форма Фитолизина особенно удобна для пациентов с дисфагией: до 35% амбулаторных пациентов в возрасте от 50 до 79 лет имеют симптомы дисфагии разной степени выраженности, при этом их частота увеличивается с возрастом и при прогрессировании неврологических заболеваний [26]. На производстве капсулы расфасовывают в герметичный блистер или в банку. Такая упаковка мягких желатиновых капсул обеспечивает отсутствие контакта с внешней средой и позволяет сохранять заявленные свойства в течение срока годности продукции. Для достижения терапевтического результата приверженность пациентов к лечению остается определяющей. Одна из потенциальных причин некомплаентности — сложность режима и способа приема лекарственного препарата как фактора, ухудшающего качество жизни. Удобство лекарственной формы существенным образом влияет на эффективность лечения. Фитолизин в форме капсул удобен при приеме, что обеспечивает высокую комплаентность даже при длительном употреблении.
Фитолизин-капсулы показаны к применению в составе комплексной терапии и в качестве профилактики инфекционно-воспалительных заболеваний мочевыводящих путей и нефроуролитиаза (с образованием мелких конкрементов).
Фармакологические свойства компонентов Фитолизина
Шелуха лука репчатого (или лука репчатого луковиц чешуя наружная сухая). Луковая шелуха содержит значительное количество различных биологически активных веществ, среди которых в первую очередь необходимо отметить бифлавоноид кверцетин. Кверцетин относится к витаминным препаратам группы Р и является агликоном рутина. Данное биологически активное вещество обладает противовоспалительными, бактерицидными, иммуностимулирующими, антиоксидантными и противоаллергическими свойствами. В 100 г шелухи лука содержится 3652 мг кверцетина. Одновременное наличие в шелухе лука рутина и витамина С способствует усилению эффекта каждого из них [27].
Корневище пырея. Лечебные свойства пырея ползучего обусловлены богатым биохимическим составом его корневищ, которые содержат флавоноиды, кумарины, дубильные вещества, сапонины, слизи, полисахариды (в том числе инулин), витамины (аскорбиновая кислота, в-каротин), агропирен (природное алициклическое соединение) [28].
В народной медицине корневище пырея используется как компонент сбора для лечения острого цистита [29]. S.S. Beydokthi et al. (2017) выявили у ацетонового экстракта корневищ пырея в концентрациях >250 мкг/мл антиадгезивную активность в отношении уропатогенных штаммов E. coli. Путем фракционирования данного вещества был выделен (Е)-гексадецил-3-(4-гидроксифенил)-акрилат, являющийся сложным эфиром гексадецил-кумаровой кислоты, который непосредственно обеспечивает антиадгезивную активность [30]. Полисахариды, флавоноиды и дубильные вещества обусловливают противовоспалительный и антиоксидантный эффекты корневища пырея [28]. В исследовании F. Grases et al. (1995) приведены данные о литолитической активности экстракта пырея относительно оксалатно-кальциевых солей [31].
Листья березы содержат эфирные масла, смолистые вещества, сапонины, флавоноиды, аскорбиновую кислоту. Галеновые формы из листьев обладают противовоспалительным и антисептическим эффектами. Диуретический эффект препаратов березы обусловлен флавоноидами, причем это действие потенцирует содержащийся в листьях березы нитрат калия [32]. Наличие фенольных соединений и эфирных масел обеспечивает антибактериальную активность в отношении многих штаммов патогенных грамположительных и грамотрицательных микроорганизмов, а также патогенных грибов, вирусов, простейших (парамеций, трихомонад и лямблий) [32].
Семена пажитника. В семенах пажитника содержатся алкалоиды, эфирные масла, стероидные сапонины, флавоноиды, кумарины, полисахариды, незаменимые аминокислоты, углеводы (45—60%), витамины (А, С, В, Р), минеральные вещества (кальций, магний, калий, железо, цинк, натрий, фосфор). Кроме того, в них содержиатся аскорбиновая кислота, ретинол и витамины группы В. Семена стимулируют выработку инсулина, оказывают гипогликемическое воздействие инсулиннезависимыми механизмами. Пажитник используется в качестве мочегонного растения, обладает антиоксидантным и противовоспалительным действиями [33].
Корень петрушки. В корне растения содержатся значительное количество эфирных масел, витамины С, А и К, а также макро- и микроэлементы: магний, фосфор, железо, кальций, калий, селен. Основными соединениями эфирного масла являются апиол и миристицин. Корень этого растения содержит много антиоксидантов, таких как флаваноиды, каротиноиды и аскорбиновая кислота. S. E. Nielsen et al. в течение 2 нед. изучали влияние потребления петрушки на экскрецию флавоноидов с мочой и на биомаркеры окислительного стресса. В ходе исследования выявлено снижение активности антиоксидантных ферментов [34]. Препараты корней петрушки оказывают спазмолитическое и мягкое мочегонное действие, что подтверждено многочисленными фармакологическими исследованиями [35].
Трава золотарника. Золотарник обыкновенный, или золотая розга, широко распространен по всей Европейской части России, на Кавказе и в Западной Сибири. Всего известны около 190 видов этого растения, с лечебной целью используется его наземная часть. Растение нашло широкое применение в народной медицине. Его мочегонное действие используют в отношении пациентов с инфекционновоспалительными заболеваниями почек и мочевого пузыря, уролитиазом. В XVI в. немецкий ботаник Якоб Теодор Табернемонтан так образно охарактеризовал клинический эффект золотарника: «...он также очищает почки и мочевыводящие пути от всей грубой слизи» [36].
Золотарник обыкновенный содержит массу биологически активных веществ: фенолкарбоновые кислоты и их производные, флавоноиды (кемпферол, кверцетин, рутин, изорамнетин), кумарины, эфирные масла, аминокислоты, полисахариды, липофильные вещества, дитерпены, массу тритерпеновых сапонинов. Такое многообразие обусловливает широкий спектр его фармакологических свойств. Золотарник обладает спазмолитическим, противовоспалительным, диуретическим, анальгетическим, антиоксидантным и антибактериальным эффектами [37, 38]. Столь широкий диапазон делает это растение по-настоящему уникальным в лечении и профилактике острого и рецидивирующего цистита, что было подтверждено результатами многих клинических исследований. Вазодилатирующий эффект препаратов золотарника обусловлен ингибирующим действием флавоноидов (кверцетин и кемпферол) в отношении протеинкиназы С, фосфодиэстеразы и циклических нуклеотидов, уменьшения транспорта ионов Ca2+ [39]. Эффективность использования золотарника для лечения гиперактивного мочевого пузыря объясняется его способностью блокировать М2- и М3-холинорецепторы [40]. Золотарник обладает умеренной антибактериальной активностью в отношении основных уропатогенов — возбудителей цистита (E. coli и Kl. pneumoniae) [41].
Полагают, что антибактериальный эффект золотарника обусловлен подавлением активности фермента дигидрофолатредуктазы [42] и способностью повреждать клеточную или внутриклеточные мембраны бактерий с последующей их гибелью [43].
Противовоспалительный эффект золотарника достаточно хорошо изучен на экспериментальных моделях [44]. Установлено, что он обусловлен действием лейокарпозида — фенольного гликозида листьев и стеблей растения [45]. Также показана способность золотарника ингибировать провоспалительный энзим — лейкоцитарную эластазу, а также стимулировать синтез глюкокортикоидов в надпочечниках, модулирующих реакции воспаления [46]. Экстракт золотарника способен оказывать обезболивающее действие за счет подавления активности брадикининовых рецепторов [47].
Фитопрепараты, содержащие экстракты золотарника, обладают диуретическим эффектом, причем при увеличении объема выделяемой мочи не происходит существенного увеличения экскреции с мочой ионов натрия, калия и кальция. Механизм этого эффекта пока изучен недостаточно, но одним из возможных вариантов является ингибирующее действие флавоноидов, особенно кверцетина, на фермент нейтральную металлоэндопептидазу. Подавление ее активности способствует усилению диуреза [48]. Мочегонное действие, проявляемое золотарником, способствует санации мочевыводящих путей за счет «вымывания» находящихся там бактерий.
Хвоща трава. В народной медицине хвощ традиционно использовали как кровоостанавливающее и мочегонное средство. Кроме этого в аюрведической медицине хвощ используется при лечении заболеваний предстательной железы, недержания мочи и энуреза у детей [49]. В состав этого растения входят углеводы (пектин, галактоза, глюкоза, манноза, арабиноза, ксилоза), органические кислоты (аконитовая, фумаровая, глюконовая, глицериновая, яблочная, малоновая, хинная, цикориевая), стероиды (в-ситостерин, кампестерин, изофукостерин), сапонины и флавоноиды (изокверцитрин, кемпферол, кверцетин, лютеолин), дубильные вещества (ванилиновая, протокатеховая, галловая, феруловая, кофейная кислоты) и каротиноиды (в-каротин и Y-каротин, лютеин). Диуретический является основным фармакологическим эффектом растения [50]. Было установлено, что употребление отвара травы хвоща в течение 4 нед. способствует увеличению диуреза на 18%, в течение 12 нед. — на 24% [51]. Современными исследованиями in vitro доказана противомикробная активность экстрактов травы хвоща. Так, в работе А. Pallag et al. (2018) установлено, что экстракт хвоща в концентрации 50 мг/мл подавляет рост Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus mutans [52]. N. Radulovid et al. (2006) показали, что эфирное масло хвоща в разведении 1:10 обладает выраженной антимикробной активностью в отношении Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Salmonella enteritidis и грибов Aspergillus niger или Candida albicans [53]. Антибактериальный эффект экстракта травы хвоща основан на том, что эфирные масла растения инактивируют микробные протеины адгезии и транспортные белки, что приводит к разрыву клеточной мембраны микроорганизма [54]. Необходимо отметить, что в хвоще полевом в большом количестве содержится кремниевая кислота. В моче кремниевые соединения образуют защитные коллоиды, которые уменьшают степень кристаллизации минеральных солей, тем самым препятствуя образованию нерастворимого осадка [55].
Трава птичьего горца (спорыш). В лечебных целях используют надземную часть растений. Среди химических веществ флавоноиды (главным образом авикулярини и кверцитрин), дубильные вещества, аскорбиновая кислота, витамин К, соединения кремниевой кислоты. Проведенные исследования выявили у экстракта горца птичьего противомикробное, вяжущее, противовоспалительное и мочегонное действия. Фармакологические эффекты горца птичьего связаны главным образом с содержащимися в нем флавоноидами, которые в дозах 50 мг/кг и выше оказывают выраженное антиоксидантное и противовоспалительное действия. При моделировании острой воспалительной реакции, индуцированной полисахаридами, флавоноиды экстракта горца птичьего значительно снижают экспрессию провоспалительных цитокинов (мРНК TNF-a, IFN-a, IFN-y и IL-2), опосредованно подавляют JNK-терминальную киназу, мутоген-активированную протеинкиназу и одновременно оказывают мощное антиоксидантное действие, снижая уровень малонового диальдегида и повышая активность эндогенной антиоксидантной системы (супероксиддисмутаза, каталаза) [56, 57]. В основе спазмолитического эффекта горца птичьего лежит способность флавоноидов блокировать кальциевые ионные каналы и снижать высокую К+-индуцированную предкондукцию в гладкомышечных клетках [58].
Хорошо изучены антибактериальные свойства экстрактов и фракций горца птичьего. Спектральный анализ активных веществ позволил идентифицировать паникудин (6-гидрокси-11-дезокси-13 дегидрогетизан), который обладает выраженной активностью в отношении основных грамотрицательных и грамположительных микроорганизмов и грибов, за исключением C. albicans [59].
Трава горца птичьего препятствует образованию мочевых камней, что связывают с наличием в экстрактах фитопрепарата растворимых соединений кремниевой кислоты и других биологически активных веществ. В экспериментальном исследовании J. Saremi et al. изучали уролитиаз на животных (крысы). Животные получали водный экстракт горца птичьего в дозах 100 и 400 мг/кг. Результаты исследования показали, что этот фитопрепарат значительно уменьшал отложение кристаллов оксалата кальция (р<0,05) и интерстициальные изменения в почках (р<0,05). На основании полученных данных был сделан вывод, согласно которому экстракт горца птичьего эффективен в качестве профилактики и лечения оксалатно-кальциевых камней в почках [60].
Любистока лекарственного корневища и корни содержат эфирные масла, также лецитин, фурокумарины, фалькариндиол, органические кислоты (фенольную, бензойную, уксусную, изовалериановую и яблочную), соли калия, смолу, камедь и флавоноиды. Корень любистока содержит 0,6—1,7% эфирного масла, основными составляющими которого являются терпены и терпеноиды. Содержащиеся в любистоке вещества обусловливают широкий спектр фармакологических эффектов - диуретического, спазмолитического, анальгетического и антибактериального. Данный фитопрепарат широко используется в терапии мочекаменной болезни, цистита, пиелонефрита, гломерулонефрита [61].
Микробиологические исследования показали, что водные экстракты любистока сдерживают рост Ps. aeruginosa, Pr. vulgaris и Staph. aureus. Бактерицидная активность в отношении этих патогенов выявлена при использовании водного экстракта растения в концентрации 100% и 50%, меньшие концентрации водного экстракта корней и корневищ любистока лекарственного не оказывают бактерицидного и бактериостатического действий [62]. Водный экстракт растения обладает синергической активностью с ципрофлоксацином в отношении E. coli, Ps. aeruginosa, Kl. pneumoniae [63].
Бутилиденфталид и лигустилид, выделенные из корня любистока, обладают спазмолитическими свойствами [64]. В эксперименте на изолированном участке тонкой кишки изучали влияние экстракта любистока лекарственного на тонус гладкой мускулатуры интактного кишечника и в условиях ацетилхолинового спазма. При введении экстракта любистока тонус кишки снизился на 90,84% (р<0,001), а на фоне ацетилхолинового спазма - на 40,35% относительно исходного тонического уровня (р<0,001) [65].
В качестве вспомогательных веществ Фитолизин паста и капсулы в своем составе имеют еще и эфирные масла. Эти масла представляют собой сложные смеси, содержащие более 300 различных соединений, которые относятся к различным химическим классам: спирты, простые эфиры или оксиды, альдегиды, кетоны, сложные эфиры, амины, амиды, фенолы, гетероциклы и главным образом терпены [66].
Антибактериальные свойства эфирных масел известны с древних времен. Эфирные масла имеют широкий спектр действия как на бактерии, так и в отношении грибов и вирусов. Это объясняется их использованием в медицинских целях, в фармацевтической промышленности. Гидрофобность эфирных масел позволяет им проникать в липиды клеточной мембраны бактерий, нарушая структуру и делая ее более проницаемой, что приводит к гибели бактериальной клетки. Следует отметить, что эфирные масла более активны в отношении грамположительных бактерий. Антибактериальная активность эфирных масел связана с их химическим составом, пропорциями летучих молекул и их взаимодействиями [66].
Эфирные масла способствуют проникновению антибиотиков в ткани, что позволяет снижать дозы антибиотиков при тяжелых заболеваниях [67]. Многие эфирные масла являются антиоксидантами, эффективность которых не уступает таковой синтетических антиоксидантов. В то же время они практически безопасны для здоровья. Такими свойствами обладают эфирные масла, содержащие фенолы: эвгенол, тимол, карвакрол [68].
Эфирные масла снижают тонус гладких мышц, действуя непосредственно на мышечную клетку [69]. Некоторые эфирные масла оказывают сосудорасширяющий эффект, благодаря чему улучшается почечный кровоток. Это приводит к увеличению водного диуреза [70].
Состав и фармакологические эффекты компонентов препаратов - паста и капсулы Фитолизин - представлены в таблице.
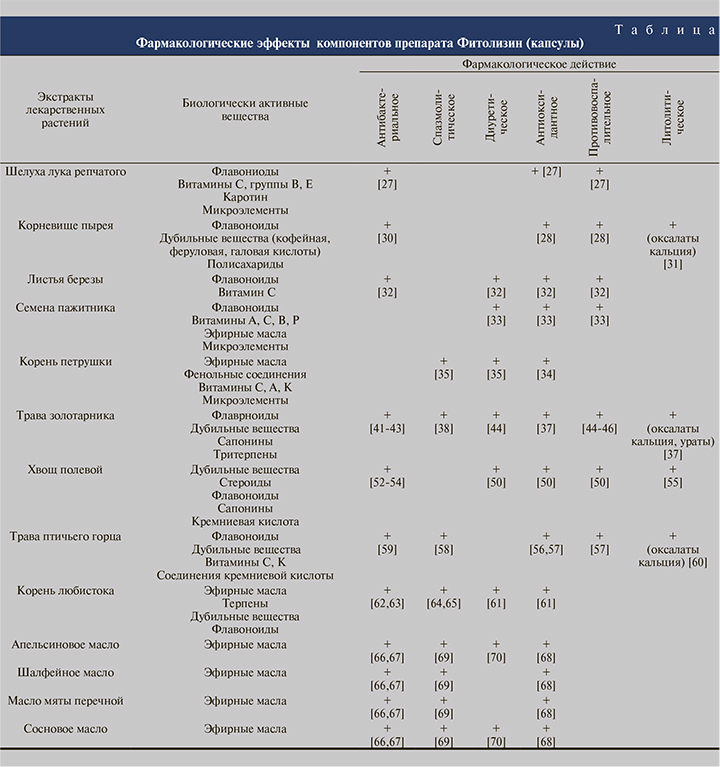
Фитолизин относится к клинико-фармакологической группе фитопрепаратов с диуретическим, спазмолитическим и литолитическим действиями. От синтетических препаратов растительные средства отличаются разносторонностью действия. К дополнительным положительным фармакологическим эффектам этого препарата относятся антибактериальный, антиоксидантный и противоспалительный.
Эффективность использования Фитолизина в лечении ИМП доказана многолетним опытом применения и клиническими исследованиями.
В 2018 г. А. В. Кузьменко и соавт. изучили эффективность комплексного лечения 63 женщин с острым неосложненным циститом с применением препарата Фитолизин. Пациенты были разделены на 2 группы: основную (n=32) и контрольную (n=31). В качестве антибактериальной терапии всем женщинам был назначен фосфомицин 3,0 г однократно. Дополнительно больные основной группы принимали Фитолизин, согласно инструкции, 3 раза в день в течение месяца. В ходе дальнейшего 3-месячного наблюдения в группе пациенток, принимавших Фитолизин, число зафиксированных рецидивов было в 2 раза меньше и составило 3 (9,4%) случая, при этом лишь у 1 (3,2%) женщины результаты посева совпали с исходными [71].
Кроме того, имеется опыт использования пасты Фитолизин 55 больными (37 женщин и 18 мужчин) с рецидивным фосфатным уролитиазом. В общем анализе мочи у всех больных была выявлена лейкоцитурия, у подавляющего большинства (87%) — кристаллурия кальция фосфатов и трипельфосфатов. При микробиологическом исследовании у всех пациентов отмечали бактериурию. При этом выявляли уреазопродуцирующие штаммы Ps. aeruginosa, Proteus mirabilis, Proteus vulgaris: титр составил от 104 до 106 КОЕ/мл. Пасту Фитолизин применяли по 1 чайной ложке, разведенной в половине стакана подслащенной воды, 3 раза в сутки после еды. Длительность курса лечения Фитолизином составила 1—2 месяца. Кроме Фитолизина всем больным назначали диету, ограничивающую потребление цитрусовых, сухофруктов и продуктов с высоким содержанием камнеобразующих веществ или их предшественников, прием жидкости не менее 2 л/сут. Влияние препарата на организм больных оценивали по 15 биохимическим показателям крови и мочи и по 3 показателям общего анализа мочи: рН, количеству лейкоцитов и кристаллурии с определением ее типа. У больных с лейкоцитурией отмечено уменьшение ее выраженности. У 72,7% больных зарегистрировано снижение рН мочи с 6,75±0,29 до 6,44±0,18. В инструкции к препарату указано на подщелачивающее мочу действие Фитолизина: полученный эффект можно объяснить его сочетанным действием, приводящим к уменьшению инфекционно-воспалительного процесса, вызванного уреазопродуцирующей микрофлорой и как результат этого — подкисление мочи. Кристаллурия фосфатов сохранялась, но превалировала кристаллурия кальция фосфатов (а не трипельфосфатов). Почечная экскреция мочевой кислоты увеличилась с 3,88±0,14 до 4,46±0,23 ммоль/сут. в 83,6% случаев [72].
Приведенные данные свидетельствуют о том, что эффективность Фитолизина для лечения инфекционно-воспалительных заболеваний мочевыделительной системы, а также мочекаменной болезни не вызывает сомнений.
Фитолизин выпускается в двух лекарственных формах: паста и капсулы. Известно, что жидкие лекарственные формы усваиваются организмом более полно и быстро, чем твердые, поэтому Фитолизин пасту можно использовать в острый период заболевания с целью максимально быстрого достижения фармакологического эффекта. Капсулы Фитолизина не отличаются по составу от пасты. Их можно принимать не только в острый период, но и для профилактики рецидивов заболевания. Новая лекарственная форма обеспечивает простоту приема для пациентов, удобство транспортировки и хранения, а также точность дозирования.



