Введение. Хронический рецидивирующий цистит (ХРЦ) у женщин – одна из наиболее актуальных и не нашедших однозначного решения проблема современной урологии [1–3].
Несмотря на соблюдение всех современных стандартов лечения, ХРЦ остается распространенным и трудноизлечимым заболеванием, особенно в женской популяции, вследствие многогранности этиопатогенеза [4–6].
Наиболее сложным и дискутабельным разделом данной проблемы является диагностика и лечение ХРЦ папилломавирусной (ПВ) этиологии [7].
Участие вируса папилломы человека (ВПЧ) в качестве этиологического фактора ХРЦ дискутируется; обусловлено данное обстоятельство отсутствием специфических маркеров и/или критериев диагностики данной нозологии [8]. Кроме того, ХРЦ, вызванный ПВИ, характеризуется тяжелым течением и выраженностью симптомов со стороны нижних мочевыводящих путей (СНМП), также отличительной чертой такого состояния служит отсутствие или низкая степень контаминации бактериального фактора при микробиологическом исследовании с учетом аэробных и анаэробных методик культивирования [9]. Обусловлено это многогранностью патогенеза и сложностью лечения ПВ-поражения мочевого пузыря. К тому же ПВИ, как правило, является первоначальным повреждающим фактором уротелия, нарушающим его проницаемость и вызывающим дисфункцию иммунокомпетентных клеток. При этом даже нормальная микробиота мочи может быть патогенной и вызывать коллаборационно с ПВИ инфекционно-воспалительный процесс в мочевом пузыре [9, 10].
Немаловажен и следующий факт: ХРЦ ПВ-этиологии приводит к снижению физической, психической активности и качества жизни женщин вследствие выраженной боли, локализующейся не только в надлонной области, но и в преддверии влагалища, в уретре и др.
Поэтому при лечении ХРЦ ПВ-этиологии актуально не только увеличение безрецидивного периода, но и улучшение качества жизни, снижение интенсивности боли, на которой акцентируют внимание пациентки с данным заболеванием. Известно, что боль при ПВИ имеет сложный механизм, одним из звеньев которого является периферическая нейропатия, обусловленная негативным воздействием ВПЧ.
В связи с этим очень ценными представляются свойства Аллоферона (Аллокин-альфа). Известно, что препарат регулирует проведение возбуждения через клетки и нервы гладкой мускулатуры, при этом происходит стимулирование передачи нервно-мышечных импульсов, нарушенной ввиду блокады калиевых каналов ПВИ. Кроме того, усиливается воздействие гистамина, окситоцина, ацетилхолина и серотонина на гладкую мускулатуру, т.е. оказывается мощное антипролиферативное воздействие на уротелиальные, нервные структуры мочевого пузыря, что тем самым способствует редукции болевой симптоматики [11].
Цель исследования: изучить эффективность Аллоферона в комплексной терапии хронического рецидивирующего папилломавирусного цистита.
Материалы и методы. Обследованы 46 пациенток с ХРЦ ПВ-этиологии, в зависимости от проводимой терапии рандомизированные в две группы. В I группе (n=22) пациентки получали комбинированную терапию, дополненную аллокином-альфа, который вводили подкожно через день, на курс 6 инъекций. Во II группе (n=24) пациентки получали комбинированную терапию без исследуемого препарата. Для постановки диагноза и последующего мониторинга использовали опросники оценки клинической симптоматики (ВАШ, опросник Female Genitourinary Pain Index), общеклиническое, культуральное и цитологическое исследования мочи, цистоскопию и морфологическое исследование биоптатов мочевого пузыря, исследование мочи и соскоба из уретры с помощью ПЦР, УЗИ мочевого пузыря.
 Эффективность лечения оценивали сразу после терапии, через 1, 3, 6 мес. от начала лечения. При этом учитывали клинические и лабораторные показатели.
Эффективность лечения оценивали сразу после терапии, через 1, 3, 6 мес. от начала лечения. При этом учитывали клинические и лабораторные показатели.
Результаты исследования были обработаны с использованием электронных таблиц Microsoft Excel из пакета программ Microsoft Office, 2007. Статистическую обработку данных проводили с использованием статистического пакета STATISTICA, 6.1 (StatSoftInc., США). Проведение расчетов и интерпретацию результатов осуществляли согласно руководству О. Ю. Ребровой. Оценку соответствия распределения признаков закону нормального распределения проводили с применением критерия Шапиро–Уилка. Корреляционную связь оценивали ранговым коэффициентом корреляции Спирмена. Для сравнения распространенности патологии в двух сравниваемых группах применяли критерий χ2. Числовые данные представлены значением медианы Me, первым и третьим квартилями в формате Me (Q1; Q3), бинарные показатели – абсолютным и относительным показателями в формате n (%). Различия числовых показателей оценивали с помощью критерия Манна–Уитни, различия в частотах признаков – путем точного двустороннего критерия Фишера.
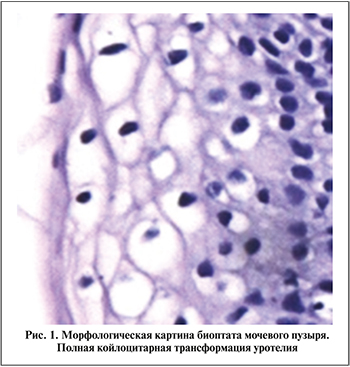
Результаты. По данным ПЦР-диагностики ПВИ в I группе была выявлена у 12 (54,5%) пациенток, во II – у 17 (70%). Диагноз цистита ПВ-этиологии подтверждали данными цитологического исследования мочи: наличием койлоцитов, характерных для ПВИ трансформированных клеток уротелия. Окончательный диагноз ХРЦ ПВ-этиологии устанавливали по результатам цистоскопии и морфологического исследования биоптатов мочевого пузыря, при котором у всех пациенток выявлена тотальная койлоцитарная трансформация уротелия, специфическая картина ПВ-поражения мочевого пузыря. Данная картина характеризовалась наличием увеличенных или анормальных размеров клеток уротелия, содержавших 1–2 (реже больше) ядра, окруженных большой, четкой перинуклеарной зоной просветления, или ореолом. Ореол представлял собой утолщенный периферический ободок цитоплазматической конденсации. Ядра чаще всего гиперхромные неправильной формы («изюмоподобные») (рис. 1).
 Оценка выраженности боли по ВАШ на фоне проводимой терапии выявила достоверные (p<0,05) различия между группами через 1 мес.: в I группе показатель снизился с 8 до 5 баллов, тогда как во II остался на прежнем уровне (рис. 2).
Оценка выраженности боли по ВАШ на фоне проводимой терапии выявила достоверные (p<0,05) различия между группами через 1 мес.: в I группе показатель снизился с 8 до 5 баллов, тогда как во II остался на прежнем уровне (рис. 2).
При оценке клинических симптомов сумма баллов по шкале Female Genitourinary Pain Index до лечения в I группе составила 38,0 (28,0; 43,0), во II – 38,0 (29,0; 41,0) (р=0,94), через 1 мес. после проведенной терапии – 19,0 (12,0; 2,09) и 35,0 (29,0; 9,5) соответственно (р=0,002), через 3 мес. –10,0 (6,0; 14,0) и 18,0 (13,0; 20,0) соответственно (р=0,007), через 6 – 6,0 (6,0; 8,0) и 10,0 (6,0; 12,0) соответственно (р=0,025).
Кроме того, отмечено снижение не только общей суммы баллов шкалы Female Genitourinary Pain Index, но и оценок по доменам боли, мочевых симптомов и качества жизни (табл. 1).
Таким образом, в I группе, в которой в составе комплексной терапии использовался Аллферон, уже через 1 мес. от начала лечения имело место достоверное снижение болевой симптоматики и СНМП, улучшение качества жизни пациенток по сравнению со II группой.
При оценке данных лабораторных исследований также отмечено достоверное снижение некоторых показателей. Так, через 1 мес. от начала терапии снижение уровня лейкоцитов в общем анализе мочи в группах было равноценным, однако интенсивность гематурии была ниже у пациенток I группы; через 3 мес. лейкоцитоурия более активно снижалась у пациенток I группы. Кроме того, на данном этапе исследования в I группе эритроциты не определялись, тогда как во II группе отмечено сохранение гематурии. Через 6 мес. в I группе показатели содержания лейкоцитов и эритроцитов соответствовали нормативным значениям, во II в единичных случаях сохранялась лейкоцитурия и эритроцитурия (табл. 2).
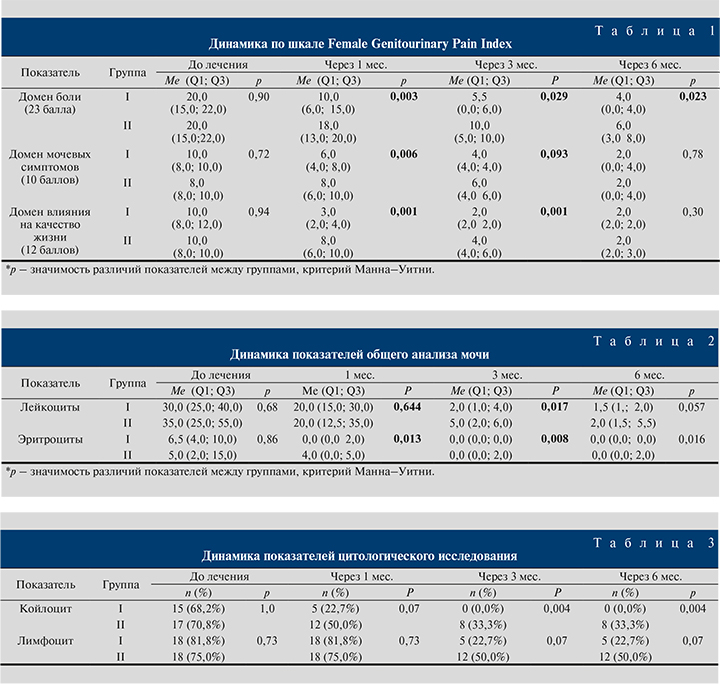
Анализ данных цитологического исследования мочи выявил снижение специфического признака папилломавирусного поражения мочевого пузыря – койлоцитоза: через 6 мес. от начала терапии в I группе койлоциты не выявлялись, тогда как во II койлоциты в моче выявлены у 8 (33,3%) пациенток (р=0,004) (табл. 3).
Кроме того, анализировали степень редукции инфекционно-воспалительного процесса, которую оценивали по наличию лейкоцитов (лимфоцитов и нейтрофилов) в моче: количество пациенток, у которых зарегистрированы данные показатели, было достоверно больше в II группе исследования.
О снижении степени интенсивности инфекционно-воспалительного процесса в мочевом пузыре и эффективности проведенной терапии можно также судить по толщине стенки мочевого пузыря. У пациенток I группы данный показатель после проведенной терапии достоверно отличался от такового у пациенток II группы. Так, до лечения толщина стенки мочевого пузыря у пациенток I и II групп была равна 7,0 (6,0; 7,0) мм (р=0,644), через 1 мес. после проведенной терапии в I группе она составила 5,0 (5,0; 6,0) мм, во II – 6,0 (6,0; 7,0) мм (р=0,010); через 3 мес. исследуемый показатель у пациенток I группы снизился до 4,0 (4,0; 5,0) мм, во II – до 5,0 (5,0; 6,0) (р=0,007), сохранившись на указанном уровне по прошествии 6 мес. (р=0,135).
Таким образом, на фоне комбинированной терапии у пациенток I группы по результатам УЗИ выявлена более активная редукция инфекционно-воспалительного процесса в мочевом пузыре.
Обсуждение. Хронический рецидивирующий цистит ПВ-этиологии представляет собой полисимптомное заболевание с выраженным болевым синдромом, существенно ухудшающим качество жизни пациенток. Характерной специфичной чертой ПВ-поражения мочевого пузыря является боль в преддверии влагалища, которая превалирует среди других локализаций: в I группе она отмечена у 21 (95,5%) женщины, во II – у 23 (95,8%).
При ПВИ мочевого пузыря, как правило, поражается треугольник Льето, что наблюдалось у подавляющего большинства пациенток исследуемых групп (табл. 4).

В треугольнике Льето расположены многочисленные нервные ганглии, рассеянные нейроны вегетативной нервной системы, чувствительные нервные окончания, которые, по-видимому, поражаются ПВИ. Клинически это проявляется выраженным болевым синдромом, локализующимся не только в надлонной области, но и в преддверии влагалища, в уретре [11].
Дисфункция иммунной системы играет ключевую роль в патогенезе развития ХРЦ ПВ-этиологии, при этом отмечается снижение показателей Т-клеточного звена иммунитета, иммунорегуляторного индекса (CD4/CD8), количества клеток Лангерганса, иммунного ответа цервикальных лимфоцитов, а также снижение функциональной активности натуральных киллеров (NK) и уровня основных сывороточных иммуноглобулинов. Клиническое течение ПВИ определяется степенью компетентности иммунной системы пациента. Ее активация приводит к прекращению дальнейшего развития вирусной инфекции и транзиторному присутствию вируса в организме, в то время как при неполноценности иммунной системы развивается вариант персистирующего течения латентной ПВИ [11, 12].
На основании вышесказанного одним из методов лечения ХРЦ ПВ-этиологии остается иммунотерапия [12–14]. К сожалению, в связи с многогранностью патогенеза папилломавирусного цистита при этом состоянии иммунотерапия проводится комбинацией нескольких иммуноактивных препаратов.
Очень важно применение именно тех иммуноактивных препаратов, которые воздействовали бы на все звенья патогенеза ПВ цистита, в связи с этим весьма ценны свойства Аллоферона. Препарат регулирует проведение возбуждения через клетки и нервы гладкой мускулатуры, при этом происходит стимулирование передачи нервно-мышечных импульсов, нарушенных ввиду блокады калиевых каналов ПВИ. Кроме того, усиливается воздействие гистамина, окситоцина, ацетилхолина и серотонина на гладкую мускулатуру, т.е. оказывается мощное антипролиферативное воздействие как уротелиальных, так и нервных структур; при этом возможно снижение болевого синдрома, обусловленного ПВ-поражением [15]. Эти данные коррелируют с нашими результатами: включение аллокина-альфа в комплексную терапию ХРЦ ПВ-этиологии приводило к более активной редукции инфекционно-воспалительного процесса в стенке мочевого пузыря: уже через 1 мес. от начала терапии отмечено достоверное снижение клинической симптоматики и лабораторных показателей (р<0,005).
Заключение. Применение Аллоферона (Аллокина-альфа) в комплексной терапии пациенток с ХРЦ ПВ-этиологии улучшало клинические и лабораторные показатели уже через 1 мес. после начатой терапии, при этом несомненным достоинством препарата считается быстрое снижение боли, что обеспечивает повышение качества жизни, а также улучшение лабораторных показателей.



