Введение. Цистит, инфекционное воспаление слизистой мочевого пузыря, относится к наиболее распространенным заболеваниям человека [1]. У женщин частота инфекций нижних мочевыводящих путей (ИНМП) значительно, более чем в 10 раз, выше, чем у мужчин, что связано с анатомическими, физиологическими и гормональными особенностями женского организма [2, 3]. Результаты эпидемиологических исследований свидетельствуют, что хотя бы 1 раз в течение жизни острый цистит переносят по крайней мере 50–60% женщин [1, 4]. Пик заболеваемости ИНМП у женщин приходится на возраст от 25 до 35 лет, а также постменопаузальный период [2, 5]. После впервые перенесенного острого цистита в течение года, а по некоторым данным и в течение полугода, у 20–40% женщин отмечается повторный эпизод заболевания с последующим развитием рецидивирующей формы ИНМП [4, 5]. Последнюю диагностируют при выявлении не менее трех эпизодов ИНМП в течение 12 мес. или двух эпизодов в течение последних 6 мес. [4, 6]. Рецидивирующие ИНМП существенно ухудшают качество жизни больных, негативно влияя на все ее аспекты: социальные, семейные, сексуальные [7].
Основными возбудителями ИНМП являются микроорганизмы семейства Enterobacteriaceae, причем среди всех уропатогенов доля Escherichia coli составляет 70–80% [8].
В связи с этим закономерно, что для профилактики рецидивов ИНМП наибольшее распространение получили антибактериальные препараты [4, 9–11]. Рекомендуемая длительность их назначения варьировалась в широких пределах [6]. Эффективность антибактериальной профилактики ИНМП доказана результатами многочисленных исследований, однако после окончания приема противомикробных препаратов у значительного числа женщин снова возникал рецидив заболевания. В современных клинических рекомендациях по лечению ИНМП антибактериальная профилактика оправдана только в том случае, если исчерпаны все возможные варианты без применения антибиотиков. Кроме того, проведение антибактериальной профилактики ИНМП ограничивает все более увеличивающаяся антибиотикорезистентность уропатогенов. Последняя признана общемировой проблемой, в связи с чем Всемирная организация здравоохранения в опубликованном в 2015 г. Глобальном плане действий по устойчивости к противомикробным препаратам рекомендует максимально ограничить их применение. Неудивительно, что в последние годы резко возрос интерес к альтернативным направлениям лечения и профилактики рецидивирующей ИНМП [12–15]. Изучаются или уже нашли применение в широкой клинической практике поведенческая, иммуно- и фитотерапия, назначение пре- и пробиотиков, пре- и посткоитальная профилактика с использование неантибактериальных препаратов [14–18].
Одним из наиболее перспективных направлений профилактики ИНМП является применение с лечебной целью субстанций, обладающих антиадгезивными свойствами, среди которых важное место занимает D-манноза [5, 19, 20]. Клиническое значение D-маннозы при лечении ИНМП изучают уже более 40 лет. В 1979 г. группа израильских микробиологов под руководством проф. M. Аронсона в эксперименте впервые продемонстрировала способность D-маннозы защищать мочевыводящие пути от инфицирования. Было установлено, что при высокой концентрации D-маннозы в моче частота возникновения ИНМП снижается на 67% [21]. Эти исследования положили начало разработке антиадгезивной стратегии лечения и профилактики ИНМП [15].
Полученные к настоящему времени экспериментальные и клинические данные подтвердили наличие антиадгезивного эффекта D-маннозы в отношении кишечной палочки и других уропатогенов [22–26]. R. Kyriakides et al. (2020) опубликовали результаты систематического обзора исследований с участием 695 человек, посвященных изучению эффективности D-маннозы в профилактике ИНМП. Авторы сделали вывод, согласно которому лекарственные средства, содержащие D-маннозу, достоверно по сравнению с плацебо снижают частоту рецидивов и увеличивают безрецидивный период заболевания [5]. Эти данные были подтверждены результатами другого систематического обзора применения D-маннозы при ИНМП, проведенного S.M. Lenger et al. (2020). Было показано, что протекторные свойства D-маннозы превышают плацебо и сравнимы с антибактериальными препаратами, а ее переносимость значительно лучше, чем у противомикробных средств. При этом авторы обзора подчеркнули, что данное заключение основано на результатах исследований разного дизайна и качества, а также небольшой суммарной выборке больных [27].
D-манноза является моносахаридом, быстро всасывающимся после перорального приема. По крайней мере 90% экзогенной D-маннозы абсорбируется в верхних отделах кишечника. Основной объем D-маннозы выводится в неизмененном виде с мочой в течение 30–60 мин, а оставшаяся часть экскретируется в течение последующих 8 ч [28].
В основе терапевтического действия D-маннозы при ИНМП лежит ее способность ингибировать адгезию уропатогенных бактерий к слизистой мочевого пузыря. Известно, что адгезия микроорганизмов к уротелиоцитам обеспечивается специфическими органеллами бактериальной стенки – фимбриями типа 1. Последние выявляют у 90% уропатогенных штаммов Escherichia coli, а также у других членов семейства Enterobacteriaceae, включая Klebsiella pneumoniae, Shigella flexneri, Salmonella typhimurium, Serratia marcescens и Enterobacter cloacae, многие из которых служат возбудителем рецидивирующих ИНМП [27, 29]. Находящиеся на фимбриях типа 1 факторы адгезии FimH обеспечивают связывание бактерий с маннозилированными мембранными белками (уроплакином 1а и др.) на поверхности эпителиальных зонтичных клеток мочевыводящих путей [30]. В дальнейшем микроорганизм проникает внутрь уротелиоцита, что предохраняет его от выведения наружу с мочой. В уротелии бактерии быстро размножаются и образуют сообщества в виде внутриклеточных резервуаров. Полагают, что именно наличие внутриклеточных бактериальных сообществ в уротелиальных клетках служит основным патогенетическим фактором рецидивирования ИНМП [20, 30]. Таким образом, наличие маннозосодержащих субстанций на поверхности уротелиоцита и тропность к ним адгезина FimH рассматривают в качестве важных факторов адгезии и последующей внутриклеточной инвазии уропатогенов. Однако маннозочувствительные субстанции уропатогенов тропны не только к маннозе структур клеточной стенке, но и к свободной D-маннозе, содержащейся в моче. При достаточно высокой концентрации D-маннозы в моче она может «занять» все маннозочувствительные зоны адгезинов бактерий и тем самым сделать невозможным их прикрепление к уротелиоциту. В последующем неприкрепленные уропатогены легко удаляются из мочевого пузыря с током мочи.
Механизм действия D-маннозы в данном случае можно охарактеризовать как антиадгезивный, а непосредственно вещество – как конкурентный блокатор бактериальной адгезии. Подтверждением данной концепции служит выявление дозозависимости эффекта D-маннозы in vitro. E.K. Michaels et al. [23] в эксперименте продемонстрировали, что степень снижения уровня бактериурии зависит от концентрации D-маннозы в моче. Вероятно, дозозависимость лечебного действия D-маннозы будет проявляться и в клинической практике, однако к настоящему времени доказательств ее наличия не представлено. Исходя из механизма действия D-маннозы можно предположить, что данный эффект имеет свои пределы – при связывании всех маннозочувствительных уропатогенов доменом дальнейшее увеличение содержания D-маннозы в моче не будет сопровождаться усилением клинического эффекта.
Несмотря на то что механизм лечебного действия входящей D-маннозы у больных рецидивирующими ИНМП хорошо изучен, клинических исследований в данном направлении недостаточно.
Наиболее обширно исследование B. Kranjčec et al. (2014), посвещенное оценке эффективности D-маннозы в профилактике рецидивов ИНМП [24]. После инициального антибактериального лечения острого неосложненного цистита 308 женщин были разделены на три группы. Пациентам первых двух групп назначали соответственно 2 г D-маннозы или 50 мг нитрофурантоина в сутки. Больные 3-й группы профилактического лечения не получали. Продолжительность лечения составляла 6 мес., в течение которых рецидивы ИНМП были отмечены у 14,6% пациентов, получавших D-маннозу, 20,4% – принимавших нитрофурантоин и у 60,8% пациентов, которым профилактику не проводили.
В другом исследовании, посвященном данной проблеме, D. Porru et al. (2014) сравнивали эффективность применения D-маннозы и триметоприма/сульфаметоксазола. Антибактериальный препарат назначали по 600 мг в сутки в течение 1 нед. в месяц на протяжении 6 мес., D-маннозу по 1 г 3 раза в сутки первые 2 нед., затем по 1 г дважды в сутки в течение следующих 22 нед. [25]. Пациенты находились под наблюдением еще 6 мес. после окончания терапии. Среднее время до развития рецидива ИНМП составило 200 дней у больных, принимавших D-маннозу, и 52,7 дня – принимавших противомикробный препарат (р<0,0001). В исследовании L. Domenici et al. [26] после начального лечения острого цистита пациенты были рандомизированы на две группы. Больные основной группы принимали D-маннозу каждый месяц в течение 7 дней по 1,5 г в сутки в течение 6 мес. Пациенты контрольной группы лечения не получали. У больных основной группы частота рецидивов за период наблюдения составила 4,5% по сравнению с 33,3% в контрольной группе.
В исследовании А. В. Кузьменко и соавт. (2019) [22] показано, что добавление в комплексную терапию неосложненной ИНМП D-маннозы способствует увеличению длительности межрецидивного периода. Под наблюдением были 60 женщин с острым неосложненным циститом, разделенных на две группы. Пациентам 1-й группы назначали антибактериальную терапию, больным 2-й группы антибактериальную терапию дополняли назначением Экоцистина, в состав которого входили D-манноза и инулин, по 1 саше-пакету в день в течение 6 мес. В ходе наблюдения рецидивы ИНМП были выявлены у 7 (23,3%) больных 1-й группы и только у 1 (3,3%) – 2-й.
Различие в частоте рецидивов ИНМП в разных исследованиях связаны, по нашему мнению, с существенно различающейся их методологией, в частности, критериями включения и оценки рецидивов, характером терапии и режимом дозирования препаратов. Так, в ряде исследований рецидив ИНМП регистрировали только при выявлении при бактериологическом исследовании мочи уропатогенов в титре более 105 КОЕ/мл, в других в исследование включали женщин после перенесенного первого эпизода ИНМП. Немаловажно также отметить различие в выборке пациентов в разных исследованиях, они отличались по возрасту, сексуальной активности, менопаузальному статусу, анамнестическим данным и т.д.
Из-за особенностей механизма действия D-маннозы отсутствует риск развития к ней бактериальной устойчивости [20]. Прием D-маннозы не влияет на жизнеспособность, форму или подвижность бактерий, не приводит к мутациям FimH, модифицирующим бактериальную адгезивность, а также не снижает активности антибиотиков [31].
Интересно, что ряд авторов в последние годы предлагают не рассматривать антиадгезивный эффект D-маннозы в качестве фармакологического, поскольку он не сопровождается прямым воздействием на макро- или микроорганизм [32]. Свою позицию они аргументируют тем, что участки фимбрий, с которыми связывается D-манноза, не являются рецепторами, поскольку не способны распознавать эндогенные химические сигналы или отвечать на них. Возможно, в будущем антиадгезивное действие D-маннозы будет выделено в отдельное направление лечения ИНМП – везикопротекторную терапию, находящуюся на стыке фармакотерапии и физических методов лечения.
В настоящем исследовании проведена оценка эффективности назначения для профилактики рецидивов ИНМП у женщин биологически активной добавки (БАД) Экоцистин. Помимо D-маннозы в состав Экоцистина входит обладающий пребиотическими свойствами инулин, что также весьма важно для больных рецидивирующими ИНМП. Кишечник, влагалище и мочевой пузырь можно рассматривать как «трифект» анатомических участков, играющих роль в патогенезе ИНМП. При этом резидентная микробиота либо служит потенциальным резервуаром уропатогенных бактерий, либо, наоборот, является защитой макроорганизма от них [33]. Кишечные бактерии переваривают инулин и продуцируют короткоцепочечные жирные кислоты. Последние оказывают благотворное влияние на нормальную микрофлору, стимулируя рост и размножение полезных кишечных бактерий, таких как Lactobacillus и Bifidobacterium, усиливают местный иммунный ответ, снижают pH толстой кишки, оказывают противовоспалительный эффект [34].
Несмотря на достаточно длительный период изучения клинической эффективности D-маннозы у пациентов с ИНМП, число проведенных исследований относительно невелико. Остаются неясными многие вопросы, относящиеся к продолжительности лечения, режиму дозирования, возможности применения D-маннозы с другими лекарственными препаратами, выявлению факторов, снижающих эффективность терапии. Получение на них ответов и стало основной задачей настоящего исследования.
Цель исследования: оценить эффективность применения БАД Экоцистин, содержащей D-маннозу и инулин, для профилактики рецидивов ИНМП у женщин.
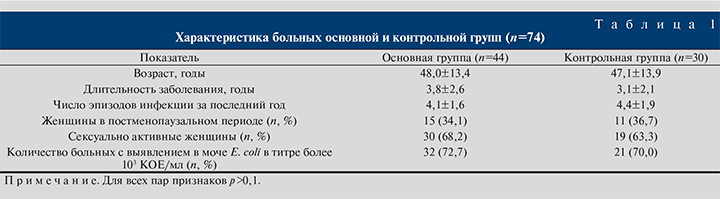
Материалы и методы. Под наблюдением находились 74 женщины в возрасте от 21 до 75 лет (в среднем 47,4±13,6 года) с рецидивирующей ИНМП. Данный диагноз устанавливали в соответствии с критериями, указанными в отечественных клинических рекомендациях: не менее 3 рецидивов в течение года или не менее 2 рецидивов в течение последнего полугодия [4]. Длительность заболевания варьировалась от 1 года до 12 лет и в среднем составляла 3,5±2,4 года. Среднее число рецидивов ИНМП за последний до включения в исследование год у наблюдаемых нами больных равнялось 4,2±1,7.
В настоящее исследование включали женщин 18 лет и старше с рецидивирующей ИНМП, давностью заболевания не менее года и у которых на момент обращения выявлено обострение цистита. Последнее диагностировали на основании жалоб и клинической картины заболевания, а также результатов общего анализа мочи (выявлении более 10 лейкоцитов в 1 мкл мочи). Все больные подписали информированное согласие на участие в исследовании.
Мы не включали в исследование больных с осложненной инфекцией мочевыводящих путей (нарушением оттока мочи из мочевого пузыря, наличием конкрементов в мочевыводящих путях, аномалиями мочевой системы, нейрогенными расстройства мочеиспускания и др.), острой или активной фазой хронического пиелонефрита, беременных или находящихся в периоде лактации, пациентов с полиурией, тяжелыми сопутствовавшими соматическими заболеваниями, ранее применявших в лечебных целях компоненты Экоцистина (D-маннозу или инулин), а также при индивидуальной непереносимости фосфомицина.
Всем наблюдаемым больным на этапе скрининга проведено общеурологическое обследование, которое включило оценку анамнеза заболевания и жалоб, физикальное обследование, лабораторные исследования, в том числе бактериологическое исследование средней порции утренней мочи. Последнее позволяло выделять и идентифицировать возбудитель ИНМП, определять его титр (степень бактериурии) и чувствительность к антимикробным препаратам. Всем женщинам для выявления инфекций, передаваемых половым путем, выполняли ПЦР-диагностику в соскобах из уретры, влагалища и шейки матки. Больных включали в исследование только после проведения соответствующей терапии указанных выше инфекций и получения отрицательного результата ПЦР-теста. В комплекс инициального обследования входило также ультразвуковое исследование мочевого пузыря с определением количества остаточной мочи.
Поскольку в исследование включали больных с обострением ИНМП, всем 74 пациентам до начала его основного этапа проводили лечение острого цистита. С этой целью назначали антибактериальный препарат фосфомицина трометамол в дозе 3,0 г однократно, что соответствует отечественным клиническим рекомендациям по лечению неосложненной ИНМП у женщин [4]. Общая продолжительность наблюдения за одной больной в рамках исследования составляла 6 мес.
Методом случайной выборки все больные были разделены на 2 группы: основную (n=44) и контрольную (n=30). Пациенты обеих групп были сопоставимымм по возрасту, основным анамнестическим показателям и клиническим проявлениям заболевания (табл. 1).
Больным основной группы назначали Экоцистин по 1 саше-пакету, содержавшему 1,5 г D-маннозы и 1,5 г инулина, 2 раза в сутки в течение первых 3 сут., а затем по 1 саше-пакету 1 раз в сутки в течение 6 мес. Больным контрольной группы Экоцистин не назначали. Пациентам рекомендовали принимать Экоцистин во время еды непосредственно после приготовления жидкой лекарственной формы, для чего содержимое 1 саше-пакета необходимо было растворять в 100 мл воды. Женщинам контрольной группы после окончания инициальной антибактериальной терапии Экоцистин не назначали.
Включенным в исследование больным на весь период наблюдения было рекомендовано придерживаться определенного образа жизни: употреблять питьевую воду не менее 2 л в сутки, соблюдать режим мочеиспускания – интервалы между мочеиспусканиями не должны были превышать 3,5 ч, избегать приема острой и чрезмерно соленой пищи, проводить необходимые гигиенические процедуры, препятствующие контаминации мочевыводящих путей уропатогенами.
Контрольное обследование пациентов проводили через 3 дня от начала лечения и далее через 3 и 6 мес. Пациенты обеих групп были инструктированы в случае возникновения симптомов цистита связаться с исследовательской командой и явиться на внеочередной визит для обследования. При подтверждении наличия рецидива ИНМП больным назначали фосфомицина трометамол 3,0 г однократно, при этом больные основной группы продолжали прием Экоцистина.
Оценку характера клинического течения ИНМП больным основной и контрольной групп проводили по следующим показателям:
1) частоте рецидивов ИНМП;
2) среднему времени до развития первого рецидива ИНМП;
3) выраженности симптоматики цистита при возникновении рецидива. Данный показатель оценивали на основании результатов заполнения больными 10-балльной визуальной аналоговой шкалы (ВАШ-10), где 0 баллов – отсутствие симптоматики, 10 – крайне тяжелая симптоматика.
4) длительности рецидива ИНМП.
Статистический анализ полученных результатов проводили с помощью компьютерной программы STATISTICA, 10 En (StatSoft, Inc.) с использованием t-критерия, χ2-критерия Пирсона, точного метода Фишера (F-тест). Различия считали достоверными при уровне значимости р<0,05. Средние значения показателей в тексте указывали со средним квадратическим отклонением (M±σ).
Результаты. При первичном обследовании у всех включенных в исследование женщин выявлено обострение ИНМП, подтвержденное клинически и лабораторно. Результаты бактериологического исследования мочи, выполненного до начала лечения, позволило выявить бактериурию в титре ≥1000 КОЕ/мл у 67 (90,5%) больных. Из них у 53 (79,1%) пациентов преобладающим микроорганизмом была Escherichia coli, у 6 (9%) – Klebsiella pneumoniae, у 5 (7,4%) – Enterococcus faecalis, у 2 (3%) – Staphylococcus aureus и у 1 (1,5%) – Proteus mirabilis. У 6 (9%) больных выделено два вида микроорганизмов. По результатам антибиотикограммы фосфомицин был активен в отношении всех обнаруженных при бактериологическом исследовании уропатогенов.
На 3-й день после приема фосфомицина у 73 женщин отсутствовали клинические и лабораторные признаки ИНМП, у 1 больной, распределенной в контрольную группу, сохранялась лейкоцитурия и дизурия. Пациентка была выведена из исследования для проведения дополнительной терапии.
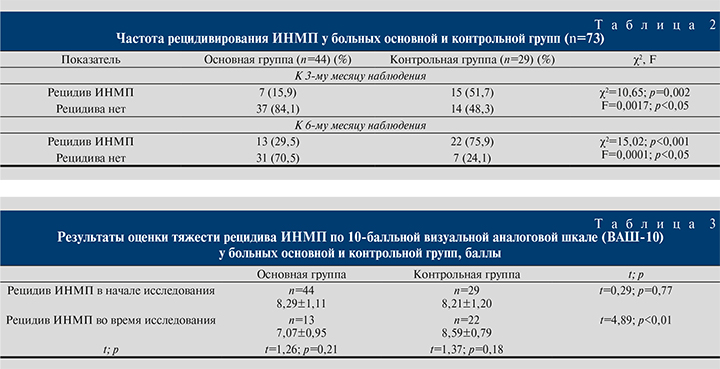
При динамическом наблюдении в течение 3 мес. рецидивы ИНМП зарегистрированы у 15 (51,7%) больных контрольной и только у 7 (15,9%) пациентов основной группы. К 6-му месяцу наблюдения рецидивы отмечены соответственно у 22 (75,9%) и 13 (29,5%) пациентов (табл. 2). Различия в частоте рецидивирования ИНМП к 3-му и 6-му месяцам наблюдения у больных основной и контрольной групп оказались статистически достоверными.
Важным показателем клинического течения ИНМП является длительность интервалов между рецидивами заболевания. В настоящем исследовании мы оценивали временной промежуток от начала исследования до возникновения первого рецидива. При промежуточном анализе полученных данных через 3 мес. от начала наблюдения отмечены не только меньшая в 3,3 раза частота развития рецидива у больных основной группы по сравнению с контролем, но и значительно больший промежуток времени до развития рецидива у пациентов в группе лечения. Так, у 7 больных основной группы рецидив ИНМП развился в среднем через 43,4±14,3 дня от начала наблюдения, в то время как у 15 больных контрольной группы с развившимся циститом этот показатель оказался в 1,5 раза меньше и был равен 28,2±13,5 дней (различие статистически достоверно (t=2,40; p=0,026)). В интервале от 3 до 6 мес. с начала исследования первый рецидив ИНМП возник еще у 6 больных основной и у 7 пациентов контрольной групп. Среднее время до развития первого рецидива за весь период наблюдения у больных основной группы оказалось в 1,7 раза больше, чем в контрольной, и составило соответственно 80,1±46,3 и 50,5±40,2 дня (t=1,92; p=0,064).
Помимо оценки общей частоты и времени возникновения рецидивов ИНМП весьма важным представляется изучение тяжести и длительности непосредственно самого обострения заболевания. Отметим, что при развитии рецидива пациенты получали антибактериальную терапию (фосфомицина трометамол 3.0 г однократно) и продолжали участвовать в исследовании. Больные основной группы при обострении цистита прием Экоцистина не прекращали.
В табл. 3 представлены результаты оценки тяжести обострений рецидивирующего цистита у больных основной и контрольной групп до начала лечения и во время исследования. Тяжесть симптоматики инициального обострения ИНМП не различалась у больных основной и контрольной групп. Также не выявлено различий между выраженностью симптомов инициального цистита и рецидивов в процессе наблюдения в контрольной группе. В то же время отмечено статистически значимое различие в тяжести симптоматики рецидивов ИНМП у больных основной и контрольной групп. Больные основной группы субъективно оценивали тяжесть рецидива в среднем на 7,07±0,95 балла, пациенты контрольной группы – 8,59±0,79 (t=4,89; p<0,01). Подобная тенденция отмечена и при оценке длительности рецидивов: в основной группе она составила в среднем 1,92±0,76 дня, в контрольной – 2,90±0,61, различие статистически достоверно (t=3,97; p<0,001). Установлено также, что продолжительность рецидивов в основной группе была значимо (на 33,8%) меньше, чем длительность инициального обострения цистита в начале исследования (t=2,96; p=0,005) (табл. 4).

Переносимость Экоцистина была удовлетворительной: ни у одной больной мы не отметили нежелательных явлений, которые можно было бы связать с его назначением.
Обсуждение. Полученные в настоящем исследовании данные свидетельствуют о высокой эффективности профилактического назначения Экоцистина больным с рецидивирующей ИНМП. При приеме Экоцистина достоверно реже развивались рецидивы ИНМП, их выраженность и продолжительность были меньше, а интервалы между рецидивами больше по сравнению с больными контрольной группы. Частота развития рецидивов ИНМП у женщин, принимавших Экоцистин, к 3-му месяцу оказалась более чем в 3 раза (15,9% vs 51,7%), через 6 мес. более, чем в 2,5 раза (29,5% vs 75,9%) меньше по сравнению с больными контрольной группы. Различие в частоте рецидивов оказалось статистически значимо, причем изначально пациенты основной и контрольной групп были сопоставимыми по всем демографическим, анамнестическим и клиническим показателям. Необходимо подчеркнуть, что наблюдаемые нами больные основной группы имели в среднем 4,1±1,6 эпизода ИНМП за последний до включения в исследование год. При этом за 6-месячный период наблюдения у 70,5% пациентов, принимавших Экоцистин, не зарегистрировано ни одного эпизода цистита. Весьма важным представляется тот факт, что даже при развитии рецидива у больных основной группы его тяжесть и длительность были достоверно меньшими, чем в контрольной группе.
Результаты выполненного исследования продемонстрировали также хорошую переносимость и высокий профиль безопасности Экоцистина. В систематическом обзоре S. M. Lenger et al. (2020) [27] сообщается о случаях появлении диареи в связи с приемом D-маннозы. В нашем исследовании мы не зарегистрировали ее ни у одной наблюдаемой больной. Возможно, отсутствие нежелательных явлений со стороны желудочно-кишечного тракта связано с наличием в составе Экоцистина помимо D-маннозы органического полисахарида инулина – источника пищевых волокон и обладающего пребиотическими свойствами.
Входяшие в состав Экоцистина D-маннозу и инулин можно назначать пациентам с сопутствующими заболеваниями, в частности с сахарным диабетом, гипертонической болезнью, неврологическими расстройствами, а также беременным [35].
Заключение. Результаты исследования показали снижение частоты развития рецидивов ИНМП у женщин, принимавших Экоцистин по схеме по 3,0 г 2 раза в сутки в течение первых 3 дней, а затем по 3,0 г 1 раз в сутки – в 3,3 раза в течение 3 и в 2,5 раза в течение 6 мес. от начала лечения по сравнению с контролем. Таким образом, применение БАД Экоцистин, в состав которой входят D-манноза и инулин, по 1 саше-пакету 2 раза в сутки в течение первых 3 сут., а затем по 1 саше-пакету 1 раз в сутки в течение 6 мес., – эффективный и хорошо переносимый метод профилактики обострений цистита у женщин с рецидивирующей ИНМП. Назначение Экоцистина представляется патогенетически обоснованной альтернативой использованию антибиотиков данной категорией больных.



