Введение. Исследования последних лет показывают, что наиболее проблемными являются нозокомиальные инфекции мочевыводящих путей (ИМП) [1–4]. С каждым годом увеличивается резистентность штаммов микроорганизмов у мужчин и женщин всех возрастов, что отражено в работах последних лет, выполненных в разных регионах мира [1–4]. На сегодняшний день практически не осталось ни одного антибиотика, к которому были бы чувствительны все внутрибольничные инфекции. Данная проблема обусловливает необходимость индивидуального подхода к подбору антибиотикотерапии не только для каждого региона, но и для каждого пациента в отдельности. Проблема эффективной профилактики и лечения ИМП как в амбулаторной, так и в стационарной практике до сих пор остается актуальной в связи со сложным патогенезом заболевания, неуклонным ростом числа резистентных штаммов микроорганизмов, имеющейся тенденцией к развитию тяжелых гнойно-септических осложнений и сепсиса у урологических больных [1–6]. Большинство эмпирически используемых в настоящее время антибиотиков нельзя назвать эффективными в лечении ИМП, так как часто в популяции персистируют резистентные штаммы микроорганизмов. Это объясняет не только медицинскую, но и социально-экономическую значимость проблемы, что требует использования современных высокоэффективных и дорогостоящих препаратов [5–8]. Исследования последних лет, проведенные в России, выявили высокую устойчивость E. сoli к ранним пенициллинам и ко-тримаксозолу, низкую резистентность к фторхинолонам, нитрофуранам и цефалоспоринам [4, 8, 9]. Резистентность микроорганизмов, вызывающих ИМП, требует постоянного мониторинга, поскольку различается в разных регионах мира [1–6, 9–13]. У пациентов с осложненными ИМП частота выделения резистентных штаммов выше, чем у пациентов с неосложненными ИМП, также имеются и географические различия [1–3, 7, 10–13].
Целью данного исследования было уточнить этиологию нозокомиальных ИМП, встречающихся в урологических отделениях и поликлинике ОБУЗ «Ивановская областная клиническая больница» (ИвОКБ), сформулировать рекомендации по эмпирическому назначению антибактериальных препаратов.
Материалы и методы. Проведено бактериологическое исследование мочи пациентов, получавших лечение в связи с ИМП в детском, взрослом урологических отделениях и в поликлинике ИвОКБ. Материалом исследования служила средняя порция утренней свободно выпущенной мочи, полученная после туалета наружных половых органов, либо моча, собранная катетером. Мочу собирали в стерильные одноразовые контейнеры и доставляли в бактериологическую лабораторию в течение не более 2 ч с момента забора.
Процедуру посева на питательные среды, выделение и идентификацию чистых культур, определение чувствительности микроорганизмов к антибиотикам в лаборатории ИвОКБ проводили в соответствии с регламентирующими нормативными документами по стандартным методикам [14–18]. Чувствительность бактерий к антибиотикам определяли с помощью диско-диффузионного метода по Keurby–Bauer. Метод разработан (Версия 4.0, июнь 2014 г.) на основании The European Committee on Antimicrobial Susceptibility Testing (EUCAST) по оценке антимикробной чувствительности [8, 16, 18]. Для определения чувствительности микроорганизмов использовали агар Мюллера–Хинтона и среду АГВ. Агаровая среда Мюллера–Хинтона представляет собой стандартную питательную среду, соответствующую общепринятым стандартам, предлагаемым Европейским комитетом по определению чувствительности к антимикробным препаратам EUCAST [8, 16, 18]. Агар Мюллера–Хинтона выпускается микробиологическими фирмами-производителями (ЗАО НИЦФ, Россия) в сухом виде для приготовления среды в лабораторных условиях. Питательная среда АГВ (ФГУП «НПО» «Микроген», Россия) предназначена для определения чувствительности к антибиотикам микроорганизмов, выделенных из патологического материала больных «методом дисков».
В нашей лаборатории использовались диски с антибиотиками фирмы ЗАО НИЦФ (Россия) в стандартной упаковке с 50 дисками или в стандартной таре, содержащей 10 упаковок. При измерении зон задержки роста ориентировались на полное подавление видимого роста. Крупные колонии, выявляемые в пределах четкой зоны ингибирования роста, свидетельствовали о наличии посторонней микрофлоры или о гетерорезистентности популяции, в этом случае была необходима повторная идентификация и повторение исследования на антибиотикорезистентность. Поскольку диаметр зоны подавления роста исследуемого микроорганизма, получаемый при постановке диско-диффузионного метода, в определенных пределах жестко связан с величиной МПК антибиотика, каждому пороговому значению МПК соответствует определенная пороговая величина диаметра зоны ингибирования роста.
Для интерпретации полученных результатов использовали таблицы, в которых приведены пограничные значения зон ингибирования роста, позволяющие отнести исследуемую культуру микроорганизма к одной из трех категорий: чувствительный, промежуточный, устойчивый [15]. При отнесении штамма к категории «чувствительный» предполагалось, что лечение соответствующим антибиотиком в обычных терапевтических дозах будет скорее всего успешным. В случае определения штамма как соответствующего категории «промежуточный» предполагалось, что терапия соответствующим антибиотиком может быть успешной лишь при использовании повышенных доз препарата или при локализации инфекции в тех локусах человеческого организма, где антибиотик способен концентрироваться в силу его фармакокинетических особенностей. При отнесении штамма к категории «резистентный» предполагалось, что соответствующий антибиотик даже в повышенных дозах будет скорее всего неэффективным. В нашем исследовании мы отобразили только резистентные к антибиотикам штаммы. «Промежуточные» штаммы мы отнесли к категории чувствительных к антимикробным препаратам.
Для анализа результатов использован стандартный пакет прикладных статистических программ Statistica 10.0 (Dell Technologies Inc., США). Для оценки статистической значимости различий использовался t-критерий Стьюдента и χ2-критерий Пирсона. Различия считали статистически значимыми при p<0,05.
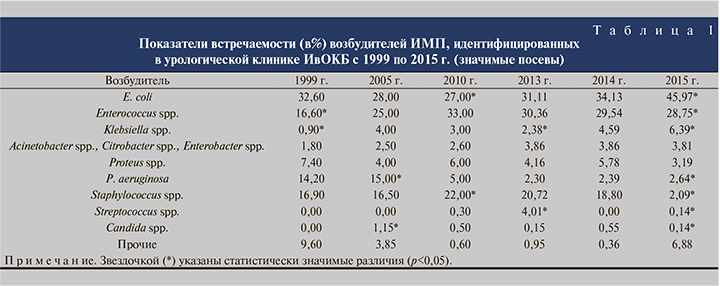
Результаты и обсуждение. Ранее мы проводили анализ частоты выявлемости ИМП с 1999 по 2005 г. [10]. Полученные данные позволяют представить весь спектр возбудителей ИМП в урологической клинике ИвОКБ, так как они основаны на репрезентативном материале: 1224 случая – за 2005 г., 1347 – за 2013 г., 1090 – за 2014 г. и 1325 – за 2015 г. В дальнейшем анализ проводился по количеству выявленных значимых штаммов, т.е. 105 и более КОЭ/мл, а не по количеству пациентов.
За последние 10 лет отмечается статистически значимое снижение частоты выявляемости ассоциаций микроорганизмов в 3 раза: так, в 2005 г. в 60% бактериологических посевов микроорганизмы находились в ассоциациях в виде двух или трех возбудителей, в 2015 г. – только в 20% (p<0,05). В основном встречались ассоциации E. coli и Enterococcus spp., Enterococcus spp. и P. аeruginosa, E. coli и P. aeruginosa. В структуре ИМП за 2015 г. одновременно два микроорганизма выявлены у 112 (18,9%) пациентов, а ассоциация из трех микроорганизмов – у 7 (1,1%). По сравнению с предыдущими годами в 2015 г. в урологической клинике ИвОКБ E. coli и Enterococcus spp. сохраняли лидирующие позиции в структуре высеянных микроорганизмов, при этом в последние годы отмечается увеличение выявляемости E. coli (табл. 1). Также обращает на себя внимание резкое снижение доли Staphylococcus spp. в 2015 г. по сравнению с данными ранее проведенных исследований (табл. 1).
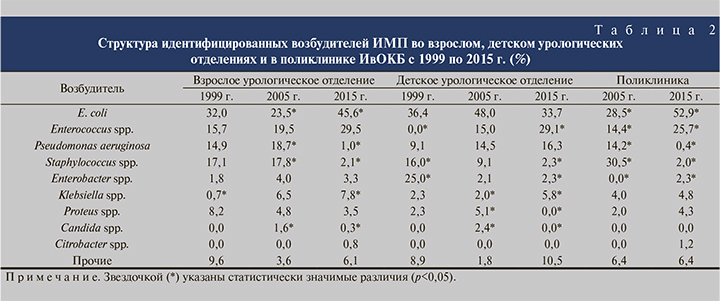
По результатам сравнительного анализа структуры возбудителей ИМП выявлено, что во взрослом урологическом отделении в 2015 г. по сравнению с 2005 г. повысилась частота выявления E. coli и Klebsiella spp. (p<0,05; табл. 2). Нельзя не отметить увеличение выявляемости и других грамотрицательных бактерий. В то же время имели место тенденция к снижению выявляемости Candida spp. (p<0,05), резкое снижение высеваемости P. aeruginosa (p<0,05) и Staphylococcus spp. (p<0,05).
В детском отделении отмечено статистически значимое увеличение частоты выявляемости Enterococcus spp. и Klebsiella spp. (p<0,05) и снижение выявляемости Enterobacter spp., Proteus spp., Staphylococcus spp. и Candida spp. (p<0,05, см. табл. 2).
В 1999 г. оценка результатов посева мочи в поликлиническом звене не проводилась. В в 2015 г. по сравнению с 2005 г. в этом структурном подразделении наблюдалось повышение выявляемости E. сoli и Enterococcus spp. и Enterobacter spp. (p<0,05), резкое снижение частоты выявления P. aeruginosa и Staphylococcus spp. (p<0,05). Высокая высеваемость P. aeruginosa в поликлинике ИвОКБ до 2005 г., вероятно, связана с прохождением амбулаторного лечения пациентов, которые ранее лечились в урологическом стационаре. С 2010 по 2015 г. четко прослеживается резкое снижение выявляемости P. aeruginosa (табл. 1), что, по нашему мнению, связано с заменой в стационаре в промывных системах фурацилина на хлоргексидин. В детском урологическом отделении пациентам редко требуются промывные системы; детей чаще оперируют по поводу врожденных аномалий развития мочеполовой системы, что требует более длительного стояния дренажа. Кроме того, в детской урологической практике не применяются фторхинолоны, поэтому показатели выявляемости P. аeruginosa в отличие от взрослого отделения и поликлиники сохраняются на высоком уровне (табл. 2). Снижение количества Staphylococcus spp. как в урологических отделениях, так и в поликлинике мы связываем с широким применением как в стационаре, так и в амбулаторной практике поздних фторхинолонов и защищенных пенициллинов, таких как амоксициллин/клавуланат, как у детей, так и у взрослых (табл. 2).
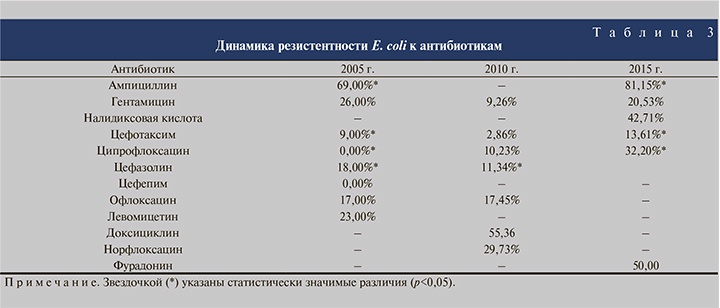
За последние 10 лет отмечается неуклонный рост числа штаммов E. coli, резистентных к ампициллину, ципрофлоксацину и в меньшей степени – к цефалоспоринам III поколения (табл. 3). Так как в ИвОКБ ведется постоянный мониторинг резистентности возбудителей ИМП, то не ко всем препаратам в некоторые года проводилось определение чувствительности в связи с высокой устойчивостью к ним, отмеченной в предыдущих исследованиях [10].
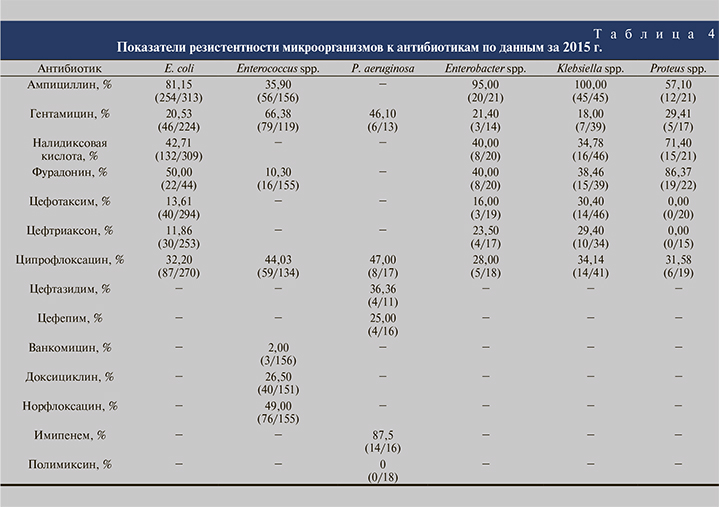
Согласно результатам анализа чувствительности идентифицированных микроорганизмов к антибактериальным препаратам за 2015 г., резистентность E. coli к ампициллину достигла 81%, к ципрофлоксацину – 32%, к гентамицину – 20,5%, к цефотаксиму – 13,6%, к цефтриаксону – 11,8% (табл. 4).
Особое внимание заслуживает факт появления штаммов Enterococcus spp., резистентных к ванкомицину. По нашему мнению, это обусловлено широким применением этого препарата в пластической хирургии. Удивляет тот факт, что P. aeruginosa в 2015 г. в большей степени оказалась резистентной к имипенему, чем к ципрофлоксацину, гентамицину, цефтазидиму и цефипиму, при этом отсутствовали резистентные штаммы к полимиксину. Мы связываем высокую резистентность Pseudomonas aeruginosa (87,5%) с тем, что эти пациенты получали лечение карбапененами в условиях палаты интенсивной терапии или реанимации. Обращает на себя внимание высокий уровень резистентности Enterobacter spp., Klebsiella spp. и Proteus spp. к ампициллину. Вероятно, это обусловлено тем, что эти пациенты до госпитализации в стационар в амбулаторных условиях получали препараты группы пенициллинов.
Заключение. Опираясь на полученные в ходе настоящего исследования данные, с целью снижения выявляемости нозокомиальных инфекций представляется целесообразным в Ивановском регионе после выписки пациента из стационара использовать в эмпирической терапии цефалоспорины III поколения, так как к ним выявлена наименьшая резистентность микроорганизмов. Необходимо резко сократить эмпирическое использование фторхинолонов, препаратов налидиксовой кислоты, нитрофуранов и полностью исключить использование ампициллина в лечении ИМП, потому как в Ивановском регионе за последние 10 лет резко увеличилось количество штаммов E. coli и других грамотрицательных бактерий, резистентных к этим препаратам: устойчивость к ним стала в 3 раза выше, чем к цефалоспоринам.



