Введение. Неосложненные бактериальные инфекции мочевыводящих путей (ИМП) – одна из самых частых внебольничных инфекций. Цистит определяется как симптоматическая инфекция нижних мочевыводящих путей, вызванная бактериальной колонизацией. Основные симптомы цистита: боль при мочеиспускании и поллакиурия. Чаще всего это заболевание встречается у женщин, что связано с особенностями анатомии мочевыводящих путей. Большинство случаев острого цистита вызваны Escherichia coli (75%–95%) [1], другим частым уропатогеном признается Staphylococcus saprophyticus [2]. Стандартом терапии острого цистита в настоящее время считается эмпирическая антибактериальная терапия, однако за последние десятилетия наблюдается увеличение встречаемости антибиотикорезистентной уропатогенной микрофлоры [3]. Известно, что количество назначаемых антибактериальных препаратов ассоциировано с повышением частоты резистентности микроорганизмов, причем как на индивидуальном, так и на популяционном (национальном) уровнях [4, 5]. Кроме того, частое применение антибиотиков может приводить к сопутствовавшему повреждению микробиома, например кишечной и влагалищной микробиоты. Согласно рекомендациям Европейской урологической ассоциации, а также Российским национальным рекомендациям, антибактериальным препаратом первой линии при лечении бактериального цистита является фосфомицина трометамол, который принимается однократно внутрь в дозе 3 г [6, 7]. Это обусловлено хорошим профилем безопасности препарата, высокой комплаентностью пациентов и сравнительно низким потенциалом развития резистентности к нему. В то же время фармакокинетика фосфомицина обусловливает специфичный режим его применения: он накапливается в большой концентрации в моче, и для достижения максимальной эффективности пациент после однократного приема препарата должен воздерживаться от опорожнения мочевого пузыря. С учетом наличия поллакиурии, а иногда и ургентных позывов на мочеиспускание при остром цистите это не всегда возможно. Особенности приема препарата могут приводить к задержке купирования наиболее беспокоящих пациента симптомов острого цистита и требовать параллельного назначения дополнительной терапии, например нестероидных противовоспалительных средств или фитопрепаратов.
Канефрон® Н – лекарственное растительное средство (ЛРС), одобренное для терапии ИМП в 28 странах, включая Германию и Россию. Препарат содержит экстракты травы золототысячника (Centaurii herba), корня любистока (Levistici radix) и листьев розмарина (Rosmarini folium), он продемонстрировал свою безопасность и эффективность по сравнению со стандартной терапией как у взрослых, так и у детей при лечении и профилактике инфекций мочевыводящих путей [8]. Противовоспалительные свойства ЛРС, обнаруженные в доклинических исследованиях [9], коррелируют с положительным влиянием на перекисное окисление липидов, наблюдаемое у пациентов с диабетической нефропатией [10]. В нескольких недавних клинических испытаниях установлено, что данный препарат не уступает ФТ и другим классам антибиотиков для пациентов с бессимптомной бактериурией и неосложненной ИМП [11–14]. Хотя некоторые авторы утверждают, что лекарственные средства растительного происхождения могут стать альтернативой антибиотикам [13,15,16], Wawrysiuk et al. (2019) не нашли убедительных доказательств того, что использование антибиотиков может быть полностью заменено неантибактериальными препаратами. Тем не менее авторы пришли к выводу, согласно которому изменение терапевтической стратегии за счет включения фитотерапии может снижать устойчивость к противомикробным препаратам и улучшать результаты терапии ИМП [17]. Принимая во внимание все вышеперечисленные факты, целью настоящего клинического исследования стала оценка эффективности ЛРС в сочетании с однократной дозой ФТ по сравнению с монотерапией ФТ у женщин с неосложненным бактериальным циститом.
Материалы и методы. За период с января 2018 по июнь 2019 г. в исследование были включены 112 пациентов, соответствовавших нижеперечисленным критериям:
- женский пол;
- возраст старше 18 лет;
- симптомы острого цистита.
Также были сформулированы следующие критерии исключения:
- сумма дифференциальных показателей по анкете ACSS (Acute Cystitis Symptom Score) >2 [18, 19];
- положительный ответ на любой из дополнительных пунктов анкеты ACSS (менструация, предменструальный период, симптомы менопаузы, беременность, сахарный диабет);
- наличие дренажей в мочевой системе или потребность в интермиттирующей катетеризации;
- дилатация верхних мочевыводящих путей;
- повышение уровня креатинина (>100 мкмоль/л);
- аллергия на фосфомицин или компоненты препарата Канефрон® Н.
Методом блоковой рандомизации все пациентки распределены на две группы в соотношении 1:1. В основную группу вошли 56 женщин, которым назначался фосфомицина трометамол 3 г per os однократно в сочетании с препаратом Канефрон® Н по 2 таблетки 3 раза в день курсом 2 нед. (группа ФТ+ЛРС). Группу контроля составили 56 пациенток, которым назначался только фосфомицина трометамол 3 г per os однократно (группа ФТ). Всем пациенткам рекомендовалось соблюдение питьевого режима с потреблением воды в объеме 30 мл на 1 кг массы тела.
При первичном обращении всем женщинам выполнялись общий и биохимический анализы крови и мочи, ультразвуковое исследование почек и мочевого пузыря, в ходе чего определялось соответствие критериям включения и проверка на отсутствие критериев исключения. Оценка субъективной симптоматики проводилась с помощью анкеты ACSS [18, 19], включенной в Национальные клинические рекомендации по лечению бактериального цистита у женщин [7]. Для определения динамики субъективной симптоматики анкета ACSS заполнялась пациентками ежедневно на протяжении недели. Анкета ACSS включает 18 вопросов, сгруппированных по 4 доменам: «Типичные симптомы», «Дифференциальная диагностика», «Качество жизни» и «Дополнительные вопросы об основном заболевании». Для первых трех доменов используется 4-балльная шкала оценки тяжести каждого симптома в диапазоне от 0 (без симптомов) до 3 (тяжелый), в то время как вопросы в дополнительном домене содержат только утверждения «да/нет». Пороговое значение 6 баллов при оценке характерных симптомов имеет чувствительность 91,2% и специфичность 86,5% в отношении прогнозирования острого цистита [18, 19, 7]. На третий и пятый день терапии пациентки выполняли на дому экспресс-анализ мочи с использованием тест-полосок и фиксировали результат. На седьмой день сдавали общий анализ мочи для контроля излеченности. Переносимость терапии оценивалась при устном опросе на 7-й день. Кратность наблюдений выбрана в соответствии с действующими российскими рекомендациями по бактериальному циститу у женщин [7].
В группах сравнивали медианы срока, на котором пациенты отвечали «0» на вопрос о динамике состояния в анкете ACSS, что соответствует полному субъективному выздоровлению. Дополнительно сравнивали медианы срока, в который, по данным общего анализа или экспресс-теста, не обнаруживались лейкоциты в моче. Сравнение медиан проводилось с помощью U-теста Манна–Уитни (для непараметрического распределения данных). Различия считались статистически значимыми при p<0,05.
Результаты. Изначально в исследование были включены 112 пациенток, однако все лечебные и диагностические процедуры, предусмотренные протоколом, выполнены 93 (83%) женщинам. Таким образом, в финальный анализ вошли данные 46 пациенток основной группы и 47 группы контроля. Основные причины исключения пациенток из анализа представлены в табл. 1.
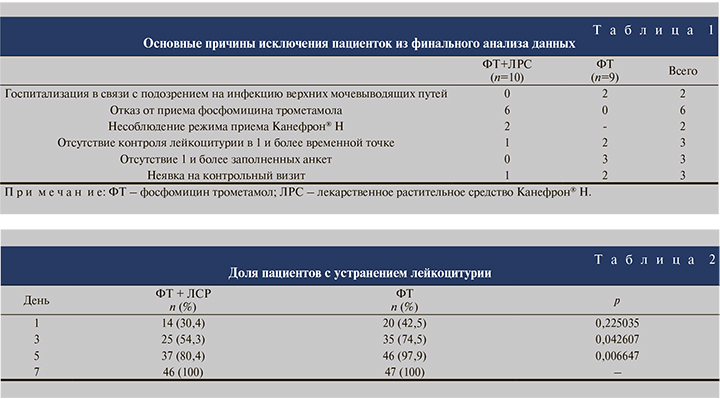
В группе комбинированной терапии полное субъективное выздоровление (в соответствии с анкетой ACSS) отмечено в срок, медиана которого составила 1 день (межквартильный интервал [МКИ]=1–2). В группе контроля медиана срока до субъективного выздоровления была равна 3 дням (МКИ=2–4). Разница между этими показателями была статистически значимой (p=0,00012). Доля пациентов с полным субъективным выздоровлением, по данным анкеты ACSS, в динамике представлена на рисунке.
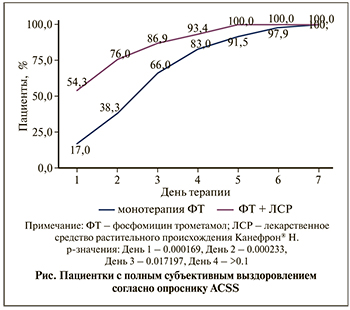
Доли выздоровевших пациенток в обеих группах post hoc сравнивались между собой с использованием анализа хи-квадрат. Доля пациентов с полным купированием симптоматики острого цистита с 1-го по 3-й день статистически значимо различалась между сравниваемыми группами. Медиана срока до устранения лейкоцитурии в обеих группах составила 3 дня (МКИ=1–5 и МКИ=1–4 соответственно) при этом статистически значимых различий между группами не наблюдалось (p=0,045). Доля пациентов с нормализацией этого показателя в динамике представлена в табл. 2. Как видно из таблицы, в группе монотерапии наблюдалась тенденция к более раннему купированию лейкоцитурии, но ее нельзя считать клинически значимой.
Что касается нежелательных явлений, то у 4 (8,7%)пациенток основной группы и 3 (6,4%) группы контроля отмечалась диспепсия, а также головная боль у 2 (4,3%) и 3 (6,4%) пациенток соответственно. Таких явлений, как диарея, дерматит, кандидоз, в нашей выборке на фоне проводимой терапии не наблюдалось.
Обсуждение. На сегодняшний день к основным возбудителям ИМП относятся такие патогены, как Escherichia coli и Staphylococcus saprophyticus [3], что позволяет применять эмпирическую антибактериальную терапию. Согласно Российским клиническим рекомендациям, у женщин с неосложненным циститом в качестве первой линии терапии показан прием ФТ однократно или фуразидина или нитрофурантоина согласно инструкции на препараты [7]. Для пациента, как и для врача наиболее удобным представляется однократный прием антибиотика, в данном случае ФТ. Однако в нашем исследовании 6 из 56 пациенток группы комбинированной терапии отказались от использования ФТ и впоследствии были исключены из исследования. Данная тенденция может отражать общий стереотип в отношении антибактериальной терапии, в связи с чем все большее количество исследователей обращают свое внимание на альтернативные методы терапии ИМП, в частности на фитопрепараты.
J. Marcon et al. (2019) использовали 40 клинических изолятов уропатогенных бактерий для оценки эффективности проантоцианидинов, Д-маннозы, экстракта розмарина и изотиоцианатов in vitro. В этом доклиническом исследовании экстракт розмарина, компонент ЛРС Канефрон® Н, оказывал сильное бактериостатическое действие на Escherichia coli, Klebsiella pneumoniae и Proteus mirabilis в концентрациях 1 или 10 мкг/мл [20]. Полученные данные могут объяснить сравнимую эффективность Канефрона Н и ФТ для пациенток с типичными симптомами острой неосложненной ИМП, наблюдаемую Wagenlehner et al. (2018): авторы обнаружили, что 238 (83,5%) пациенток, получавших фитопрепарат в монотерапии, и 272 (89,8%) группы ФТ не нуждались в дополнительном назначении антибактериальных препаратов в течение 38 дней исследования [13]. Попытки заменить антибактериальные препараты фитотерапевтическими средствами осуществлялись и ранее, хотя исследователям не удавалось доказать, что в эффективности (non-inferiority) фитотерапия не уступает стандартной антибиотикотерапии [15]. Что касается результатов нашего исследования, то ни одной из пациенток не потребовался дополнительный прием антибиотиков после однократной пероральной дозы ФТ. Однако 19 женщин были исключены из исследования в связи с неявкой на контрольный визит – возможно, именно в этой категории были пациентки, прибегнувшие к дополнительным антибактериальным препаратам.
Все пациентки, включенные в окончательный анализ и получившие однократную дозу ФТ в сочетании или без ЛРС, продемонстрировали полное субъективное и объективное выздоровление к 7-му дню исследования, что отражает высокую эффективность обоих режимов терапии. Хотя нам не удалось продемонстрировать преимуществ комбинированной схемы лечения в отношении лейкоцитурии, нами отмечено значительно более быстрое уменьшение симптомов острого цистита в основной группе. Эти данные согласуются с результатами доклинического исследования Nausch et al. (2019): у самок крыс линии Спрег-Доули с циститом, вызванным циклофосфамидом, пероральное введение ЛРС Канефрон® Н привело к уменьшению воспаления и гипералгезии, возможно, из-за ингибирования биосинтеза простагландина Е2 и лейкотриена В4 [9]. Этот результат имеет важное значение, поскольку именно симптомы раздражения и боль определяют тяжесть цистита, в отличие от инфекций верхних мочевыводящих путей, где решающую роль играют симптомы интоксикации и риск ухудшения функции почек [6, 21]. Эффективность ЛРС в данном случае связана с его противовоспалительным действием и умеренным влиянием на диурез, что обеспечивает нормальное выведение бактерий и их токсинов [22]. Мочегонный эффект ЛРС также может объяснить более высокую частоту лейкоцитурии в группе комбинированной терапии на 2-й и 5-й день, благодаря чему осуществлялся клиренс лейкоцитов из мочевыводящих путей.
Нами отмечена хорошая переносимость комбинированной терапии ФТ с ЛРС, а также монотерапии ФТ: частота наблюдаемых нежелательных явлений была низкой, составив 8,7 против 6,4% для диспепсии и 4,3 против 6,4% для головной боли, что сопоставимо с ранее опубликованными данными. В частности, по данным Wagenlehner et al. (2018), наиболее часто регистрируемыми нежелательными явлениями были желудочно-кишечные расстройства, о которых сообщалось с более высокой частотой в группе ФТ (22 из 334 пациентов; 6,6%), чем в группе ЛРС (13 из 325 пациентов; 4,0%). Хотя данные авторы обнаружили большее число пациентов, сообщивших о пиелонефрите в группе ЛРС (n=5; 4 легкой и 1 средней тяжести), чем в группе ФТ (n=1, легкой тяжести), в группе ЛСР 3 из 5 случаев пиелонефрита произошли в тот же день (1 случай) или через 1 день после включения в исследования (2 случая). Данная тенденция скорее всего указывает на факт развития пиелонефрита в стертой форме еще до включения этих пациенток в исследование [13]. В нашей работе ни одного случая пиелонефрита в обеих группах пациенток, включенных в анализ, не наблюдалось.
Эффективность растительных препаратов в терапии неосложненных инфекций мочевыводящих путей уже неоднократно демонстрировалась в ряде исследований, авторы которых заявляют, что ЛРС обладают потенциалом для сокращения амбулаторного применения антибиотиков [11–17]. Наше исследование подтвердило высокую эффективность однократной дозы ФТ и показало, что добавление растительного препарата Канефрон® Н, обладающего противовоспалительным, противомикробным и мочегонным действиями способствует более быстрому устранению симптомов ИМП. Благодаря чему он может улучшить качество жизни женщин с циститом, ускорив их возвращение к нормальной ежедневной деятельности, уменьшить потребность в дополнительном применении анальгетических и антибактериальных препаратов. Мы считаем, что любые препараты растительного происхождения, в том числе Канефрон® Н, следует рассматривать не как альтернативу антибактериальным препаратам, а как полезное дополнение к стандартной терапии.



