Введение. Хронический бактериальный простатит (ХБП) является одним из распространенных заболеваний мужской репродуктивной системы. На его долю приходится от 5 до 10% от числа больных простатитом всех категорий [1]. Основными причинами возникновения ХБП являются инфекции и микроэкологические нарушения урогенитального тракта, а также цитокин-опосредованные механизмы воспаления предстательной железы [2]. Длительному персистированию микроорганизмов при простатите способствует их способность инактивировать лизоцим [3] и формировать биопленки [4]. Выявленные изменения антипептидной активности микробиоты в отношении цитокинов (TNFα, IL1РА, IL6, IL17) также могут вносить свой вклад в нарушение иммунного гомеостаза биотопа, приводя к формированию очага хронической инфекции [2]. Рядом авторов показано, что ингибирующим влиянием на персистентный потенциал микроорганизмов, в том числе возбудителей инфекционно-воспалительных заболеваний, характеризуются фитопрепараты [5, 6, 7]. В последние годы появилось множество сообщений о целесообразности применения растительных препаратов в комплексной терапии ХБП, в частности ПростаНорм®, терапевтические эффекты которого экспериментально подтверждены в многочисленных исследованиях в течение 20 лет [8–11]. Так, изучение в условиях in vitro антимикробной активности ПростаНорма® в отношении 56 клинических штаммов условно-патогенных микроорганизмов, выделенных от больных (Институт хирургии им. А.В. Вишневского и НИИ урологии РАМН), показало, что грамположительные бактерии рода Staphylococcus и Streptococcus (Enterococcus), играющих важную роль в этиологии инфекционно-воспалительных неспецифических заболеваний предстательной железы и мочевыводящих путей, проявляли высокую чувствительность к препарату. При этом активность ПростаНорма® в отношении лекарственно резистентных штаммов проявлялась в той же степени, что и в отношении антибиотикочувствительных штаммов бактерий [12].
Исследованием на базе ГБУЗ Московской области «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского» (МОНИКИ) в условиях in vitro была установлена бактериостатическая активность ПростаНорма® в отношении грамотрицательных и грамположительных микроорганизмов, а также бактерицидный эффект в отношении грамположительных микроорганизмов, выделенных от больных хроническим простатитом [11]. В результате другого исследования, установлена антибактериальная активность ПростаНорма® в отношении микроорганизмов, выделенных от пациентов с катетером-стентом мочеточника [13].
Вместе с тем, не охарактеризовано влияние ПростаНорма® на персистентные характеристики микроорганизмов, выделенных из секрета простаты больных хроническим бактериальным простатитом, что и явилось целью нашего исследования.
Материалы и методы. В работе исследован официнальный фитопрепарат ПростаНорм® (экстракт жидкий для приема внутрь) ООО НПО «ФармВИЛАР» (Россия), содержащий природные растительные компоненты травы зверобоя (Hypéricum perforátum), травы золотарника канадского (Solidágo canadénsis), корней солодки (Glycyrrhiza uralensis), корневищ и корней эхинацеи пурпурной (Echinácea purpúrea) и этанол 50% в качестве экстрагента. Клинические штаммы, выделенные из секрета простаты больных хроническим бактериальным простатитом: Escherichia coli (n=10), Staphylococcus aureus (n=10), S. haemolyticus (n=10), S. epidermidis (n=10), Enterococcus faecalis (n=10).
Видовую принадлежность микроорганизмов оценивали с помощью масс-спектрометра MALDI-TOF серии Microflex (Bruker Daltonics, Германия), идентификацию микроорганизмов с расчетом коэффициента достоверности проводили с использованием программного обеспечения Maldi BioTyper 3,0.
Влияние ПростаНорма® на персистентные свойства микроорганизмов изучали с помощью оригинальной методики, заключающейся в сокультивировании 1 мл микробной взвеси в физиологическом растворе с 1 мл фитопрепарата ПростаНорм® в 2 мл питательного бульона при 37°С в течение 2 часов. В качестве первого контроля использовали взвесь микроорганизмов без препарата, в качестве второго – взвесь микроорганизмов с добавлением 1 мл 50% раствора этилового спирта. Затем контрольные и опытные пробы центрифугировали в течение 15 мин при 3000 об/мин, сливали надосадочную жидкость, добавляли к осадку 2 мл питательного бульона, ресуспензировали. Далее отбирали по 150 мкл взвеси для определения антилизоцимной и антицитокиновой активности, способности формировать биопленки.
Способность образовывать биопленки (БПО) определяли по [14], антилизоцимную активность (АЛА) микроорганизмов – по [15]. Антицитокиновую активность (АЦА) в отношении IL4, IL6, IL8, TNFα и IL17А определяли методом иммуноферментного анализа (ИФА) по известной методике [16] с использованием наборов ООО «Цитокин» (Санкт-Петербург). В центрифужные пробирки вносили по 150 мкл взвеси микроорганизмов и растворы соответствующих цитокинов в соотношении 1:1, пробы инкубировали в течение 2 часов при 37 °С. После инкубации реакцию останавливали на холоде, пробы центрифугировали при 3000 об/мин в течение 15 мин (+4°С) и отбирали супернатанты.
Определение концентрации цитокинов в опытных и контрольных пробах проводили методом ИФА, результаты учитывали на фотометре StatFax 2100 (США) при длине волны 450 нм. Для определения антицитокиновой активности использовали растворы цитокинов в физиологическом растворе в следующих концентрациях: IL4 – 30,7 пг/мл, IL6 – 83,3 пг/мл, IL8– 83,3 пг/мл, TNFα– 52,3 пг/мл и IL17А– 461,5 пг/мл. Для оценки АЦА вычисляли процент инактивации цитокинов в опыте относительно контроля и выражали в % инактивации.
Эффект регуляции факторов персистенции микроорганизмов являлся существенным, если под воздействием ПростаНорма® происходило снижение их уровня на 40-60% и более, умеренный ингибирующий эффект регистрировался при снижении экспрессии факторов персистенции на 20-40% [17].
Статистический анализ результатов проводился с помощью пакета программ Microsoft Excel 2007. Значимость различий средних величин показателей оценивали с помощью методов вариационной статистики (t-критерий Стьюдента). Статистически значимыми отличия считали при p<0,05.
Результаты. В ходе проведенных исследований установлено выраженное однонаправленное ингибирующее действие ПростаНорма® как на распространенность, так и выраженность АЛА условно-патогенных микроорганизмов и их способности формировать биопленки.
Так, установлена потеря способности инактивировать лизоцим у половины изученных штаммов коагулазонегативных стафилококков (S. haemolyticus и S. epidermidis) и E. faecalis; 30% культур E. coli и S. aureus.
При этом под действием ПростаНорма® отмечено максимальное подавление АЛА у штаммов стафилококков: на 72% у S. haemolyticus, на 80,9% у S. epidermidis и на 81,5% у S. aureus (p<0,001). В меньшей степени (на 65,9%) ПростаНорм® ингибировал способность к инактивации лизоцима у E. faecalis (p<0,001), умеренный ингибирующий эффект признака (на 28,3%) регистрировался у кишечной палочки (таблица 1).
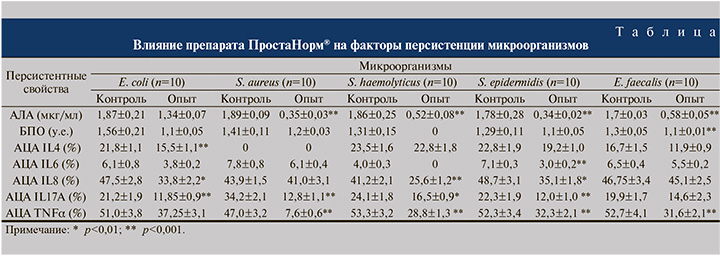
Способность формировать биопленки была утрачена у 100 % изолятов S. haemolyticus, 50 % штаммов S. aureus, S. epidermidis и E. faecalis, а также 30% культур E. coli. Под действием ПростаНорма® отмечено снижение БПО у остальных изученных культур стафилококков разных видов и энтерококков в среднем на 15%, а у изолятов E. coli на 30% .
Анализ распространенности антицитокиновой активности микроорганизмов показал подавление АЦА в отношении IL6 у 20% изолятов E. coli, 50% S. epidermidis и всех изученных культур S. haemolyticus.
Установлено разнонаправленное влияние ПростаНорма® на способность клинических штаммов инактивировать цитокины IL4, IL6, IL8. Препарат ПростаНорм® достоверно не изменял выраженность АЦА культур коагулазоотрицательных стафилококков и энтерококков в отношении противовоспалительного IL4; E. faecalis в отношении IL6 и IL8, S.aureus в отношении IL8.
Вместе с тем, максимальное подавление (на 58%) АЦА в отношении IL6 под действием ПростаНорма® отмечено у эпидермального стафилококка, на 38% снизилась выраженность АЦА в отношении IL8 у S. epidermidis и S. haemolyticus (p<0,001).
При этом ПростаНорм® оказывал однонаправленное ингибирующее действие на АЦА в отношении IL17А и TNFα у всех изученных микроорганизмов.
У S. aureus выявлено достоверное снижение АЦА в отношении IL17А и TNFα на 63% и 84% (p<0,01), у S. haemolyticus – на 32% и 46% (p<0,001), у S. epidermidis на 46% и 38% (p<0,001) соответственно, умеренный ингибирующий эффект активности отмечен у E. faecalis – на 27% и 40% (p<0,01).
Также умеренный ингибирующий эффект (на 27–29%) ПростаНорм® оказывал на выраженность антицитокиновой активности в отношении IL4, IL8, TNFα у изолятов E. coli и существенный (44%) на АЦА в отношении IL17А у данного вида бактерий.
Обсуждение. В результате проведенного исследования получены новые сведения о модифицирующем действии ПростаНорма® на персистентные свойства микроорганизмов, выделенных из секрета простаты больных хроническим бактериальным простатитом.
Факторы персистенции микроорганизмов, в частности, биопленкообразование и антилизоцимная активность, являются биомишенью для изучения и подбора препаратов, пригодных для борьбы с патогенами [18]. В эксперименте in vitro нами установлено однонаправленное ингибирующее действие препарата ПростаНорм® на АЛА и БПО всех изученных видов условно-патогенных микроорганизмов.
В настоящее время активно изучается антицитокиновая активность микроорганизмов. Показано ее наличие у стафилококков разных видов, выделенных из секрета предстательной железы у мужчин с симптомами урогенитальной инфекции [19], разработан алгоритм прогнозирования риска развития послеоперационных воспалительных осложнений с использованием данных о распространенности и выраженности АЦА у кишечных палочек, выделенных у больных с урогенитальной патологией [20], выявлены отличия в значениях АЦА микроорганизмов, выделенных при различных формах инфекционного процесса [21]. Кроме того, предложено использование антипептидной активности микробиоты в совокупности с цитокиновым профилем хозяина в качестве биомишени для диагностических, профилактических и лечебных мероприятий при ХБП [2].
В связи с этим, представляют несомненный интерес полученные нами в ходе исследования данные о модификации препаратом ПростаНорм® антицитокиновой активности, заключающейся в снижении экспрессии АЦА в отношении IL17А и TNFα у всех изученных видов микроорганизмов, АЦА в отношении IL4, IL6, IL8 у E. coli и АЦА в отношении IL6 и IL8 у коагулазоотрицательных стафилококков.
Заключение. Полученные материалы позволяют объяснить один из возможных механизмов фармакологической активности ПростаНорма® in vivo его способностью однонаправленно снижать изученные факторы персистенции условно-патогенных микроорганизмов в условиях in vitro.



