Введение. Среди бактериальных инфекций, являющихся угрозой для здоровья человека, одно из лидирующих мест принадлежит инфекциям мочевыделительных путей [1], при этом ведущую позицию занимают хронический пиелонефрит [2, 3] и хронический цистит [4]. В основе патогенеза инфекций мочевыделительной системы лежит запуск реакций цитокинового каскада, который включает выработку про- и противовоспалительных цитокинов [4]. Провоспалительные цитокины (IL6, IL8, FNO α, INF γ) участвуют в инфекционном иммунитете. Воспалительные цитокины (IL6, IL8) играют важную роль в ответе на бактериальную инфекцию [5]. Активированные антигенами условно-патогенных микроорганизмов макрофаги, нейтрофилы, Т-хелперы и другие клетки крови в системе микроциркуляции почек и мочевого пузыря, при развитии инфекций мочевыделительной системы, синтезируют и выбрасывают в кровоток про- и противовоспалительные цитокины [6], обеспечивая тем самым, реализацию врожденного звена иммунитета.
Вместе с тем, очевидно, что возбудителями эндогенных инфекционно-воспалительных заболеваний мочевыводящих путей (хронического пиелонефрита и цистита) могут быть условно-патогенные микроорганизмы [7], обладающие определенным набором свойств, позволяющим им состояться как возбудители и реализовать ключевые этапы развития инфекционного процесса. К ним относятся свойства бактерий, которые определяют их способность инактивировать факторы противоинфекционной защиты макроорганизма (лизоцим, про- и противовоспалительные цитокины) и повышают устойчивость бактерий в условиях макроорганизма (формирование микробных биопленок) Рядом авторов показано, что при инфекционно-воспалительных заболеваниях бактериальной природы, в частности заболеваниях мочеполовой системы, достоверно чаще выделяются микроорганизмы, обладающие антилизоцимной активностью и способностью формировать биопленки [8]. Установлен высокий уровень распространенности и выраженности антицитокиновой активности у E. coli, изолированных из мочи больных мочекаменной болезнью с послеоперационными воспалительными осложнениями [9].
Все чаще в терапии инфекций мочевыводящих путей применяют лекарственные препараты растительного происхождения [10, 11], ингибирующие способность приоритетных видов урофлоры инактивировать лизоцим и формировать биопленки [12, 13]. Установлено, что подавление препаратом персистентных свойств возбудителя затрудняет его паразитирование внутри клеток и тем самым, повышает эффективность лекарственных воздействий [14].
Целью настоящего исследования явилась экспериментальная оценка влияния фитопрепарата Фитофрон®, используемого при терапии инфекций мочевыделительной системы, на способность условно-патогенных микроорганизмов, инактивировать факторы врожденного иммунитета (лизоцим, про- и противовоспалительные цитокины) и формировать биопленки.
Материалы и методы. В работе использован официнальный фитопрепарат Фитофрон® (раствор для приема внутрь) ООО НПО «ФармВИЛАР» (Россия), содержащий экстракт жидкий из лекарственного сырья: золототысячника травы, любистока лекарственного корней, розмарина лекарственного листьев и воды очищенной в качестве вспомогательного вещества.
Клинические изоляты из мочи больных с инфекциями мочевыделительной системы (пиелонефрит, цистит): Escherichia coli (n=10), Staphylococcus aureus (n=10), S. haemolyticus (n=10), S. epidermidis (n=10), Enterococcus faecalis (n=10). Видовая принадлежность микроорганизмов оценена с помощью масс-спектрометра MALDI-TOF серии Microflex (Bruker Daltonics, Германия), идентификация проведена с расчетом коэффициента достоверности при использовании программного обеспечения Maldi BioTyper 3,0.
Исследование изменений персистентных свойств уроштаммов препаратом Фитофрон® проводили оригинальным методом. Сокультивировали 1 мл бактериальной взвеси в физиологическом растворе (концентрация 1х109 КОЕ/мл) с 1 мл препарата и 2 мл питательного бульона 2 часа при 37оС (опыт). Контролем были взвеси бактерий без добавления препарата. Далее пробы центрифугировали 15 мин при 3000 об/мин, сливали надосадочную жидкость, приливали к осадку 2 мл питательного бульона и проводили ресуспензирование. Затем отбирали по 150 мкл микробной взвеси для определения антилизоцимной и антицитокиновой активности, кроме того у бактерий определяли способность к формированию биопленок
Способность образовывать биопленки (БПО) определяли по O’Toole G. с соавт. (2000) [15], антилизоцимную активность (АЛА) микроорганизмов – по О.В. Бухарину с соавт. (1999) [16]. Антицитокиновую активность (АЦА) в отношении выбранных про- и противовоспалительных цитокинов (IL4, IL6, IL8, TNFα и IL17А) оценивали иммуноферментным методом (ИФА) по методике [17] в модификации с использованием наборов ООО «Цитокин» (Санкт-Петербург). В центрифужные пробирки добавляли по 150 мкл взвеси изученных бактерий и разведения цитокинов в соотношении 1:1, пробирки культивировали 2 часа при 37 °С, реакцию останавливали на холоде, потом пробирки центрифугировали при 15 мин при 3000 об/мин (+4°С), далее отбирали супернатанты. Для определения антицитокиновой активности микроорганизмов использовали разведения цитокинов в физ. растворе в описанных концентрациях: TNFα – 52,3 пг/мл, IL17А – 461,5 пг/мл, IL8 – 83,3 пг/мл, IL6 – 83,3 пг/мл, IL4 – 30,7 пг/мл. Замеры концентрации цитокинов в опыте и контроле проводили ИФА методом, результаты учитывали на фотометре StatFax 2100 (США) при длине волны 450 нм. Для оценки АЦА вычисляли процент инактивации цитокинов в опыте относительно контроля и выражали в % инактивации.
Эффект регуляции персистентных свойств микроорганизмов являлся значимым, если под воздействием Фитофрона® происходило их подавление на 40-60% и более, умеренный подавляющий эффект определялся при снижении выраженности признаков на 20–40% [18].
Статистический анализ результатов проводили с помощью пакета программ Microsoft Excel 2007. Значимость различий средних величин показателей оценивали с помощью методов вариационной статистики (t-критерий Стьюдента). Статистически значимыми отличия считались при p<0,05.
Результаты. В результате проведенных исследований по изучению влияния препарата Фитофрон® на антилизоцимную активность микроорганизмов разных видов и их способность формировать биопленки было выявлено его ингибирующее действие на данные свойства (см. таблицу).
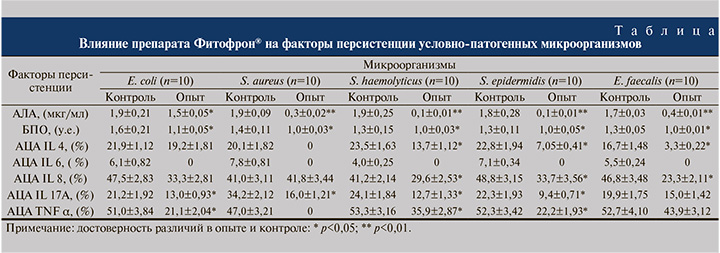
Под воздействием препарата Фитофрон® наиболее эффективно снижалась АЛА у коагулазоотрицательных стафилококков (на 94,4% у S.epidermidis и 94,7% – S. haemolyticus, p<0,01), в меньшей степени у S.aureus и E. faecalis – на 84% и 76,5% соотвественно (p<0,01), способность инактивировать лизоцим у кишечной палочки изменялась незначительно (на 21%, p<0,05).
У коагулазоотрицательных стафилококков S.epidermidis, S. haemolyticus и E. faecalis коэффициент биопленкообразования снизился на 23,1% (p<0,05), у штаммов S.aureus – на 28,5% (p<0,05), у E. coli на 31% (p<0,05) по сравнению с контролем.
Установлено разнонаправленное влияние исследуемого препарата на способность клинических штаммов инактивировать цитокины. Препарат достоверно не изменял выраженность АЦА E. coli в отношении противовоспалительного IL4; S. aureus в отношении IL8 и E. faecalis – в отношении IL 17A и TNF α; в то же время, Фитофрон полностью ингибировал АЦА в отношении IL 6 у всех изученных штаммов микроорганизмов.
Фитопрепарат Фитофрон® снижал АЦА в отношении IL4 у стафилококков и энтерококков, причем у штаммов E. faecalis на 80,2% (p<0,05), у S. epidermidis на 69,1% (p<0,05), у S. haemolyticus – на 41,7% (p<0,05), у золотистых стафилококков признак не определялся.
Наиболее эффективно (на 52,1%) Фитофрон® ингибировал АЦА в отношении IL 8 у энтерококков, и умеренно у коагулазоотрицательных стафилококков (у S. epidermidis на 30,9%, у S. haemolyticus на 28,2%) и кишечной палочки (на 29,9%).
Максимальное подавление (на 57,8%) АЦА в отношении IL 17A под действием Фитофрона® отмечено у эпидермального стафилококка (p<0,05), на 53,2% признак снизился у S. aureus (p<0,05), а у S. haemolyticus на 47,3% (p<0,05). Умеренный ингибирующий эффект (на 38,7%) Фитофрон® оказывал на АЦА IL 17A кишечной палочки.
Влияние препарата приводило к снижению АЦА в отношении TNF α у штаммов S. epidermidis и E. coli на 57,5 и 58,6% (p<0,05). Фитофрон® характеризовался умеренным ингибирующим эффектом (на 32,6%) в отношении АЦА TNF α гемолитического стафилококка (p<0,05), у золотистых стафилококков признак перестал регистрироваться.
Обсуждение. Проведенные исследования позволили получить экспериментальные данные о влиянии препарата Фитофрон® на биологические свойства условно-патогенных микроорганизмов. Установлено однонаправленное достоверное снижение способности изученных микроорганизмов инактивировать лизоцим макроорганизма, IL17 А, TNF α (за исключением E. faecalis), IL8 (за исключением S. aureus), IL4 (за исключением E. coli) под влиянием препарата Фитофрон®.
Показано, что действие препарата Фитофрон® приводило к полному исчезновению АЦА в отношении IL 6 у всех изученных бактерий, у штаммов золотистого стафилококков пропадала также АЦА в отношении IL4 и TNF α.
На ряду с тем, что растительный препарат Фитофрон®, применяемый в лечении и профилактике инфекций мочевыводящих путей, обладает мочегонным, спазмолитическим, противовоспалительным, противомикробным действием, обусловленным биологически активными веществами, входящими в его состав [19], он также ингибирует возможность условно-патогенных микроорганизмов инактивировать факторы врожденного иммунитета (лизоцим, про- и противовоспалительные цитокины) и формировать микробные биопленки, что, вероятно, может способствовать скорейшей элиминации патогенов из мочевыводящих путей.
Заключение. Проведенные исследования раскрывают еще один из возможных механизмов фармакологической активности in vivo растительного препарата Фитофрон®, применяемого для лечения инфекций мочевыделительной системы, который связан с его способностью ингибировать персистентные свойства условно-патогенных микроорганизмов в условиях in vitro.



