Введение. Проблема патогенеза нефролитиаза – одна из ключевых в современной урологии. Этиология мочекаменной болезни все еще остается до конца не ясной. Однако многие аспекты сложного процесса камнеобразования разработаны достаточно подробно. Например, сравнительно хорошо изучены многочисленные факторы риска формирования почечных конкрементов. Значительную роль играют так называемые немодифицируемые факторы, в частности пол, возраст пациента, принадлежность к тому или иному этносу, географическое расположение местности, где проживает больной, генетические особенности. Между тем все больший интерес современных исследователей привлекают «модифицируемые» факторы риска мочекаменной болезни, такие как ожирение, сахарный диабет (СД) и метаболический синдром.
Сахарный диабет 2 типа (СД2) – ведущий компонент метаболического синдрома, а происходящие при этом нарушения метаболизма могут негативно влиять на функцию почек и состав мочи, повышая ее литогенную активность [1, 2]. Показано, что абдоминальное ожирение, гипергликемия и СД2 независимо коррелируют с повышенным риском нефролитиаза [3–5]. Это связано с одновременным действием двух групп факторов – метаболическими нарушениями, ведущими к развитию инсулинорезистентности и гипергликемии, а также изменениями в составе мочи, способствующими камнеобразованию вследствие действия тканевого воспаления, и молекулярными нарушениями, влияющими на транспорт метаболитов в почке [6].
Эти пациенты в большинстве своем получают лекарственную терапию, направленную на коррекцию нарушений углеводного обмена, которая потенциально может влиять на риск камнеобразования как в положительную, так и в отрицательную сторону.
Современная фармакология для лечения СД2 предлагает достаточно обширный выбор препаратов для перорального приема с различным механизмом действия:
- производные сульфонилмочевины – стимулируют секрецию инсулина островковыми клетками;
- бигуаниды – повышают чувствительность тканей организма к инсулину, на фоне чего снижается масса тела больного, улучшается липидный состав крови;
- производные тиазолидинона (глитазоны) – снижают инсулинорезистентность главным образом жировой и мышечной ткани, нормализуют соотношение липидов в крови;
- ингибиторы α-глюкозидазы – блокируют усвоение углеводов на уровне желудочно-кишечного тракта;
- ингибиторы дипептидилпептидазы-4 (глиптины) и инкретины – опосредованно (через гастроинтестинальные гормоны) стимулируют секрецию инсулина;
- ингибиторы натрий-глюкозного котранспортера II типа (глифлозины) – угнетают реабсобцию глюкозы в проксимальном канальце, вызывая почечную глюкозурию.
В литературе имеются указания, будто пероральные противодиабетические препараты могут влиять на литогенные факторы мочи и в зависимости от фармакологической группы уменьшать или увеличивать кристаллообразование, вероятность камнеобразования.
Широко используемый в современной эндокринологической практике метформин в опытах на клеточных культурах и на крысах с индуцированной гипероксалурией уменьшал повреждение клеток, индуцированное добавлением к культуре клеток оксалатов, предотвращал рост концентрации маркера перекисного окисления липидов (малонового диальдегида) и снижение активности антиоксидантного фермента супероксидоксидазы, а в опытах in vivo снижал кристаллообразование оксалатов [7]. Канаглифлозин, относящийся к группе ингибиторов натрий-глюкозного котранспортера II типа, снижает концентрацию мочевой кислоты в крови больных СД2 с гиперурикемией на 23–32% [8]. Пиоглитазон у крыс с моделированной гипероксалурией уменьшал кристаллообразование, что сопровождалось снижением маркеров оксидантного повреждения клеток и их апоптоза [9]. Представленные данные свидетельствуют о потенциальной значимости почечных эффектов сахароснижающих средств в условиях нефролитиаза. Однако вышеупомянутые исследования были проведены без комплексной оценки влияния этих препаратов на биохимические параметры крови и мочи, от которых зависит вероятность рецидива камнеобразования.
Цель исследования: изучить влияние пероральных сахароснижающих препаратов на литогенные свойства мочи больных нефролитиазом на фоне СД2.
Материалы и методы. Для оценки влияния лекарственной терапии СД2 на процесс камнеобразования обследованы 376 пациентов, страдавших рецидивирующим нефролитиазом и медикаментозно компенсированным СД2, проходивших лечение в НИИ урологии и интервенционной радиологии им. Н. А. Лопаткина – филиал ФГБУ НМИЦ радиологии Минздрава России и отделение эндокринологии ГКБ им. Д. Д. Плетнева Департамента здравоохранения г. Москвы в 2012–2017 гг. Пациенты были разделены на пять групп, согласно примененному пероральному сахароснижающему средству. Лекарственная терапия назначалась врачом-эндокринологом с учетом выраженности нарушений углеводного обмена, ранее применявшихся препаратов, оказавшихся малоэффективными, без какого-либо вмешательства со стороны исследователей.
Выбор сахароснижающих препаратов для исследования осуществлен по нескольким позициям:
- широкое применение в реальной терапевтической/эндокринологической практике;
- доказанная эффективность для лечения СД2 (уровень доказательности А или B);
- доступность (в том числе и экономическая) препарата на отечественном рынке.
Проанализировав фармакологические свойства, а также доказательные базы имеющихся на отечественном рынке пероральных сахароснижающих средств, мы пришли к выводу, что в наибольшей мере указанным требованиям отвечают:
- из группы бигуанидов метформин (146 пациентов, 2-я группа);
- из группы производных сульфонилмочевины глибенкламид (87 пациентов, 3-я группа);
- из группы тиазолидиндионов (глитазонов) пиоглитазон (34 пациента, 4-я группа);
- из группы производных ингибиторов натрий-глюкозного котранспортера II типа (глифлозинов) канаглифлозин (52 пациента, 5-я группа).
- из группы ингибиторов дипептидилпептидазы-4 (глиптинов) вилдаглиптин (27 пациентов, 6-я группа).
Данные препараты широко применяются в реальной клинической практике для лечения СД2, в том числе в режиме монотерапии.
Ввиду возможных затруднений при интерпретации результатов, а также необходимости формирования чрезмерно большого числа групп от обследования пациентов, получавших комбинированную терапию СД2, решено отказаться.
Объектом изучения был ряд биохимических показателей крови и мочи, при комбинированной оценке позволивших охарактеризовать интенсивность процесса камнеобразования, а также с достаточной для клинического применения вероятностью предположить состав конкремента.
Контрольную 1-ю группу составили 30 пациентов, страдавших СД2 и нефролитиазом, достигших компенсации диабета с применением инсулина без использования пероральных сахароснижающих средств.
Критерии исключения: СД 1 типа, симптоматический СД, вторичный нефролитиаз на фоне обструкции мочевыводящих путей, канальцевых дисфункций, генетически обусловленных ферментопатий, первичного гиперпаратиреоза; диабетическая нефропатия, выраженная почечная недостаточность вне зависимости от ее этиологии (СКФ<60 мл/мин), комбинированная терапия СД2, декомпенсированный СД2, в том числе и на фоне терапии изучаемыми препаратами (HbA1c<6,5%), активные инфекционно-воспалительные заболевания органов мочеполовой системы.
Статистический анализ цифровых данных проведен с помощью программы «Statistica 10» с использованием для сопоставления значений независимых выборок непарного критерия Стьюдента, а для оценки значимости различий в частоте встречаемости анализируемого признака – критерия χ2. Достоверными считались различия при p<0,05.
Результаты.
Анализ сопоставимости исследуемых групп
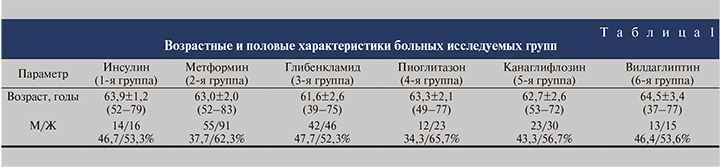
На первом этапе исследования исследуемые группы были сопоставлены по основным демографическим показателям (пол, возраст), а также по таким медицинским критериям, как уровень гликемии, функциональное состояние почек, локализация камней и их минеральный состав, поскольку значимые различия по этим факторам могут влиять на результаты анализа.

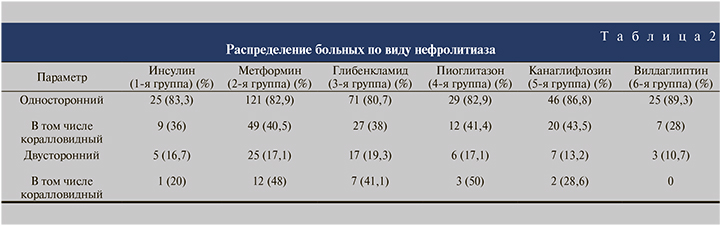
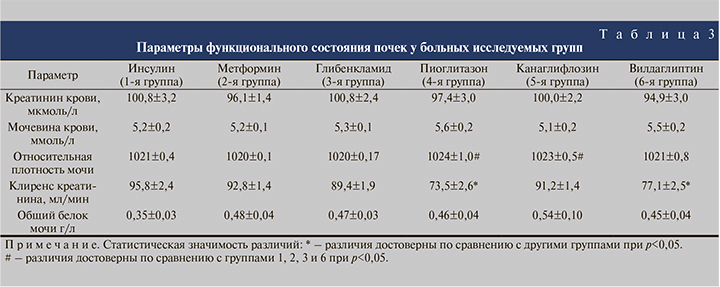
Средний возраст больных, соотношение мужчин и женщин в группах оказались примерно одинаковыми (табл. 1). Несколько меньшая доля мужчин во 2-й и 4-й группах по сравнению с другими группами оказалась статистически незначимой (χ2=1,66–3,51 при критическом значении 3,84 для достоверности при p<0,05). Все больные, включенные в исследование, страдали от наличия камней почек. При этом у большинства больных был односторонний нефролитиаз (табл. 2). Имеющиеся различия между группами в соотношении одностороннего и двустороннего нефролитиаза оказались статистически незначимыми (χ2–0,14–2,51 при критическом значении 3,84 для достоверности при p<0,05). Средние значения биохимических показателей крови, характеризующих азотовыделительную функцию почек, во всех группах были примерно одинаковыми и статистически не различались (табл. 3). Уровень креатинина крови был в пределах нормы или незначительно ее превышал. Пациентов с выраженной почечной недостаточностью из исследования исключали.
Уровень протеинурии во всех исследуемых группах варьировался от 0,35±0,03 ммоль/л в 1-й группе до 0,54±0,10 ммоль/л в 5-й (табл. 4), но эти различия не были статистически значимыми (t=0,94, p<0,05).
Определение наиболее важного показателя функционального состояния почек – клиренса креатинина показало, что у большинства больных этот показатель был в пределах нормы. Средние его значения в исследуемых группах варьировались от 95,8±2,4 мл/мин в 1-й группе (инсулин) до 73,5±2,6 – в 4-й (вилдаглиптин). Сниженные значения клиренса креатинина (менее 90 мл/мин) выявлены в 4-й (пиоглитазон) и 6-й (вилдаглиптин) группах.
Проведенный анализ показал, что изучаемые группы оказались сопоставимыми по основным демографическим и медицинским параметрам за исключением несколько большего количества больных с умеренным нарушением функции почек в группах пациентов, получавших пиоглитазон и вилдаглиптин. По механизму действия и изученным побочным эффектам эти препараты не оказывают прямого токсического влияния на почки. Следовательно, различия могут быть обусловлены основными патологическими процессами: СД, нефролитиазом и хроническим обструктивным пиелонефритом.
Пероральная гипогликемическая терапия, состав камней и литогенные свойства мочи
Во всех группах преобладали больные, имеющие уратные камни, что характерно для нефролитиаза на фоне нарушений углеводного обмена и соответствует результатам ранее проведенных исследований [10–12]. Их доля колебалась от 58,5% в 5-й группе (канаглифлозин) до 84,9% во 2-й (метформин).
Оксалатные камни выявлялись реже. Их доля колебалась от 8,9% во 2-й группе (метформин) до 25% в 6-й (вилдаглиптин).
Еще реже у больных СД2 имел место фосфатный нефролитиаз. Частота выявления фосфатных камней варьировалась от 6,2% во 2-й группе (метформин) до 17% в 5-й (канаглифлозин).
Относительная частота уратного нефролитиаза наиболее высокой оказалась у пациентов, получавших метформин, а наиболее низкой – у больных, получавших канаглифлозин и вилдаглиптин (χ2 – 15,79 при минимальной значимости 11,72, достоверность различий p<0,01 и χ2 – 8,97 при минимальной значимости 5,31, достоверность различий p<0,01 соответственно).

Таким образом, у больных, получавших для контроля гликемии метформин, имелась тенденция к более частому образованию уратных камней при снижении вероятности образования оксалатных и фосфатных камней. В то же время на фоне терапии канаглифлозином уменьшалась вероятность развития уратного нефролитиаза при возрастании доли оксалатных и фосфатных камней, у больных, получавших вилдаглаптин наряду с уменьшением вероятности развития уратного литиаза, повышалась вероятность формирования оксалатных конкрементов (табл. 4).
Полученные данные свидетельствуют о влиянии противодиабетической терапии на распределение почечных конкрементов по химическому составу, на относительный риск формирования камней той или иной структуры. Между тем нельзя говорить, что какой-либо препарат увеличивает или уменьшает абсолютный риск нефролитиаза. Для такого заключения требуется существенно изменить дизайн исследования и контрольную группу формировать из пациентов, страдающих СД2, получающих изучаемые препараты, но не имеющих мочекаменной болезни.
Влияние пероральных сахароснижающих средств на литогенные свойства мочи
«Литогенные свойства мочи» – это принятое в современной урологии обобщающее понятие, объединяющее ряд функциональных почечных показателей, влияющих на камнеобразование. Уровень почечной экскреции солей, реакция утренней порции мочи, скорость клубочковой фильтрации позволяют с большой вероятностью предсказывать возможное рецидивирование нефролитиаза определенного химического состава.
В клинической практике оценка литогенных свойств мочи дополняется исследованием сывороточной концентрации электролитов и ионов, участвующих в камнеобразовании, что повышает ценность исследования и в ряде случаев позволяет рекомендовать метафилактические мероприятия, даже не прибегая к спектральному анализу камня. Определение основных показателей электролитного состава крови не выявило достоверных различий (табл. 5). Концентрация натрия, калия, кальция, фосфора, магния и хлора в крови всех пациентов была в пределах нормы.
Анализ влияния пероральных гипогликемических препаратов на литогенные свойства мочи показал, что все они в разной степени влияют на отдельные литогенные факторы (табл. 6).
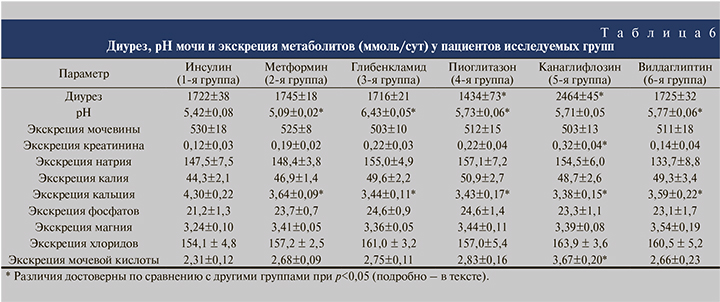
Параметры мочи у больных 1-й группы, которым для контроля гликемии назначали инсулин, считались контрольными значениями, с которыми сравнивали данные других исследуемых групп. Гипогликемическая терапия больных 2-й группы, получавших метформин, приводила к достоверному закислению мочи и снижению экскреции кальция с мочой. У больных 3-й группы, получавших глибенкламид, отмечено защелачивание мочи, а также произошло снижение экскреции кальция с мочой. У больных 4-й группы, получавших пиоглитазон, происходило снижение диуреза в среднем на 16,7 % (p<0,05) с повышением относительной плотности мочи в среднем до 1024 по сравнению с 1020–1021 в 1-й, 2, 3 и 6-й группах (p<0,05). При этом также отмечено достоверное снижение экскреции кальция с мочой. В 5-й группе (канаглифлозин) в отличие от 4-й (пиоглитазон) происходило увеличение диуреза на 43%, что было связано с индуцированным осмотическим диурезом вследствие ингибирования реабсорбции глюкозы в проксимальном канальце.
В соответствии с этим отмечена более высокая относительная плотность мочи по сравнению с 1-й, 2, 3 и 6-й группами (1023 против 1020–1021; p<0,05) за счет повышенной концентрации глюкозы в моче.
В связи с повышенным диурезом у этих больных имело место увеличение экскреции креатинина (p<0,05) и мочевой кислоты с мочой (p<0,05). Суточная экскреция кальция, как и в других группах, оказалась сниженной (p<0,05). У больных 6-й группы, получавших вилдаглиптин, все показатели за исключением экскреции кальция с мочой, которая также оказалась сниженной по сравнению с контролем, не отличались от значений контрольной и остальных групп. По таким параметрам, как экскреция мочевины, натрия, калия, хлоридов, неорганического фосфата и магния, достоверных различий между группами не выявлено. Диурез в 1-й, 2, 3 и 6-й группах был примерно одинаковым. В 4-й группе он был достоверно снижен, в 5-й группе – достоверно повышен по сравнению с пациентами, получавшими инсулин.
Значения рН утренней порции мочи в 3-й (пиоглитазон) и 6-й (вилдаглиптин) группах были достоверно выше, чем у больных 1-й группы (инсулин), составив 5,73±0,06 и 5,77±0,06 соответственно против 5,42, однако эти изменения не выходили за пределы нормальных значений.
В группе получавших канаглифлозин значения рН мочи недостоверно отличались от контрольных значений. В то же время у больных 2-й группы (метформин) наблюдалось значительное снижение рН мочи (5,09±0,02), свидетельствуя о ее закислении, у больных 3-й группы, получавших глибенкламид, наоборот, происходило защелачивание мочи (6,43±0,05).
Суточная экскреция кальция во всех исследуемых группах оказалась ниже, чем в контрольной группе.
Обсуждение. В плане обсуждения целесообразно проанализировать факторы, потенциально влияющие на риск камнеобразования у больных, получающих различные пероральные гипогликемические средства.
У больных, принимающих метформин, ключевым фактором, влияющим на камнеобразование, следует считать закисление мочи, потенциально способствующее образованию уратов. Считается, что в основе формирования мочекислых камней лежат три патофизиологических механизма: 1) гиперурикозурия, 2) резко кислая реакция мочи, 3) низкий диурез с высокой плотностью мочи. При этом высокая кислотность мочи считается наиболее важным патогенетическим фактором [13, 14]. У пациентов, страдающих СД2, имеется склонность к закислению мочи, предположительно связанная с наличием инсулинорезистентности [13, 15–17], а длительная терапия метформином склонна еще больше усиливать эту тенденцию, повышая риск уратного нефролитиаза. Однако на фоне терапии метформином отмечается снижение почечной экскреции кальция, что снижает риск (по крайней мере относительный риск) образования кальций-оксалатных и кальций-фосфатных камней. Сопоставление мочевых факторов риска нефролитиаза и состава почечных конкрементов продемонстрировало наиболее высокий процент уратных камней. По сравнению с контрольной группой больных, получавших инсулин, различия оказались статистически незначимыми, но по сравнению с другими группами выявились статистически значимые различия. В то же время относительная частота оксалатных и фосфатных камней в этой группе была наименьшей, что в целом соответствовало выявленному влиянию препарата на состав мочи.
В группе получавших глибенкламид отмечено защелачивание мочи по сравнению с контролем, что потенциально может способствовать усилению кристаллизации оксалатов и фосфатов. Патофизиология кальций-оксалатного нефролитиаза помимо изменения реакции мочи включает повышенную экскрецию промоутеров литогенеза (кальция, оксалатов, мочевой кислоты и др.) при снижении экскреции ингибиторов [18, 19]. В то же время изменения этих показателей у большинства больных не выходили за пределы нормы, экскреция кальция с мочой снижалась, что являлось благоприятным фактором.
В результате пропорциональное распределение мочевых камней по минеральному составу существенно не отличалось от такового в контрольной группе.
Негативным фактором в отношении потенциального камнеобразования на фоне приема пиоглитазона служит более высокая концентрация мочи. Имеется склонность к уменьшению клубочковой фильтрации. У больных этой группы отмечена наиболее высокая частота оксалатного нефролитиаза (20% от общего количества камней), хотя статистический анализ не выявил достоверных различий по сравнению с другими группами. Благоприятным фактором служит снижение экскреции кальция с мочой.
У пациентов, получавших канаглифлозин, отмечено увеличение диуреза, что считается благоприятным фактором камнеобразования. Потенциально негативным моментом может считаться увеличение экскреции мочевой кислоты, что может быть одним из факторов риска уратного нефролитиаза. Однако при нормальных значениях рН мочи его роль проявляется не так выраженно. Отражением этого служит значительно менее частое выявление у этих больных уратных мочевых камней (58%) по сравнению с другими группами.
В группе получавших вилдаглиптин не отмечено значимого влияния препарата на риск камнеобразования. Распределение камней, выявленных у этих больных, по минеральному составу не отличалось от такового в контрольной группе, хотя по сравнению со 2-й группой (метформин) имела место более низкая частота формирования уратных камней.
Заключение. На основании проведенного исследования можно сделать следующий вывод: лекарственная терапия СД2 существенно влияет на свойства мочи у больных нефролитиазом, что обязательно должно учитываться при метафилактике. В ряде случаев может оказаться целесообразным пересмотр схемы терапии СД с учетом функционального состояния почек.
Наиболее важный, на наш взгляд, вывод состоит в том, что метформин как препарат первого ряда при лечении СД в условиях нефролитиаза требует осмотрительного назначения. Метформин продемонстрировал склонность закислять мочу, что негативно отражается на течении уратного нефролитиаза, который доминирует по частоте распространенности при сопутствующем СД2. Дополнительными факторами риска могут оказаться снижение фильтрационной функции почек, рецидивирующий подагрический артрит, тофусы, рентгенонегативный нефрокальциноз, т.е. признаки глубокого нарушения пуринового обмена [20]. Если форма нефролитиаза неизвестна (такое в общемедицинской практике встречается нередко), целесообразно воздержаться или хотя бы минимизировать дозировку метформина, комбинируя его с более безопасными с точки зрения нефролитиаза препаратами, например вилдаглиптином. Очень нежелательно назначение метформина, если у пациента на фоне нефролитиаза в серии общих анализов мочи стойко прослеживается резко кислая реакция мочи.
Производные сульфонилмочевины, в частности глибенкламид, в связи с защелачиванием мочи могут потенциально повышать риск образования кальций-оксалатных камней. Однако риск этот относительно невелик, поскольку изменения рН мочи под влиянием препарата не выходят за пределы нормальных значений. Препараты группы тиазолидиндионов, в частности пиоглитазон, за счет задержки жидкости и формирования более концентрированной мочи в целом нежелательны при любой форме нефролитиаза. Повышение плотности мочи является важным, но отнюдь не определяющим фактором образования камней различного минерального состава. В связи с этим данное свойство препарата скорее является одним, причем далеко не самым главным аргументом при выборе лекарственной терапии, а не жестким противопоказанием.
Ингибиторы натрий-глюкозного котранспортера II типа, в частности канаглифлозин, за счет осмотического диуреза снижают концентрацию солей в моче, что снижает риск камнеобразования. Однако эти препараты усиливают почечную экскрецию мочевой кислоты, что при низких значениях рН (меньше 5,5) может повышать риск развития уратного нефролитиаза. Глифлозины нежелательны при существенном снижении фильтрационной функции почек, при часто рецидивирующем («злокачественном») уратном нефролитиазе, а также при всех других вариантах подагрической нефропатии.
Ингибиторы дипептидилпептидазы-4, к которым относится вилдаглиптин, не оказывают существенного влияния на литогенные свойства мочи и не влияют на риск камнеобразования у больных СД2, что позволяет рекомендовать эти лекарственные средства к более широкому применению при сочетании СД2 и нефролитиаза любой формы.



