Введение. Рак предстательной железы (РПЖ) – одно из наиболее часто выявляемых злокачественных новообразований и ведущих причин онкологической смертности среди мужчин во многих странах мира [1]. В России, несмотря на уменьшение доли больных с впервые выявленной IV стадией опухолевого процесса (с 19,7% в 2007 г. до 18,1% в 2017-м), продолжают регистрировать увеличение смертности от РПЖ (на 13,85% за 10 лет), что может быть связано как с высокой частотой генерализации процесса после радикального лечения больных локализованной и местнораспространенной стадиями, так и с ограниченной эффективностью стандартных подходов к лечению распространенного РПЖ.
С учетом гормональной зависимости опухоли от андрогенов «золотым» стандартом лечения больных метастатическим РПЖ (мРПЖ) на протяжении более 70 лет оставалась гормональная андрогендепривационная терапия (АДТ), направленная на подавление уровня тестостерона до кастрационного порога (менее 50 нг/дл, или 1,7 нмоль/л) [2]. Ответ на АДТ в 1-й линии лечения достигается более чем у 90% пациентов, однако среднее время до развития резистентности к АДТ (кастрационной резистентности) составляет 2 года [3, 4], 5-летняя общая выживаемость (ОВ) – лишь 29% [5]. К независимым факторам неблагоприятного прогноза, ассоциированным со снижением ОВ, относят наличие висцеральных метастазов, число (более 5) и локализацию костных метастазов, высокую степень злокачественности (низкодифференцированная градация) опухоли [6].
В последние годы предложены новые подходы к 1-й линии лечения гормоночувствительного мРПЖ, основанные на данных крупных рандомизированных клинических исследований, продемонстрировавших значительное увеличение продолжительности жизни, времени до развития кастрационно резистентного РПЖ (КРРПЖ) и клинического прогрессирования у больных мРПЖ при раннем начале химиотерапии доцетакселом или антиандрогенной терапии абиратероном в дополнение к стандартной АДТ [7–9]. Согласно рекомендациям ведущих профессиональных сообществ (EAU, ESMO, NCCN), всем больным впервые выявленным мРПЖ показано проведение комбинированной терапии, однако в подгруппе пациентов с незначительной распространенностью метастатического поражения (low volume disease) целесообразно использование индивидуального подхода при выборе терапии (АДТ или комбинированной) с учетом хорошего прогноза и отсутствия достоверных различий в ОВ у данной категории больных, показанных в исследовании CHAARTED [10, 11].
Для определения индивидуальной стратегии лечения предложено применение валидированных факторов неблагоприятного прогноза (распространенность, низкодифференцированная градации опухоли), но перспективным представляется использование современных молекулярно-генетических маркеров [12]. Герминальные мутации в генах BRCA1 и BRCA2 ассоциированы с агрессивным клиническим течением заболевания и снижением выживаемости больных после радикального лечения РПЖ [13–15].
В проведенном нами ранее исследовании выявлено неблагоприятное влияние герминальных мутаций в гене CHEK2 у больных РПЖ на отдаленные результаты – снижение безрецидивной и безметастатической выживаемости после радикального лечения [16].
Целью настоящего исследования было оценить прогностическую значимость герминальных мутаций в генах BRCA1, BRCA2 и CHEK2 на время до развития кастрационной резистентности у больных мРПЖ, получавших АДТ в 1-й линии системного противоопухолевого лечения.
Материалы и методы. В проспективный анализ были включены данные 76 пациентов с мРПЖ, которым проводилась гормональная терапия аналогами лютеинизирующего гормона рилизинг-гормона (ЛГРГ) и которые находились под наблюдением в НМИЦ онкологии им. Н. Н. Блохина. Критерии исключения: тяжелый общесоматический статус EGOG >2; наличие декомпенсированной почечной, печеночной или другой органной недостаточности; наличие протоковой аденокарциномы и других редких гистологических вариантов РПЖ, ассоциированных с неблагоприятным прогнозом; раннее начало химиотерапии или антиандрогенной терапии абиратероном при гормоночувствительном мРПЖ. У всех пациентов подтверждено наличие отдаленных метастазов и оценена степень распространенности метастатического поражения: за незначительную степень распространенности принимали отсутствие висцеральных метастазов и минимальное поражение костей (менее 4 метастазов в костях); за значительную распространенность – наличие висцеральных метастазов и/или множественных (более 4) метастазов в костях скелета, из которых как минимум один метастаз определяется вне костей таза или позвоночника. Гистологическую градацию опухоли определяли согласно обновленной классификации Международного общества уропатологов (ISUP) и классификации TNM 8-го издания [17]. Кастрационную резистентность подтверждали в соответствии со стандартными критериями [2].
Всем пациентам провели ДНК-диагностику с целью выявления герминальных клинически значимых мутаций 1100delC, I157T и IVS2+1G>A в гене CHEK2, мутаций 185delAg, 4153delA, 5382insC, 3875del4, 3819del5, C61G, 2080delA в гене BRCA1 и мутации 6174delT в гене BRCA2 с помощью ПЦР в режиме реального времени (панель «Онко-генетика», регистрационное удостоверение № ФСР 2010/08415). Вторым этапом определяли кодирующие части генов BRCA1 и BRCA2 с использованием метода секвенирования по Сэнгеру (Beckman Coulter enomeLab GeXP).
В анализ были включены мутации, определяемые как патогенные (клинически значимые) или возможно патогенные (с неопределенным значением, variants with uncertain significance – VUS).
Статистическую обработку материалов исследования проводили с помощью пакета прикладных программ IBM SPSS Statistics, версия 22 (IBM Corp., США). Для выявления различий между качественными показателями пациентов различных групп применяли точный критерий Фишера. Медиану времени до развития КРРПЖ оценивали по методу анализа выживаемости Каплана–Майера, статистические различия между группами – с помощью log-rank-теста. С целью оценки потенциального влияния различных факторов риска на выживаемость до КРРПЖ проводили однофакторный анализ с использованием непараметрической модели пропорциональных рисков Кокса. В многофакторную модель были включены факторы риска с наиболее значимым влиянием на выживаемость (p<0,05). Статистически значимыми считали различия при р<0,05 (95% уровень значимости).
Результаты. При генотипировании герминальные мутации в генах BRCA2 и CHEK2 выявлены у 19 (25%) пациентов (табл. 1). Случаев мутаций в гене BRCA1 не обнаружено. Наиболее распространенными были миссенс-мутации I157T (c.470T>C, rs17879961) в гене CHEK2 и N372H (c.1114A>C, rs144848) в гене BRCA2 (9,21% для каждой мутации).
В зависимости от результатов генотипирования пациенты были распределены в 2 группы: группу носителей герминальных мутаций в гене CHEK2 или BRCA2 –mtBRCA2(+)/mtCHEK2(+), 19 человек, и группу пациентов без выявленных герминальных мутаций – mtBRCA(-)mtCHEK2(-), 57 человек. Частота низкодифференцированных форм опухоли была выше в группе mtBRCA2(+)/mtCHEK2(+) (68,4 против 40,4%, отношение рисков [ОР]=1,70, 95% доверительный интервал [ДИ] – 1,093–2,63, р=0,062). По остальным клиническим характеристикам пациентов группы были сбалансированными (табл. 2).

При медиане наблюдения 34,79 мес. (интерквартильный интервал [IQR]=17,74–58,62 мес.) кастрационная резистентность зарегистрирована у 17 (89,5%) пациентов группы mtBRCA2(+)/mtCHEK2(+) и у 28 (49,1%) – группы mtBRCA2(-) mtCHEK2(-).
Медиана времени до развития КРРПЖ у всех пациентов составила 32,95 мес. (95% ДИ – 15,71–50,19), была достоверно выше при mtBRCA2(-)mtCHEK2(-) – 48,66 мес. (95% ДИ – 31,05 – 68,26), чем при mtBRCA2(+)/mtCHEK2(+) – 7,93 мес. (95% ДИ – 2,62 – 13,25, p<0,001; рис. 1, а).

При подгрупповом анализе выявлено, что медиана времени до развития КРРПЖ у больных мРПЖ незначительной распространенности метастатического поражения была 48,66 мес. (95% ДИ – 45,30–52,02): была достоверно меньше при mtBRCA2(+)/mtCHEK2(+), составив 7,93 мес. (95% ДИ – 3,51–12,36), чем при mtBRCA2(-)/mtCHEK2(-), – 54,53 мес. (95% ДИ – 38,80– 0,26, р<0,001). Шестимесячная выживаемость до КРРПЖ в обеих группах составила соответственно 61,5±13,5 и 97,4 2,6%, однолетняя – 28,8±13,1 и 91,8±4,5% (рис. 1, б).
В подгруппе пациентов мРПЖ со значительным объемом метастатического поражения медиана времени до развития КРРПЖ составила 16,13 мес. (95% ДИ – 11,74–20,52), была также ниже при mtBRCA2(+)/mtCHEK2(+) – 6,1 мес. (95% ДИ – 0,00–24,52), чем при mtBRCA2(-)/mtCHEK2(-), – 16,13 мес. (95% ДИ – 11,22–21,04), однако из-за малой выборки различие не достигло статистической значимости (p=0,359 log-rank тест). Шестимесячная выживаемость до КРРПЖ в обеих группах составила соответственно 100 и 66,7±19,2% (рис. 1, в).
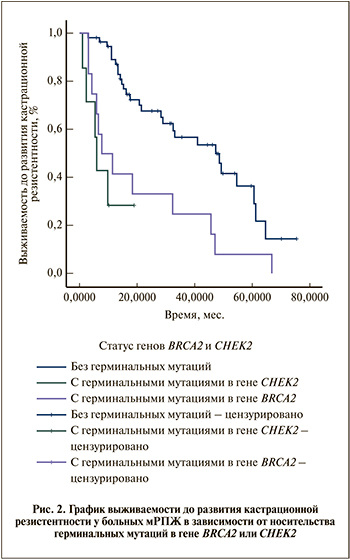 Выявлено отсутствие значимых различий в выживаемости больных до КРРПЖ в подгруппе mtCHEK2(+) (медиана – 6,07 мес., 95% ДИ – 0,00 – 16,28; р=0,448, рис. 2), при наличии достоверных отличий от группы mtBRCA2(-)/mtCHEK2(-) (p<0,001 и 0,002 соответственно).
Выявлено отсутствие значимых различий в выживаемости больных до КРРПЖ в подгруппе mtCHEK2(+) (медиана – 6,07 мес., 95% ДИ – 0,00 – 16,28; р=0,448, рис. 2), при наличии достоверных отличий от группы mtBRCA2(-)/mtCHEK2(-) (p<0,001 и 0,002 соответственно).
Раннее наступление кастрационной резистентности в течение первого года АДТ чаще отмечалось при mtBRCA2(+)/mtCHEK2(+) (66,7%) по сравнению с группой без мутаций (11,1%, ОР=6,00, 95% ДИ – 2,64–13,65, р<0,001), в том числе у больных с незначительной распространенностью метастатического поражения (ОР=8,75, 95% ДИ – 2,83–27,09, р<0,001). Наступление КРРПЖ в течение первых 2 лет АДТ также чаще отмечалось в группе mtBRCA2(+)/mtCHEK2(+) (ОР=2,15, 95% ДИ – 1,34–3,45, р=0,005).
По данным моновариантного анализа Кокса, герминальные мутации в генах BRCA2 и CHEK2, так же как низкодифференцированная градация опухоли и значительная распространенность метастатического поражения, являются фактором неблагоприятного прогноза, ассоциированным со снижением выживаемости до развития КРРПЖ (р=0,003 для mtBRCA2(+), p<0,001 для mtCHEK2(+) соответственно, табл. 3). Мультивариантный анализ подтвердил независимую прогностическую значимость на время до развития КРРПЖ для трех факторов: значительной распространенности метастатического поражения (ОР=2,53, 95% ДИ – 1,32–4,86, р=0,005), герминальных мутаций в гене BRCA2 (ОР=2,63, 95% ДИ – 1,32–5,26, р=0,006) и гене CHEK2 (ОР=6,66, 95% ДИ – 2,35–18,89, р<0,001). Для подгруппы больных мРПЖ с незначительной распространенностью метастатического процесса независимыми факторами, ассоциированными со снижением выживаемости до развития КРРПЖ, являются герминальные мутации в генах BRCA2/CHEK2 (ОР=4,59, 95% ДИ – 2,06–10,22, р<0,001) и низкодифференцированная гистологическая градация (ОР=2,56, 95% ДИ – 1,12–5,86, р=0,026).
Обсуждение. Молекулярные перестройки в генах репарации ДНК, значительную часть из которых составляют наследуемые мутации, у пациентов с мРПЖ встречаются довольно часто (до 20–30%) [18]. Так, по данным C. C. Pritchard et al. [19], при генотипировании 692 пациентов с мРПЖ герминальные мутации в этих генах были выявлены в 11,8% случаев, преимущественно в генах BRCA2 (5,3%), ATM (1,6%), CHEK2 (1,9%) и BRCA1 (0,9%), и их частота не зависела от наличия семейной отягощенности РПЖ или возраста начала заболевания. Проведены исследования, продемонстрировавшие независимое неблагоприятное влияние мутаций в генах BRCA1/2 на отдаленные результаты радикального лечения при локализованных формах РПЖ – снижение выживаемости без метастатического прогрессирования заболевания и опухолевоспецифической выживаемости пациентов. Однако до настоящего времени остается малоизученным прогностическое влияние мутаций в генах репарации ДНК на клиническое течение заболевания при метастатическом гормоночувствительном РПЖ. В международных базах данных представлены лишь отдельные исследования и описания клинических наблюдений, причем целью исследований становится оценка выживаемости пациентов уже на стадии КРРПЖ. Анализ данных о предшествовавшей АДТ считается редким исключением.
Единственным исследованием, в котором представлен сравнительный анализ времени до развития КРРПЖ у пациентов в зависимости от наличия герминальных мутаций, остается работа из Vancouver Prostate Center с участием 319 больных мКРРПЖ [20]. Всем пациентам проводилось генотипирование с определением кодирующей части 73 РПЖ-ассоциированных генов, включая 22 гена репарации ДНК. Герминальные мутации делеции в генах репарации ДНК выявлены у 24 (7,5%) больных: преимущественно в гене BRCA2 (16/322, 5%), реже – в генах PALB2, CDK2 (оба 0,6%), BRCA1, ATM (оба 0,3%) и др. Случаев носительства мутаций-делеций в гене CHEK2 не установлено. При анализе исходных клинических характеристик пациентов обнаружено существенное уменьшение времени до развития кастрационной резистентности у пациентов с герминальными мутациями (медиана – 11,8 мес., 95% ДИ – 5,1–18,4) по сравнению с группой без мутаций (медиана – 19,0 мес., 95% ДИ – 15,4 – 22,6; р=0,031). Выживаемость без прогрессирования (ВБП) на первой линии антиандрогенной терапии мКРРПЖ энзалутамидом или абиратероном также была ниже в группе пациентов с герминальными мутациями (медиана – 3,3 мес., 95% ДИ – 2,7–3,9 против 6,2 мес., 95% ДИ – 5,1–7,3 в группе без мутаций; р=0,01).
В исследовании [21] медиана времени ответа на АДТ у больных РПЖ с герминальными мутациями в генах репарации ДНК составила 2,1 года и значимо не отличалась от соответствовавшего показателя в группе пациентов без мутаций (р=0,458), однако для правильной интерпретации данных необходимо, во-первых, принимать во внимание, что АДТ, вероятно, проводилась большинству пациентов в адъювантном режиме (так как 50% выполнена предшествовавшая радикальная лучевая терапия, у 78,9% была первично местнораспространенная стадия T3/T4), во-вторых, учитывать профиль мутантных генов: из 22 носителей мутаций лишь у 5 (22,7%) был статус mtBRCA(+), у 1 (4,5%) – mtCHEK2(+), все остальные случаи представлены мутациями в генах ATM, FANCL и др. По данным другого ретроспективного исследования [22], мутации в генах репарации ошибочно спаренных нуклеотидов (mismatch repair genes, MMR) служат благоприятным прогностическим фактором для больных мРПЖ: несмотря на крайне неблагоприятные клинико-морфологические характеристики заболевания (висцеральные метастазы у 31% пациентов, индекс Глисона 9–10 у 75%, внутрипротоковый рак у 23%), от носителей мутаций в генах MMR достигнут неожиданно длительный ответ на АДТ (медиана ВБП – 66 мес, 95% ДИ – 55–77 по сравнению с 27 мес. в группе без мутаций в генах MMR, 95% ДИ – 22–32) и последующая антиандрогенная терапия энзалутамидом/абиратероном в первой линии лечения мКРРПЖ (медиана ВБП – 26 мес., 95% ДИ – 6–верхняя граница не достигнута, по сравнению с 12 мес. в группе без мутаций, 95% ДИ – 10–14). Четырем пациентам проведена иммунотерапия ингибиторами PD-1 в 4–6-й линиях лечения: от 2 достигнут ПСА-ответ ≥50% к 12-й неделе терапии, от 3 – объективный ответ по критериям RECIST, медиана ВБП составила 9 мес. (95% ДИ – 4–11 мес.).
Прогностически более неблагоприятное влияние mtBRCA2(+) по сравнению с мутациями в других генах репарации ДНК было также продемонстрировано в многоцентровом наблюдательном исследовании PROREPAIR-B, главной целью которого была сравнительная оценка опухолевоспецифической выживаемости 419 больных мКРРПЖ в зависимости от носительства герминальных мутаций в генах репарации ДНК (BRCA1/2, ATM и PALB2), получавших любую из опций противоопухолевого лечения (химиотерапию, энзалутамид, абиратерон, радий-223) [23]. Согласно исходным клиническим характеристикам пациентов, медиана времени до развития КРРПЖ у носителей мутаций составила 23,7 мес., у пациентов без мутаций – 26,7 мес. (р=0,22), однако только в подгруппе mtBRCA2(+) была ниже и составила 18,0 мес. Важно отметить, что результаты исследования показали отсутствие значимых различий в опухолево-специфической выживаемости пациентов основных групп, однако подгруппа mtBRCA2(+) была достоверно ассоциирована со значительным уменьшением медианы выживаемости (17,4 против 36,0 мес. в группе без мутаций, р=0,02), в том числе среди получавших химиотерапию 1-й линии (12,8 против 24,5 мес, р<0,01).
Раннее развитие КРРПЖ у носителей мутаций в гене BRCA2 также обнаружено в отдельных наблюдениях [24–26]. Так, по данным Y. Ma, несмотря на умеренную степень дифференцировки (индекс Глисона 7 (4+3) и отсутствие висцеральных метастазов на момент начала лечения, ответ на АДТ у больного мРПЖ с герминальной мутацией G1761X (c.G5281T) в гене BRCA2 продолжался 4,3 мес., в то же время длительность ответа на комбинированную терапию с PARP-ингибитором, назначенную в 6-й линии лечения этому пациенту, составила 6 мес. и сопровождалась частичным регрессом метастазов в печени, снижением уровня ПСА в 7 раз. Аналогичная длительность (4 мес.) ответа на АДТ была получена в наблюдении за больным мРПЖ с изолированным метастатическим поражением скелета, у которого при генотипировании биопсиийного материала из костного метастаза была выявлена соматическая мутация c.4723G>T (rs879255389) в гене BRCA2 [27].
Заключение. Результаты нашего исследования и зарубежных публикаций подтверждают ограниченную эффективность стандартных подходов к лечению гормоночувствительного мРПЖ, в том числе при незначительной распространенности метастатического поражения, у носителей герминальных мутаций в генах репарации ДНК BRCA2 и CHEK2. Мутации в генах BRCA2 и CHEK2 ассоциированы с повышенным риском раннего наступления КРРПЖ в течение первых 2 лет гормональной терапии мРПЖ. Оценка прогностического значения мутаций в других генах репарации ДНК требует дополнительных исследований.
Кроме прогнозирования течения заболевания ДНК-диагностика молекулярных маркеров при РПЖ может быть полезной для определения стратегии и тактики лечения пациентов на основе индивидуального генотипа. Полученные результаты могут служить обоснованием к проведению дальнейших исследований, направленных на изучение эффективности комбинированной противоопухолевой терапии данной категории пациентов.



