Актуальность. Цистоскопия – одна из наиболее частых инвазивных лечебно-диагностических процедур как в амбулаторной, так и в стационарной практике [1, 2]. Введение цистоскопа по уретре сопровождается болью, выраженность которой зависит и от пациента, и от опыта врача, выполняющего манипуляцию [1, 3]. Несмотря на то что представленные выше факторы довольно субъективны, разработка методик уменьшения боли во время и в ближайшее время после процедуры не теряет актуальности [4].
К объективным факторам, обусловливающим болезненные ощущения, относят скольжение (степень смазки инструмента), наличие местного анестетика, продолжительность манипуляции [5–7]. Единого подхода к обезболиванию при цистоскопии нет, и решение, как правило, остается за врачом или принимается совместно с пациентом [4, 8, 9]. Осложняется это еще и тем, что в литературе имеются различные описания методик обезболивания и противоречивые данные об их эффективности. Тем не менее в целом авторы делают вывод о снижении уровня боли и дискомфорта [5–9].
По мнению ряда авторов, в большинстве случаев бывает достаточно местного обезболивания любрикантом [10]. В литературе можно встретить противоречивые данные об эффективности различных внутриуретральных гелей в зависимости от их дозировки, температуры и времени экспозиции [11, 12]. В рандомизированном исследовании [11] при сравнении 2%-ного лидокаинового геля в объеме 10 и 20 мл с любрикантом, не содержащим действующих веществ, получен сопоставимый обезболивающий эффект. В мета-анализе [12], напротив, продемонстрирована эффективность любриканта с лидокаином. В то же время мета-анализ, представленный A. R. Patel et al. [13], не выявил статистически значимых различий уровня боли при использовании гелей с лидокаином по сравнению с гелями без анестетика при эндоскопическом исследовании уретры и мочевого пузыря.
Параллельно с демонстрацией эффективности любрикантов с лидокаином для обезболивания при цистоскопии публикуются работы, посвященные поиску иных способов снижения боли. В литературе представлены следующие сообщения: о нестероидных противовоспалительных препаратах (НПВП) [4], внутривенной седации [14] и даже об ингаляционной анальгезии оксидом азота [5]. Имеются упоминания об использовании различных НПВП (диклофенак, залтопрофен) при использовании per os и per rectum [15–17]. Авторы приводят положительные результаты применения НПВП по сравнению с плацебо и лидокаиновым гелем. Еще меньше данных относительно эффективных мер по снижению боли и/или дискомфорта после проведенной цистоскопии, а также облегчения первого мочеиспускания после этого вида исследований [4].
Довольно давно в урологической практике применяют феназопиридин. Выделяясь с мочой, он воздействует на слизистую оболочку нижних мочевыводящих путей, где оказывает местный анальгетический эффект. Это действие помогает уменьшать выраженность дизурических явлений, в том числе боли, жжения, учащенного мочеиспускания [18].
Цель исследования: оценить эффективность использования феназопиридина для превентивной анальгезии и обезболивания в раннем периоде после цистоскопии у женщин.
Материалы и методы. В проспективное сравнительное рандомизированное исследование включены 97 пациенток, которым предстояло перенести смотровую цистоскопию. Показания к цистоскопии: гематурия, симптомы нарушенного мочеиспускания/боль, удаление уретрального стента. Перед цистоскопией всем участницам исследования выполнен общий анализ мочи и ее посев на микрофлору.
Критерии исключения: аллергия на лидокаин, возраст младше 18 и старше 65 лет, обострение уроинфекции, хронические соматические заболевания в стадии декомпенсации, нарушение функции печени и почек, анемия, беременность и лактация, дефицит глюкозо-6-фосфатдегидрогеназы, цистоскопия в анамнезе.
Пациентки были рандомизированы в две группы. Перед процедурой им предлагали опорожнить мочевой пузырь. В качестве местного обезболивающего препарата в обеих группах непосредственно перед цистоскопией применяли лидокаиновый гель в объеме 10 мл.
В основной группе (n=50) пациентки дополнительно принимали феназопиридин 200 мг (2 таблетки) за 20 мин до цистоскопии, затем в той же дозе каждые 8 ч еще 2 раза.
В контрольной группе (n=47) применяли только гель с лидокаином непосредственно перед цистоскопией.
Непосредственно перед и после процедуры оценивали у всех пациенток частоту пульса. Непосредственно после процедуры, через 3 ч (с оценкой первого мочеиспускания после манипуляции), 8 и 24 ч пациенткам предлагали 10-балльную визуально-аналоговую шкалу (ВАШ) с уменьшенным для большей дискретности до 0,5 пункта шагом. «0» означал отсутствие неприятных ощущений, «10» – максимальную выраженность боли, когда-либо испытанную пациенткой.
Статистический анализ проводили посредством инструментов программы Statistica10.0 for Windows с применением непараметрических критериев. Количественные величины представлены в виде М±m (Ме, 95% доверительный интервал (ДИ)), где М – среднее арифметическое; m – стандартное отклонение среднего; Me – медиана.
Результаты. Статистически значимых различий по возрасту; причинам, послужившим причиной проведения цистоскопии; времени, затраченному на исследование; пульсу перед процедурой не было (p>0,5; табл. 1).

Результаты оценки уровня боли по ВАШ были предоставлены всеми участницами исследования (табл. 2).
В обеих группах отмечена статистически значимая (р<0,001) положительная динамика снижения уровня боли и дискомфорта после цистоскопии. В то же время представляют интерес межгрупповые различия на разных сроках исследования. Так, сразу после процедуры разница в среднем уровне баллов составила 27,7 % в пользу основной группы при медиане 3,0 и 4,0 соответственно (р<0,001). Через 3 ч средний балл в основной группе был в 2 раза меньше, чем в контрольной (р=0,012; см. табл. 2). В дальнейшем разница по этому показателю между группами увеличивалась при сохранении той же степени значимости статистических различий.
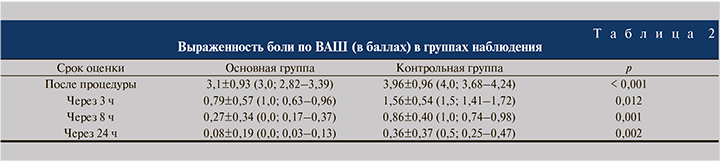
Однако стоит отметить, что уровень боли в 0,27 и 0,86 балла (результаты в группах через 8 ч) и 0,08 и 0,36 (через 12 ч) для пациентки, быть может, и не различим, но различия все же были статистически значимыми (р<0,01).
В связи с этим представляет интерес доля «нулевых» результатов, т.е. число пациенток, субъективно не испытывающих дискомфорта. Через 3 ч (т.е. уже после первого мочеиспускания) в контрольной группе не было респондентов с баллом «0» по ВАШ; в основной группе таких пациенток было 10 (р<0,005). В следующем сроке (8 ч) соотношение пациенток, не отметивших болевых ощущений, было 4 и 28 соответственно при том же уровне значимости статистических различий (р<0,005). Через сутки после исследования доля пациенток, не испытывавших болевых ощущений, увеличилась до 84,0 и 44,7% в основной и контрольной группах соответственно и достигло уровня тенденции к наличию статистически значимых различий (р<0,06).
Как было отмечено выше, различий в пульсе перед процедурой не было. После нее в основной и контрольной группах пульс составил 75,1±5,0 (76; 95% ДИ – 73,6–76,5) и 77,9±4,6 (78; 95% ДИ – 76,6–79,3) соответственно (р=0,016).
Обсуждение. В настоящей статье изложены результаты изучения обезболивающего эффекта предварительного применения феназопиридина с продолжением его приема в течение суток после цистоскопии. Были получены данные, свидетельствовавшие о достоверном снижении боли как во время самой процедуры, так и после первого мочеиспускания после цистоскопии, что мы считаем особенно ценным.
Известны различные подходы к обезболиванию при цистоскопии. Рандомизированное исследование A. R. Patel et al. [14], охватившее 817 случаев цистоскопии, не выявило преимуществ интрауретрального применения геля, содержавшего лидокаин, перед обычным гелем при оценке с помощью 100-балльной ВАШ. Безусловно, это расходится с устоявшимися представлениями клиницистов о необходимости применения любрикантов с анестетиком.
Для более дискретной оценки уровня боли и дискомфорта мы применили 10-балльную ВАШ с уменьшенным до 0,5 балла шагом. Важным результатом считаем облегчение первого после проведения эндоскопической манипуляции мочеиспускания: уровень боли был почти в 2 раза ниже при высоком уровне статистической значимости различий. Через 3 ч полностью отсутствовали «нулевые» значения в контрольной группе, в основной они встретились в 10 случаях (р<0,005). В дальнейшем к 24 ч наблюдения это соотношение составило 8,5 к 56,0% (р<0,005).
С точки зрения переносимости цистоскопии представляет интерес оценка реакции вегетативной нервной системы, которую косвенно можно оценить по изменению частоты пульса, тем более что эта оценка не часто встречается в иных подобных исследованиях [4]. Так, при исходно одинаковом пульсе (73–74 удара в минуту) в сравниваемых группах после цистоскопии частота статистически значимо увеличилась в контрольной, нежели в основной группе (р=0,016).
Из повседневной клинической практики мы знаем, что цистоскопия нередко является повторяемым исследованием (онкологические пациенты, рецидивирующее течение цистита и др.). Повторяемая, доставляющая мучения цистоскопия не может способствовать приверженности пациента к лечению. Muezzinoglu et al. указывают на потребность в более эффективной анестезии эндоскопического исследования мочевого пузыря в амбулаторной практике для повышения качества жизни и как следствие – для повышения приверженности пациента к лечению, сопряженному с необходимостью повторных цистоскопий [19]. Помимо обсужденных выше любрикантов имеются сообщения о применении в различных вариантах нестероидных противовоспалительных средств: разные пути введения, дозировки, действующие вещества, кратность применения [4, 15, 20, 21]. Обсуждаются различные варианты обезболивания с применением НПВП пациентами различных возрастов, поскольку более молодые имеют более низкий болевой порог и более высокую тревожность [4, 15].
В своей работе мы использовали иной подход. Феназопиридин назначали за 20 мин до исследования, затем еще дважды с интервалом 8 ч. Такой вариант приема апробирован эмпирически с учетом фармакодинамики и фармакокинетики действующего вещества, а также в целях предотвращения специфического окрашивания среды, описанного при приеме этого препарата, потенциально способного затруднить осмотр мочевого пузыря. Феназопиридин имеет период полувыведения 7,35 ч, быстро выделяется почками. На 90% выводится в течение суток при суточной дозировке 600 мг, при этом 41% в неизменном виде и 49% в виде метаболита. По данным экспериментальных исследований, феназопиридин снижает чувствительность слизистой нижних мочевыводящих путей, напрямую ингибируя Aδ волокна (быстрое проведение боли) [18].
Заключение. Прием феназопиридина перед цистоскопией и дважды с 8-часовым интервалом после процедуры позволяет эффективно снижать уровень дискомфорта/боли как во время, так и после процедуры, снижать болезненность мочеиспускания после цистоскопии и может быть рекомендован в том числе и для повышения приверженности пациента лечению.



