Введение. Ежегодно в мире первично диагностируют более 400 тыс. опухолей паренхимы почки, что составляет около 2–3% всех впервые выявленных онкологических заболеваний [1, 2]. Почечно-клеточный рак (ПКР) статистически занимает 10-е место в России среди других онкологических заболеваний [3]. При этом ПКР находится на 13-м месте по причине онкоспецифической смертности во всем мире [1, 2].
Для характеристики степени злокачественности светлоклеточного и папиллярного вариантов ПКР используется система морфологической оценки степени ядерной градации по Фурман. Согласно классификации, ПКР делится на четыре степени – 1-я и 2-я относятся к высокодифференцированным опухолям (high grade) с благоприятным прогнозом, 3-я и 4-я – низкодифференцированные новообразования (low grade), имеющие неблагоприятное течение [4, 5]. Оценка градации по Фурман является независимым прогностическим фактором [6]. Однако эта информация появляется в распоряжении врача-уролога уже после операции и не позволяет заранее определять тактику лечения пациента.
В последние десятилетия отмечается тенденция к увеличению верификации новообразований паренхимы почки размером до 4 см («малая» опухоль почки), что связано с широким использованием лучевых методов визуализации при наличии того или иного заболевания или подозрении на болезни других внутренних органов и систем [7].
В настоящее время приоритетной стратегией терапии локализованных новообразований паренхимы почки является хирургическое лечение, при этом от 10 до 30% от всех прооперированных образований морфологически верифицируются как доброкачественные опухоли [8, 9]. Количество «малых» опухолей почки, ежегодно удаляемых в США, показывало существенный рост среди доброкачественных новообразований с 2080 до 3393, ПКР очень низкого риска прогрессирования (сТ1а G1) с 3352 до 5452 и опухолей низкого риска (сТ1а G2) с 8512 до 13631 в период с 2000 по 2014 г. [10]. По данным ряда мировых исследователей, от 30 до 90% удаленных ПКР имеют низкий потенциал злокачественности [10–15]. Столь высокий уровень выявления доброкачественных и индолентных образований ставит под сомнение уместность хирургического вмешательства при любом подозрительном поражении, учитывая ряд возможных осложнений, связанных с оперативным вмешательством [10, 22].
Использование современных лучевых методов диагностики показывает высокий процент точности специфичности и чувствительности в диагностике новообразований паренхимы почки. Так, магнитно-резонансная томография (МРТ) и мультиспиральная компьютерная томография (МСКТ) с контрастированием имеют приблизительно одинаковый процент точности – 95–100% [16, 17, 19]. Однако необходимо отметить возможности этих методов в верификации гистологического типа опухоли гораздо ниже. Так, при выполнении МРТ с оценкой различных характеристик точность верификации составляет не более 86%, а для МСКТ – лишь 79% [17–19]. Позитронно-эмиссионная компьютерная томография (ПЭТ/КТ) показывает точность до 93,8% с одним радиофармпрепаратом, а при проведении нескольких серий ПЭТ с введением 2–3 радиоизотопов достигает 100% [20–22]. Однако дифференцированная морфологическая верификация ПКР при выполнении ПЭТ/КТ требует использования комбинации нескольких радио-фармпрепаратов. Тем самым затраты, продолжительность исследования и лучевая нагрузка на пациента увеличиваются.
Согласно клиническим рекомендациям, дооперационная морфологическая диагностика новообразований паренхимы почки не является обязательной и выполняется лишь по узким показаниям: пациентам с местнораспространенным ПКР для определения тактики лекарственной терапии, при планировании аблативных методов лечения и больным с множественными злокачественными опухолями для верификации диагноза [21].
При выполнении биопсии опухоли гистологические результаты по сравнению с окончательным морфологическим диагнозом выглядят недостаточно полноценными, чувствительность, специфичность и точность составляют 95,5%; 89,7%; 90,3% соответственно [21, 23, 24].
Достоверность диагностики степени ядерной анаплазии по Фурман варьируется от 46 до 85% [21–24]. Важно отметить, что биопсия дает лишь «точечную» оценку морфологии тканей и не характеризует опухоль целиком, ее результаты в 10–15% ошибочны или малоинформативны ввиду гетерогенности новообразования [21–25]. Кроме того, биопсия не всегда осуществима из-за топографоанатомических особенностей расположения опухоли, а сама процедура является инвазивной и сопровождается осложнениями с частотой от 0,4 до 4,9% [21–25].
В связи с этим превалирует необходимость дооперационного получения достаточно полной и достоверной информации о морфологии новообразований паренхимы почки без применения инвазивных манипуляций с риском осложнений для осуществления персонифицированного подхода к определению тактики лечения.
В последнее десятилетие с целью неинвазивной морфологической верификации в мире нашла свое применение современная технология радиомика [22, 26].
Данная технология включает количественную оценку лучевых методов визуализации – текстурный анализ (ТА) – в сопоставлении с клиническими, морфологическими генетическими и другими характеристиками пациента при помощи интеллектуального анализа [22, 26].
Для анализа изображения используются методики интеллектуальной оценки данных посредством компьютерных программ с применением статистики (первого, второго и высших порядков), моделей (создание модели, характерной для определенного изображения), метода преобразования (начертательная геометрия общего положения геометрической фигуры относительно плоскости проекции к частному) – DICOM (Digital Imaging and Communications in Medicine) [22, 26].
На данный момент в мире проведен ряд исследований, оценивающих возможности ТА 2D-DICOM данных МСКТ и/или МРТ и 3D-моделей опухолей в прогнозе морфологической верификации новообразований [27–29]. Работ с ТА в предикации степени анаплазии ядер светлоклеточного варианта ПКР мало, а результаты выполненных исследований неоднозначны [30–32]. В связи с чем сохраняется необходимость в выполнении дальнейших исследований, анализирующих возможности ТА в определении степени ядерной дифференцировки по Фурман.
Цель исследования. Оценить возможности текстурного анализа 3D-моделей патологического процесса в дифференцировке степени ядерной анаплазии светлоклеточного варианта почечно-клеточного рака (ПКР).
Материалы и методы. В ретроспективное исследование включены результаты хирургических пособий 190 пациентов, находившихся на лечении в Институте урологии и репродуктивного здоровья человека Сеченовского Университета за период с 2018 по 2022 г. (табл. 1). Все операции выполнены из лапароскопического доступа в объеме ОСО. Средний возраст пациентов составил 57,2± 10,8 года. Мужчин было 121 (63,6%), женщин – 69 (36,4%).
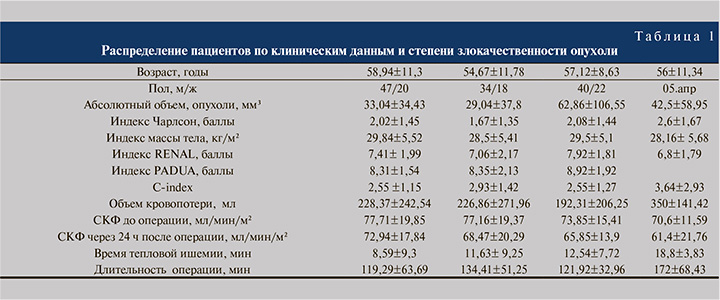
Для расчета абсолютного объема опухоли в мм3 использована формула: V=4/3πR3, где V – абсолютный обьем опухоли, π=3,14, R=(a+b+c):6; a, b, c – размеры опухоли три измерения опухоли, которые производились во взаимно перпендикулярных направлениях по данным выполненной МСКТ. Из учитываемых клинических данных кроме возраста и пола пациентов учитывались индекс массы тела, индекс коморбидности Чарлсон, индексы нефрометрии (RENAL, PADOVA, C-index).
В анализируемую группу включены пациенты со светлоклеточным вариантом ПКР. Степень клеточной анаплазии G была верифицирована как G1 в 67 (35%), G2 – в 52 (27%), G3 – в 62 (33%), G4 – в 9 (5%) наблюдениях.
Всем больным на этапе предоперационного обследования проводилась МСКТ, исследования выполнялись на мультиспиральных компьютерных томографах Toshiba Aquilion One 640 или Toshiba Aquilion multi 320 (Япония). Протокол проведения исследования 3 Phase Kidneys – в положении пациента лежа на спине (параметры съемки: режим исследования спиральный, толщина среза – 0,5 мм, напряжение – 120 kV, сила тока – 80 mA, скорость вращения трубки – 0,5 с, зона исследования: от купола диафрагмы до лобкового сочленения) с внутривенным контрастированием. Контрастные препараты – используемые для контрастирования с содержанием йода 300–370 мг/мл (омнипак, ультравист, визипак) в объеме 80–90 мл в среднем на одно исследование со скоростью внутривенного введения 3,5–4 мл в секундах.
Всем пациентам на основании DICOM данных МСКТ проведено 3D-виртуальное планирование операций посредством программы 3D-моделирования «Amira» по ранее описанному алгоритму [33].
Выполнение текстурного анализа 3D-моделей включала несколько этапов, представленных на рис. 1.
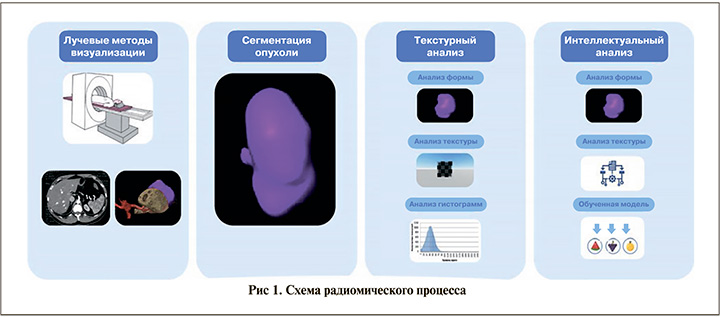
Сегментация опухоли выполнялась в ручном режиме на 3D-моделях патологического процесса двумя опытными врачами лучевой диагностики.

Извлеченные 3D-модели опухоли оценивали по форме новообразований (рис. 2) с математическим расчетом трех показателей по формулам 1–3:
Отклонение – отношение объема опухоли к объему описывающего эллипсоида (формула 1).
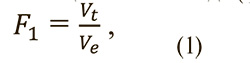
где Vt – объем опухоли, Ve – объем описывающего эллипсоида.
Отношение диаметров 1 – отношение минимальной по длине полуоси эллипсоида к максимальной (формула 2).

где dmin – минимальная по длине полуось описывающего эллипсоида, dmax – максимальная по длине полуось описывающего эллипсоида.
Отношение диаметров 2 – отношение промежуточной по длине полуоси эллипсоида к максимальной (формула 3).
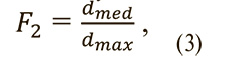
где dmed – промежуточная по длине полуось описывающего эллипсоида, dmax – максимальная по длине полуось описывающего эллипсоида.
В дальнейшем выполнялся текстурный анализ и извлечение 300 характеристик текстуры, состоящих из статистик первого, второго и высшего порядков.
Для предикации степени ядерной анаплазии новообразований паренхимы почки и точности классификации выполнен интеллектуальный анализ. В прогностической модели использовался алгоритм машинного обучения Стохастического градиентного спуска и кросс-валидации k=5 с входящими параметрами: статистика первого, второго и высшего порядков, параметры формы образований и клинические данные наблюдений.
Результаты исследования. В исследовании первично пациенты были разделены на три группы, согласно степени ядерной анаплазии по Фурман. Пациенты со степенью градации G4 не включались в классификацию ввиду малого количества наблюдений (G4-n-9). Для построения моделей прогноза отобраны значимые признаки: эксцесс (Kutrosis), различность (Dissimilarity), нормализованная степень разности (Difference Normalized), дисперсия степени разности (Difference variance), обратная степень разности (Inverse Difference [Normalized]), однородность (Homogeneity), контрастность (Contrast). Точность классификации для трех групп G1-2-3 составила 51,5% по метрики F1. Использовалась кросс-валидация k=5. Точность прогноза представлена в табл. 2.
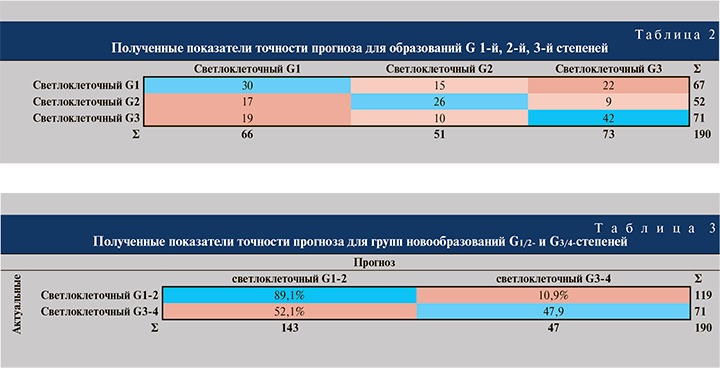
Ввиду низкого качества моделей прогноза и для учета наблюдений со степенью ядерной анаплазии G4 были сформированы 2 группы анализа: первая группа G1/G2 – 119, вторая группа G3/G4 – 71 наблюдение.
Для построения моделей были отобраны следующие наиболее значимые признаки: объем новообразования, индекс коморбидности Чарлсона, «Энергия», первый квартиль и второй дециль распределения яркости пикселей. В результате точность прогноза степени ядерной дифференцировки по Фурман для двух групп G1/2 и G3/4 составила 72,2 по метрики F1. Точность прогноза представлена в табл. 3.
Обсуждение. Интерпретация и анализ DICOM данных лучевых методов диагностики являются продуктом субъективной визуальной оценки изображений врачом-рентгенологом. В заключение специалист использует незначительное количество объективных параметров, которые не имеют существенной дифференциально диагностической значимости: размер патологического образования, топографо-анатомические взаимоотношения, градиент накопления контрастного вещества в различных фазах исследования выбранного участка в единицах Хаунсфилда (HU) на МСКТ, интенсивность сигнала (SI) на МРТ или стандартизированное значение поглощения (SUV –
Standardized Uptake Value) на ПЭТ [34]. Органы зрения человека распознают текстуру изображения лучевых методов диагностики как зернистый узор, состоящий из различной интенсивности точек серого цвета – пикселей. Однако изображения имеют ряд признаков различных порядков, определенную яркость, размер цвета, шероховатость, направленность, случайность, гладкость, грануляцию и так далее, оценка которых глазом человека неполноценна, недостаточно значима и оператор зависима [34].
ТА-изображения предоставляет намного больше информации о структурных и функциональных характеристиках биологических объектов, поэтому использование радиомики является важным вопросом в обработке и понимании полученного изображения.
Система классификации степени ядерной анаплазии по Фурман является наиболее широко используемой врачами-морфологами и является независимым предиктором «агрессивности» светлоклеточного и папиллярного вариантов ПКР [35]. Соответственно, для степеней 1, 2, 3 и 4 5-летняя онкоспецифическая выживаемость составила 84,60%, 60,50, 11,54 и 6,40% [5].
Определение биологической природы ПКР или вероятной «агрессивности» рака на этапе планирования тактики терапии больного может оказать существенную поддержку врачу в принятии решения об оптимальном методе лечения: хирургическое вмешательство и его объем (ОСО и/или органоуносящая операция), аблация и/или активное наблюдение.
Поскольку точность чрескожной биопсии новообразований паренхимы почки в определении ядерного грейда по Фурман невысока из-за значительной систематической ошибки, дооперационное распознавание биологической природы ПКР является проблематичным в настоящее время.
В нашем исследовании точность прогноза степени ядерной дифференцировки по Фурман для двух групп (G1/2 и G3/4) составила 72,2 по метрики F1 при использовании алгоритма машинного обучения Стохастического градиентного спуска и кросс-валидации k=5. Отличительной особенностью нашей работы является применение ТА 3D-моделей новообразований паренхимы почки. Сегментированные объемные модели опухоли включали все фазы МСКТ.
В ряде исследований в мире в прогнозе степени ядерной анаплазии для ТА используются одна или несколько фаз МСКТ.
Так, в исследовании Bektas и соавт. текстурные признаки извлечены из венозной фазы МСКТ 53 пациентов со светлоклеточным вариантом ПКР с разделением на 2 группы: 31 ПКР низкой степени (G1/2), и 23 высокой степени (G3/4). В интеллектуальном анализе с целью классификации использовалось несколько алгоритмов машинного обучения. Наивысшая прогностическая эффективность была получена при применении алгоритма метода опорных векторов (SVM- support vector machine), SVM-точность прогноза классификатора двух групп (G1/2 и G3/4) составила 85,1% [30].
По нашему мнению, для разработки прогностической модели классификатора степени ядерной анаплазии светлоклеточного варианта ПКР наравне с текстурными признаками необходимо использовать характеристики формы опухоли. В своем исследовании мы использовали три расчетных значения формы новообразований. Наше предположение подтверждается работой Luo и соавт., где ТА выполнен в бесконтрастной и экскреторной фазах МСКТ 177 пациентов со светлоклеточным ПКР (124 G1/2, и 53 G3/4), наибольшая точность прогноза – 81% – была достигнута в моделях с включением характеристик формы опухоли [31].
Расчетный показатель объема опухоли в нашем исследовании был определен значимым фактором в учете классификатора ядерной дифференцировки по Фурман.
В какой-то мере результаты нашей работы согласуются с работой Kierans и соавт. Исследователи провели ТА МРТ 61 пациента со светлоклеточным вариантом ПКР, при выполнении многофакторного регрессивного анализа было установлено, что размер опухоли (р=0,013), ассиметрия (р=0,012) и матричная корреляция совпадений (р=0,030) являются значимыми независимыми предикторами степени ядерной анаплазии G3/4 [32].
Кроме учета показателя объема новообразований в нашем исследовании отмечена значимость индекса коморбидности Чарлсон в прогнозе степени градации по Фурман.
В основу расчета индекса коморбидности входят характеристики возраста и сопутствующих заболеваний пациента [36]. При этом большинство соматических заболеваний, которые повышают индекс коморбидности больных, связано с метаболическим синдромом: сахарный диабет, гипертоническая болезнь, ишемическая болезнь сердца. Наличие вышеупомянутых заболеваний в наблюдениях, по мнению различных исследователей, оказывает влияние на общую выживаемость и «биологический потенциал» ПКР [37–39].
Положительными сторонами нашего исследования являются выполнение радиомики 3D-моделей опухоли, выполненных на основании оценки всех четырех фаз МСКТ брюшной полости с контрастированием, использование в прогнозировании расширенного набора данных – клинических, демографических, форма образований.
Недостатками нашего исследования явились небольшая общая выборка пациентов, малое количество наблюдений со степенью ядерной дифференцировки G4, одноцентровой и ретроспективный характер исследования.
Необходимо проведение дальнейших многоцентровых исследований с большим количеством наблюдений, с целью валидации радиомики в медицине для определения персонифицированного подхода в определении тактики лечения пациентов с ПКР.
Заключение. Использование текстурного анализа 3D-моделей в прогнозе грейда по Фурман светлоклеточного варианта почечно-клеточного рака продемонстрировало удовлетворительное качество моделей для двух групп (G1/2 и G3/4) клеточной анаплазии.



