Доброкачественная гиперплазия предстательной железы (ДГПЖ) – одно из самых распространенных заболеваний мочеполовой системы, им страдает около 50% мужчин в возрасте 60 лет и почти 90% – в возрасте 85 лет [1].
Современная медицина способна предложить пациенту множество достаточно эффективных методов лечения, главным из которых остается консервативный. Однако в тех случаях, когда медикаментозное лечение оказывается неэффективным, пациенту показано оперативного лечения [2].
Сегодня ведущее место среди методов оперативного лечения ДГПЖ занимают эндоскопические вмешательства. Трансуретральная резекция предстательной железы (ТУРПЖ) остается «золотым» стандартом оперативного лечения ДГПЖ. Тем не менее, несмотря на многолетний опыт выполнения, ТУРПЖ может быть причиной таких осложнений, как ретроградная эякуляция, недержание мочи, гематурия, стриктуры уретры, склероз шейки мочевого пузыря и др., и не может быть выполнена пациентам с высоким хирургическим и анестезиологическим риском [3, 4]. Похожие ограничения имеют как современные методы лазерной трансуретральной хирургии, так и прочие хирургические методики лечения ДГПЖ, такие как позадилонная и лапароскопическая аденомэктомия. Зачастую выполнение оперативного пособия пациенту оказывается невозможным ввиду отягощенного соматического статуса, поэтому особое значение приобретают малоинвазивные оперативные методы лечения ДГПЖ, характеризующиеся уменьшением объема анестезиологического пособия, длительности оперативного вмешательства и частоты послеоперационных осложнений [5, 6].
Минимально инвазивные хирургические методы лечения ДГПЖ, такие как трансуретральная инцизия предстательной железы [7], трансуретральная микроволновая терапия [8], трансуретральная электровапоризация предстательной железы [9, 10], трансуретральная игольчатая абляция предстательной железы [11] и др. [12–20], как правило, выполняются под общей анестезией и не всегда могут быть выполнены пациентам с тяжелыми сопутствующими заболеваниями.
Применение эмболизации простатических артерий в эксперименте и клинической практике
Среди множества минимально инвазивных хирургических методов лечения ДГПЖ обращает на себя внимание суперселективная эмболизация артерий предстательной железы (эмболизация простатических артерий; ЭПА), главное преимущество которой в следующем: она проводится под местной анестезией и может быть использована при лечении пациентов пожилого возраста с выраженной сопутствующей патологией.
Изначально селективная ЭПА выполнялась для остановки кровотечения, обусловленного ДГПЖ. Первые попытки катетеризации нижней пузырной артерии и ее ветвей предпринимались в 1970-е гг., когда M. Mitchell et al. [21] впервые сообщили о четырех случаях транскатетерной билатеральной эмболизации внутренних подвздошных артерий при лечении массивной макрогематурии. С тех пор эта техника широко используется как эффективный и безопасный метод лечения пациентов с активным кровотечением из мочевого пузыря либо предстательной железы, когда консервативные методы не дают результата [22–24]. Однако по причине недостаточной селективности рентгенэндоваскулярных технологий того времени перспектива применения ЭПА как метода лечения ДГПЖ так и не получила развития.
С развитием рентгенэндоваскулярной техники стали возможны исследования на животных. Так, в 1980 г. J. Darewicz et al. [25] на пяти собаках изучили изменения в предстательной железе после транскатетерной эмболизации внутренних подвздошных артерий с использованием N-бутил-2-цианоакрилатной кислоты. По прошествии 4 нед. макроскопически не было выявлено никаких изменений простаты. Однако при гистологическом исследовании наблюдалась инфильтрация лимфоцитов, гистиоцитов и фибробластов в интерстициальной ткани предстательной железы. Авторы пришли к выводу, согласно которому эмболизация внутренних подвздошных артерий является эффективным методом, который может быть использован в клинической практике с гемостатической целью, так как данная манипуляция не приводит к выраженным атрофическим изменениям в предстательной железе.
В 2000 г. J. S. DeMeritt et al. [26] впервые случайно выявили влияние ЭПА на симптомы со стороны нижних мочевых путей (СНМП): 76-летнему мужчине с неразрешимой макрогематурией, обусловленной ДГПЖ, была выполнена транскатетерная артериальная эмболизация правой нижней пузырной артерии с использованием поливинилового спирта до полной деваскуляризации предстательной железы. Левосторонняя эмболизация не была проведена по техническим причинам (из-за тяжелого атеросклероза внутренней подвздошной артерии). По результатам 12-месячного наблюдения отмечено, что показатели IPSS улучшились с 24 до 13 баллов, а объем простаты уменьшился на 40% – с 305 до 190 мл. Позднее F. Sun et al. [27] оценили возможность выполнения и безопасность ЭПА на животной модели. Для эмболизации использовали микросферы 500–700 мкм. Вмешательство оказалось успешным для всех 8 свиней. Через 3 мес. после ЭПА отмечено значительное уменьшение объема простаты (p<0,001). Гистологическое исследование выявило уменьшение объема железистой ткани за счет фиброза. Исходя из результатов, авторы предположили, что ЭПА – это перспективный метод симптоматического лечения ДГПЖ. Позднее F. Sun et al. [28] оценили патоморфологические изменения в предстательных железах семи собак с гормонально-индуцированной ДГПЖ после ЭПА с использованием микросфер от 500 до 700 мкм, прошедших без осложнений. Через 1 мес. после ЭПА при аутопсии был выявлен асептический некроз простаты. Это подтвердило мнение, что данная методика может быть использована для лечения ДГПЖ.
Первые в мире результаты клинического применения ЭПА при ДГПЖ были представлены А. И. Неймарком et al. в 2009 г. За период с 2004 по 2009 г. ЭПА была проведена 38 пациентам с ДГПЖ и тяжелой сопутствующей патологией, не позволявшей проводить традиционное оперативное лечение. Эмболизация была успешно выполнена всем 38 пациентам, объем простаты в среднем снизился на 45% (p<0,001), у всех пациентов улучшилось качество мочеиспускания, что было подтверждено данными урофлоуметрии и оценкой выраженности СНМП по шкале опросника IPSS; 4 пациента были избавлены от цистостомического дренажа [29, 30].
В работе Carnevale et al. [31] двум пациентам была выполнена ЭПА с использованием микросфер 300–500 мкм. Спустя 6 мес. в обоих наблюдениях констатировали уменьшение степени инфравезикальной обструкции, уменьшение объема простаты и объема остаточной мочи. Позже в 2011 г. те же авторы представили среднесрочные результаты лечения тех же пациентов: объем простаты не увеличился, а качество мочеиспускания через 30 мес. наблюдения оказалось аналогичным значению 6-месячного показателя [32]. В 2011 г. J. M. Pisco et al. опубликовали результаты исследования, в котором оценивалась эффективность ЭПА для больных с СНМП, обусловленными ДГПЖ. Процедура была технически успешной в отношении 14 из 15 пациентов, при этом значительно снизилась балльная оценка по IPSS, улучшилось качество жизни (QoL), увеличилась пиковая скорость мочеиспускания (Qmax) и уменьшился объем предстательной железы. Было одно серьезное осложнение – ишемия мочевого пузыря, потребовавшая резекции, а у 4 (28,6%) пациентов не было эффекта от операции. В дальнейшем при увеличении наблюдаемой группы до 104 человек выявлено, что через 1 мес. после операции средний балл IPSS снизился на 10 пунктов, средний показатель QoL уменьшился на 2 балла, средний показатель Qmax вырос на 38%, средний объем простаты уменьшился на 20%, средний объем остаточной мочи уменьшился на 30 мл, а средний балл международного индекса эректильной функции (IIEF) увеличился на 0,5 пункта (для всех показателей p<0,01). Кроме случая ишемии мочевого пузыря, описанного выше, других осложнений зарегистрировано не было [33, 34].
В 2011 г. Д. Г. Курбатов и соавт. на съезде Американской урологической ассоциации (AUA) представили доклад о результатах успешного выполнения ЭПА в лечении ДГПЖ на международном уровне. В 2013 г. теми же авторами опубликованы результаты выполнения ЭПА 36 пациентам с объемом простаты более 80 см3, согласно которым показатель IPSS за 12 мес. наблюдения улучшился с 23±9 до 5,2±1,7 балла (p<0,001) [35, 36].
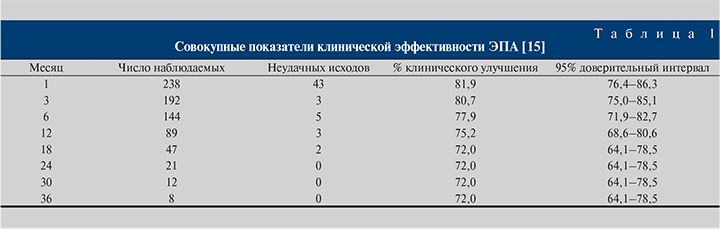
В исследовании [37] с участием 255 пациентов со средним сроком наблюдения 10 мес. билатеральная эмболизация была эффективной для 97,9% пациентов. Совокупные показатели клинической эффективности представлены в табл. 1.
В 2013 г. A. A. Antunes et al. [38] описали результаты ЭПА для 11 пациентов с задержкой мочеиспускания, обусловленной ДГПЖ. Эффективность составила 91% (10 из 11 пациентов) при среднем сроке наблюдения 22,3 мес. После ЭПА клинические и уродинамические параметры мочеиспускания значимо улучшились. В первый год наблюдения средний балл IPSS составил 2,8 (p=0,04), средняя оценка качества жизни (QoL) – 0,4 балла (p=0,001), средний уровень ПСА снизился с 10,1 до 4,3 нг/мл (p=0,003), показатель Qmax вырос с 4,2 до 10,8 мл/с (p=0,001), а детрузорное давление уменьшилось с 85,7 до 51,5 см водн.ст. (p=0,007).
F. C. Carnevale et al. [39] также сообщили о результатах применения билатеральной ЭПА в группе из 11 пациентов. Технический успех достигнут 75% пациентов (билатеральная эмболизация у 8 из 11 пациентов), а клинический успех – у 91% (улучшение СНМП у 10 из 11 пациентов) без серьезных осложнений. За 12-месячный период наблюдения средний объем предстательной железы уменьшился более чем на 30%, СНМП были выражены слабо (средний балл IPSS – 2,8±2,1; p=0,04), эректильная функция, согласно опроснику МИЭФ-15, не изменилась, оценка QoL улучшилась, составив в среднем 0,4±0,5 (p=0,001).
В работе К. Г. Нотова и соавт. [40] в группе из 21 пациента ЭПА позволила избавить от необходимости надлобкового дренирования мочевого пузыря 87% пациентов, средний регресс объема предстательной железы составил более 50%, регресс СНМП по шкале IPSS – более 9,5, а регресс по шкале QoL – около 3,7 балла.
S. Bagla et al. [41] опубликовали ранние результаты оценки эффективности ЭПА. Двусторонняя ЭПА была эффективной для 18 из 19 пациентов без каких-либо осложнений. Один случай односторонней ЭПА был обусловлен выраженным атеросклеросклерозом контралатеральной простатической артерии. У 19 из 20 пациентов через 6 мес. наблюдения значительно улучшился эквивалент IPSS – показатель выраженности СНМП Американской урологической ассоциации (AUA): средний балл – 9,8 (p=0,06) и QoL (средний балл – 2,6; p=0,007), объем простаты снизился на 18% (p=0,05).
Позже, в 2015 г., M. Q. Wang et al. [42] представили среднесрочные результаты ЭПА при лечении 105 мужчин с ДГПЖ и объемом простаты более 80 см3. Эмболизацию выполняли с использованием комбинации микросфер 50 и 100 мкм в диаметре. В течение 24 мес. последующего наблюдения ощутимо улучшились средние показатели IPSS (с 26 до 9; p<0,01), QoL ( с 5 до 3; p<0,01), Qmax (c 8,5 до 14,5 мл/с; p<0,01), объем остаточной мочи (со 125 до 40 мл; p<0,01), объем простаты (с 118 до 69 см3, в среднем на 41,5%; p=0,01). Каких-либо серьезных осложнений в раннем послеоперационном периоде отмечено не было. Незначительное жжение в уретре отметили 19 (17,4%) пациентов, преходящую гематурию – 11 (10,9%) пациентов, преходящая гематоспермия отмечена у 9 (8,1%) пациентов, преходящее ректальное кровотечение произошло у 8 (7,34%) пациентов, и небольшая паховая гематома в месте пункции возникла у 3 (2,8%) пациентов. Все эти незначительные осложнения были купированы на фоне консервативной терапии в течение первой недели. У 31 (28,4%) пациента за первые 1–3 дня после ЭПА отмечена острая задержка мочи, для купирования которой пациентам на срок от 3 до 6 дней устанавливался уретральный катетер.
К моменту выписки самостоятельное мочеиспускание было восстановлено у 100% пациентов. Таким образом, был сделан вывод: большой объем простаты не увеличивает риска осложнений.
На сегодняшний день рентгенэндоваскулярные хирурги обладают довольно богатым арсеналом материалов для выполнения ЭПА, сюда входят современные микропроводники с внутренним диаметром до 0,014 inch, различные виды микросфер диаметром от 90 до 500 мкм, эмболизационные спирали, гидрогелевые эмболизационные препараты, а также их комбинация – так называемая сендвич-терапия. Согласно исследованиям Jin Ho Hwang et al., наиболее эффективной оказалась ЭПА с применением микросфер [43], а O. M. Gonçalves et al. [44] доказали, что применение микросфер диаметром 100–300 мкм позволяет добиваться лучших клинических результатов по сравнению с использованием микросферами в 300–500 мкм.
В 2015 г. А. И. Неймарк и соавт. сообщили о результатах выполнения ЭПА в период с 2004 по 2014 г. 59 пациентам с ДГПЖ, средний возраст которых составил 68,2±6,2 года, объем простаты варьировался от 35 до 296 см3. После эмболизации статистически значимо уменьшилась выраженность симптомов по шкале IPSS, увеличился показатель Qmax, объем простаты в среднем уменьшился на 53% (p<0,01), объем узлового образования – на 47% (p<0,01). По прошествии 24 мес. наблюдения из 59 пациентов была выделена группа в 17 человек с сохранившимися СНМП, соматический статус которых не позволил выполнить им чреспузырную аденомэктомию, но в связи с уменьшением объема простаты до показателей менее 80 см3 стало возможным выполнение ТУРПЖ. Всем 17 пациентам успешно проведена ТУРПЖ, интраоперационно была отмечена минимальная кровоточивость резецируемых тканей. Ранний послеоперационный период протекал без особенностей. Период долгосрочного наблюдения (6 мес.) не отличался от такового после стандартной ТУРПЖ [45, 46].
По данным С. Б. Жарикова и соавт. [47], у 44 пациентов спустя 6 мес. после ЭПА объем простаты уменьшился в среднем на 54,7% (p<0,001), уровень ПСА снизился в среднем на 65% (p<0,001), показатель Qmax вырос на 60% (p<0,001), время мочеиспускания сократилось на 59,5% (p<0,001), объем выделяемой единоразово мочи вырос на 26% (p<0,001).
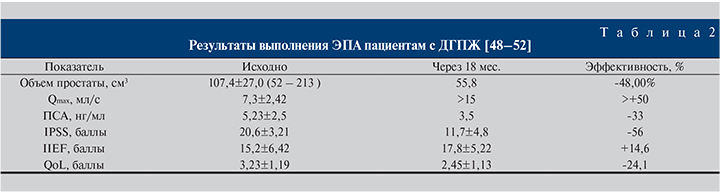
С 2013 по 2017 г. сотрудниками МНОЦ МГУ им. М. В. Ломоносова и кафедры урологии и андрологии МГУ им. М. В. Ломоносова (Камалов А. А., Карпов В. К.) совместно с кафедрой факультетской хирургии РНИМУ им. Н. И. Пирогова (Капранов С.А.) на базе ГКБ № 31 Москвы 124 пациентам с ДГПЖ выполнена суперселективная эмболизация простатических артерий. Средний возраст прооперированных составил 69 (53–89) лет, средний объем простаты – 107,4±27,0 (52–213) см3, уровень ПСА – 5,23±2,5 нг/мл. При уровне ПСА выше 4 нг/мл выполнялась трансректальная биопсия простаты либо ПЭТ КТ для исключения онкологического процесса. Максимальная скорость мочеиспускания до операции составила 7,3±2,42 мл/с, оценка качества жизни QoL – 3,23±1,19 балла, оценка симптомов нижних мочевых путей по шкале IPSS – 20,6±3,21 и оценка Международного индекса эректильной функции IIEF – 15,2±6,42. Суперселективная эмболизация простатических артерий с двух сторон успешно выполнена 113 пациентам, в 9 случаях проведена унилатеральная ЭПА, 4 пациентам в сроки до 16 мес. была выполнена повторная ЭПА. Через 18 мес. наблюдения у 92% пациентов констатировали уменьшение объема простаты в среднем на 48%, снижение уровня ПСА до 33% от исходного, средний балл IPSS составил 11,7±4,8, средний балл QoL – 2,45±1,13, IIEF – 17,8±5,22. Показатель Qmax достоверно улучшился до нормальных значений (табл. 2). Число осложнений составило 1,73±0,11 [48–52].
Сравнительная эффективность ЭПА и ТУР
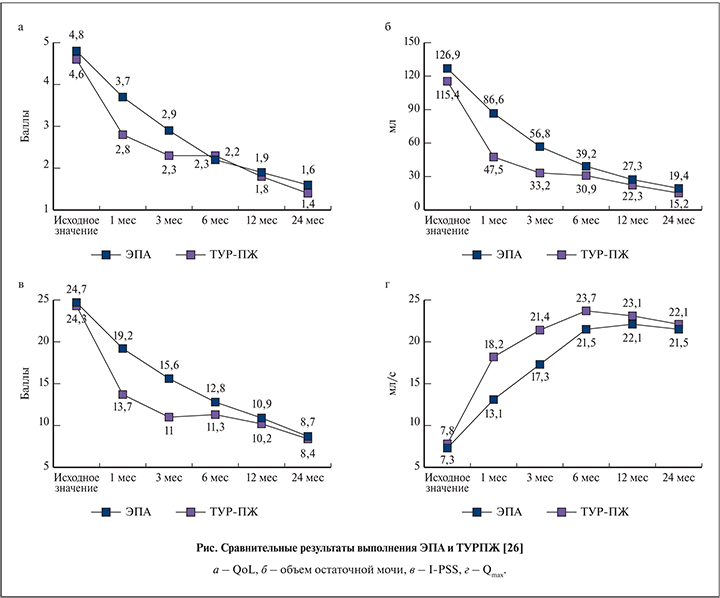
Значительный научный интерес представляют исследования, посвященные сравнению эффективности результатов ЭПА и ТУР ПЖ. Наиболее крупное из них, в котором приняли участие 120 пациентов, провели Yuan-an Gao et al. [53], наглядно продемонстрировав сопоставимость результатов этих методик (см. рисунок).
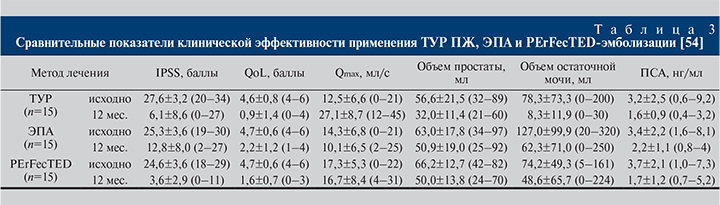
В похожем исследовании F. C. Carnevale et al. [54], где трем группам пациентов выполнялась соответственно ТУР ПЖ, классическая ЭПА и эмболизация простаты по усовершенствованной технологии – PErFecTED (Proximal Emdolization First Then Embolize Distal) [55], продемонстрировано существенное преимущество последней перед ТУР ПЖ при оценке выраженности СНМП по шкале IPSS через 12 мес. наблюдения: 3,6±2,9 в группе PErFecTED-эмболизации против 6,1±8,6 у пациентов, которым была выполнена ТУР ПЖ. У пациентов после ЭПА и PerFecTED-эмболизации не встречались осложнения, которые были при ТУР ПЖ и включали недержание мочи (26,7%), разрыв простатической капсулы (6,7%), ретроградную эякуляцию (100%), а также повторную госпитализацию в связи с гематурией (табл. 3).
Большой интерес вызывают подсчеты S. Bagla et al. [56], согласно которым выполнение одной ЭПА в среднем на 486 долл.дешевле, чем ТУР ПЖ (1667,10 против 2153,64 долл.), а с учетом затрат на весь период стационарного лечения эта разница составила около 3360 долл. (1678,14 против 5338,31 долл.).
Перспективным направлением использования ЭПА является комбинированное лечение ДГПЖ объемом более 150 см3, при котором на первом этапе для уменьшения размеров «неоперабельной» для ТУР ПЖ применяется ЭПА, а вторым этапом выполняется один из видов эндоскопического гисторедуктивного лечения. Результаты такого лечения были опубликованы в 2017 г. группой китайских исследователей во главе с P. Li: оперативное лечение в объеме ЭПА c последующей гольмиевой лазерной энуклеацией предстательной железы (HoLEP) было успешно выполнено 24 пациентам [57].
Показания, противопоказания и подготовка к ЭПА
Алгоритм предоперационного обследования включает все необходимые исследования, проводимые при подготовке к любым оперативным вмешательствам по поводу ДГПЖ: определение объема простаты с помощью ТРУЗИ или МСКТ, УЗИ мочевого пузыря с определением объема остаточной мочи, анализ крови на ПСА, при повышении которого показано выполнение трансректальной биопсии простаты, урофлоуметрии, определение выраженности СНМП с помощью опросников IPSS и QoL. Для предоперационной оценки ангиоархитектоники простаты рекомендована МСКТ-ангиография, при невозможности выполнения которой альтернативой может служить ультразвуковая 3D-ангиография [58–60].
Относительные показания к выполнению ЭПА: объем простаты более 60 см3, отсутствие эффекта от консервативного лечения в течение 6 мес., балльные оценки по шкале IPSS>18, по шкале QoL>3, Qmax<13 мл/с, острая или хроническая задержка мочи в анамнезе, наличие цистостомы, возраст более 65 лет. Основными показаниями служат невозможность выполнения оперативного лечения в связи с высоким анестезиологическим риском, отягощенный соматический статус, невозможность выполнения открытого или эндоскопического лечения по каким-либо другим причинам. При определении тактики лечения также учитывается желание пациента избежать открытого или трансуретрального вмешательства и желание сохранить антеградную эякуляцию [58, 59, 61].
Противопоказаниями к применению ЭПА могут быть лекарственная непереносимость рентгеноконтрастного препарата, а также выраженный атеросклероз и сосудистые аномалии развития в области бифуркации аорты, наружной и внутренней подвздошных артерий.
Осложнения ЭПА
Наиболее частые осложнения ЭПА: постэмболизационный синдром (субфебрилитет, дизурические явления, боль в паховой области; встречается примерно в 11,1% случаев, купируется пероральным приемом НПВС в стандартных дозах), а также острая задержка мочи, регистрируемая в 25,9% случаев, разрешающаяся на фоне терапии α1-адреноблокаторами. Помимо вышеуказанных осложнений существует риск непреднамеренной эмболизации коллатералей с развитием ишемии мочевого пузыря, кавернозных тел или прямой кишки, однако в мировой литературе описаны единичные случаи ишемии, требовавшей оперативного вмешательства [31–34, 37–41].
Исходя из имеющихся на сегодняшний день данных, ЭПА является эффективной и безопасной минимально инвазивной методикой лечения ДГПЖ. Преимущества ЭПА заключаются в том, что эта операция может быть выполнена амбулаторно и требует только местной анестезии или умеренной седации. Несмотря на имеющиеся данные, ЭПА еще предстоит найти свое место среди методов лечения ДГПЖ. Требуются дальнейшие долгосрочные мультицентровые контрольные исследования, способные помочь оценить эффективность и безопасность, а также определить четкие показания и противопоказания к выполнению данного вида оперативного лечения.



