Острое повреждение почек (ОПП) – серьезная междисциплинарная проблема современной медицины, что обусловлено его широкой распространенностью и ассоциацией с неблагоприятными последствиями для пациента. В недавних исследованиях выявлено развитие ОПП у 3,2–9,6% пациентов, находившихся на стационарном лечении в развитых странах. При этом госпитальная летальность составляла 20%, а в отделениях интенсивной терапии летальность достигала 50% [1–3]. У 5–6% пациентов отделений интенсивной терапии развивается ОПП, при котором требуется гемодиализ, госпитальная летальность при этом возрастает до 60% [4–6].
Острый тромбоз артерий почек занимает 5-е место среди тромбозов любой локализации, а эмболия почечных артерий – второе после тромбоэмболии легочной артерии. В результате тромбоэмболии развивается инфаркт почки, тяжесть которого зависит от массивности поражения и диаметра вовлеченных сосудов. Часто односторонний тромбоз сосудов почек не диагностируется в связи со скупостью клинических проявлений и компенсацией утраченной функции контрлатеральной почкой [7, 8].
Инфаркт почки (ИП) является редким заболеванием, возникающим из-за окклюзии кровеносных сосудов почки [9]. Частота инфаркта почки, по оценкам, составляла от 0,004 до 0,007% наблюдений, у пациентов, обращавшихся в отделение неотложной помощи [10]. Однако при изучении результатов вскрытий инфаркт почки был обнаружен в 1,4% случаев [11]. Это говорит о том, что частота инфаркта почки может быть выше, чем оценивается в литературе. Это может быть связано с неспецифической клинической картиной: у данной группы пациентов выявляются симптомы, характерные как для острого пиелонефрита, так и для почечной колики.
Инфаркт почки наиболее часто встречается у пациентов средней возрастной группы – в 30–50 лет. Не описано каких-то гендерных различий в заболеваемости ИП или преимущественного поражения правой или левой почечной артерии.
Неспецифичность клинической картины обусловливает сложности в установлении диагноза [12]. Изучение современных аспектов диагностики и лечения тромбозов почечных артерий актуально в связи с глобальной пандемией COVID-19, так как ряд исследований сообщают, что тромбоз почечных артерий может быть вторичным по отношению к коронавирусной инфекции. [15]
Целью настоящего обзора было изучение современных аспектов диагностики и лечения инфаркта почки.
Несмотря на редкость выявления инфаркта почки в среднем в популяции частота тромбозов почечных артерий может быть достаточно высокой у пациентов групп риска: при онкологических заболеваниях, при тяжелом атеросклеротическом поражении аорты и почечных артерий, при нарушении сердечного ритма. Тромбоз может формироваться как в магистральных почечных артериях, так и в их ветвях.
Этиология инфаркта почки
Согласно многим исследованиям, к развитию инфаркта почки в большинстве случаев (до 95%) приводят заболевания сердца [7, 9, 10]. Особенно часто среди факторов риска тромбоза почечных артерий отмечается фибрилляция предсердий. Другими причинами развития инфаркта почки являются бактериальный эндокардит, повреждение почечной артерии и гиперкоагуляция [13, 14].
Также сообщается о редких случаях развития инфаркта почки в связи с другими заболеваниями, включая васкулит, системную красную волчанку, серповидноклеточную анемию и фибромышечную дисплазию почечных артерий.
Несмотря на многообразие возможных причин возникновения инфаркта почки, установить его причину не удается установить примерно в 30% зарегистрированных случаев [15].
В 2013 г. М. Bourgault и соавт. выделили 4 группы причин ИП [9]:
- сердечной этиологии;
- связанные с повреждением почечной артерии (сосудистые формы);
- связанные с гиперкоагуляцией;
- идиопатические.
Эта классификация не только описывает возможные причины ИП, но и детализирует подходы к диагностике при ИП. Важна оценка состояния свертывающей системы, сосудистого русла и сердечной мыщцы, полостей сердца и клапанного аппарата. Относительно «сосудистых форм» A-L. Faucon и соавт. [16] подчеркивают важность исследования состояния нескольких сосудистых бассейнов (сонные артерии, контралатеральная почечная артерия) для уточнения этиологии ИП и снижения частоты ложноидиопатической формы.
Клиническая картина
У большинства пациентов с инфарктом почки отмечается боль в животе, хотя некоторые из них не испытывают каких-либо субъективных симптомов. Могут также наблюдаться субфебрильная температура, тошнота и рвота [9, 14]. Также нередко встречается и гематурия. Часто клиническая картина может быть невыраженной и развиваться постепенно – по мере того, как уменьшается перфузия почечной паренхимы.
Таким образом, инфаркт почки может быть ошибочно диагностирован первоначально как почечная колика или острый пиелонефрит [9]. В ретроспективном исследовании у 14 пациентов инфаркт почки первоначально был ошибочно диагностирован как почечная колика [17]. Диагноз инфаркта почки часто ставится более чем через 48 ч с момента появления симптомов [18].
Диагностика
С учетом неспецифичности клинической картины инфаркта почки крайне важно выделить специфические изменения в рутинных исследованиях, выполняемых при почечной колике или пиелонефрите, которые могут сфокусировать клиническую мысль на возможном инфаркте почки. Так, инфаркт почки связан с повышенным уровнем лактатдегидрогеназы (ЛДГ) более чем в 90% наблюдений, что может помочь в дифференциации этого заболевания от почечной колики и пиелонефрита [9].
У многих пациентов с инфарктом почки может быть вначале ошибочно диагностирована почечная колика, соответственно, пациенту может быть выполнена нативная компьютерная томография (КТ) мочевыводящих путей. Чувствительность нативного КТ в отношении инфаркта почки невысока [19]. Поэтому при исключении мочекаменной болезни и сохранении клинических подозрений на инфаркт почки, рекомендовано дополнить протокол КТ внутривенным контрастированием [20].
Именно реноваскулярная КТ с контрастированием является оптимальным диагностическим инструментом для диагностики инфаркта почки [21]. Кровоснабжение почек обычно оценивается в сосудистую фазу, которая составляет около 15–25 с после внутривенного введения контрастного вещества [22]. Внешний вид паренхимы почки при ИП определяется размером тромба, его расположением и длительностью заболевания. Ключевым признаком для постановки диагноза является отсутствие усиления почечной ткани в артериальной фазе [23].
При УЗИ локальный инфаркт почки визуализируется в виде участка повышенной эхогенности. По форме участок инфаркта представляет собой конус, направленный основанием к капсуле почки [9].
Инвазивная диагностика инфаркта почки, включая ангиографию почек и эндоваскулярное ультразвуковое исследование, изменили подходы к терапии ИП за счет лучшей оценки этиологии этого состояния. Кроме того, инвазивные исследования улучшили результаты терапии ИП за счет увеличения использования антиагрегантной терапии и уменьшения использования пероральной антикоагулянтной терапии. Инвазивные исследования 59 пациентов привели к изменению антитромботической стратегии в 56% наблюдений в виде увеличения назначения антитромбоцитарной терапии. Только у 2 (8%) пациентов отмечена стойкая хроническая болезнь почек (ХБП). Авторы показали, что инвазивное исследование состояния почечной артерии может улучшать долгосрочный прогноз при инфаркте почки [25]. В отличие от ангиографии внутрисосудистое ультразвуковое исследование (ВСУЗИ) позволяет не только выявлять тромбоз почечной артерии, но и непосредственно оценивать атеросклеротическое поражение и ремоделирование артериальной стенки [24]. Следовательно, ВСУЗИ более чувствительно, чем ангиография, для выявления сосудистых поражений при условии, что пораженная артерия доступна для инвазивной катетеризации.
Варианты терапии
Научное обоснование подходов к лечению ИП крайне скромное, так как основывается лишь на небольших исследованиях или сериях клинических наблюдений. В то время как достигнут консенсус в подходах к диагностике и лечению острого ИП, взгляд профессионального сообщества на проблему отсроченной терапии ИП остается противоречивым.
Варианты консервативного медикаментозного лечения включают антитромботическую терапию и системный или селективный тромболизис. Оптимальное сочетание этих методов в настоящее время также спорно ввиду отсутствия большого количества данных, однако несомненно: чем раньше начато лечение, тем меньше ишемическое повреждение почечной ткани. Некоторые исследователи рекомендуют использовать преимущественно консервативную антикоагулянтную стратегию при одностороннем поражении, а также низком резерве сохранения почечной ткани [26].
Cистемная антикоагулянтная терапия гепарином в остром периоде является стандартом лечения и направлена на снижение летальности [27]. Четких критериев ее длительности не определено, и решение часто базируется на индивидуальной клинической оценке. Особенности пролонгированной консервативной терапии во многом зависят от этиологии ИП и механизма тромбоза. В случае если причиной тромбоза стала тромбоэмболия из левых камер сердца, в том числе вследствие фибрилляции предсердий, показан прием пероральных антикоагулянтов (варфарин, апиксабан, ривароксабан, дабигатран) [28]. При атеросклеротическом поражении рекомендовано применение антиагрегантов (ацетилсалициловая кислота, клопидогрел) [29]. Антикоагулянтная терапия идиопатических тромбоэмболических состояний пациентов без фибрилляции предсердий остается неясной. В крупном ретроспективном когортном исследовании M. I. Khayat и соавт. (2019), в котором сравнивались долгосрочные результаты антикоагулянтной и неантикоагулянтной терапии пациентов (n=103) c идиопатическими ИП, не было выявлено существенной разницы в частоте рецидивов артериального тромбоза между группами лечения в течение 4,3 года наблюдения (p=0.46) [30].
Что касается тромболитической терапии, то с момента начала ее использования в клинической практике она активно применяется в лечении ИП как в виде системного тромболизиса, а по мере развития эндоваскулярных вмешательств – все чаще в виде селективного. Применяются фибринолитические ферменты (стрепокиназа, урокиназа), тканевые активаторы плазминогена (альтеплаза) [31]. Данные об эффективности и безопасности этого метода терапии также базируются в основном на сериях клинических наблюдений, которые в целом демонстрируют достаточную безопасность и хорошую клиническую эффективность даже в случае длительной ишемии [26, 32].
Важно упомянуть, что в некоторых клинических ситуациях необходимо сочетание различных антитромботических стратегий. В любом случае длительность лечения и выбор препарата вариабельны и зависят от соматического статуса, сопутствующих заболеваний пациента, индивидуального риска кровотечений и должны определятся мультидисциплинарной командой. Также важно фокусироваться не только на терапии ИП, но и на выявлении и модификации состояний, которые обусловили его возникновение.
Таким образом, медикаментозное лечение ИП представляет собой непростую задачу с ограниченным количеством доказательных данных. Необходимо проведение рандомизированных контролируемых сравнительных исследований для оценки преимущества того или иного метода лечения данного патологического соcтояния.
В случаях травматического тромбоза почечной артерии высокоэффективным является хирургическое лечение, включающее эндоваскулярный тромболизис, данные о котором в литературе ограниченны. Другими вариантами чрескожной эндоваскулярной терапии могут являться тромбэктомия или ангиопластика с/без стентирования почечной артерии.
Успешно выполненный тромболизис позволяет добиваться улучшения кровоснабжения, но не восстанавливает полностью функции почки. Тромболизис максимально эффективен при выполнении его в кратчайшие сроки после инфаркта почки.
Всем пациентам, перенесшим ИП, необходима продолжительная профилактика повторных артериальных тромбозов по общепринятым правилам: сочетанное применение пероральных антикоагулянтов и антитромбоцитарных препаратов.
В таблице приводится анализ назначения антитромботических препаратов сразу после постановки диагноза ИП, о которых сообщалось в литературе, и состоящих в основном из пероральных антикоагулянтов.
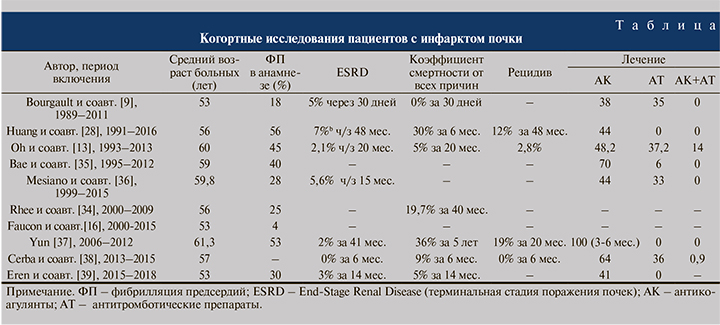
Прогноз пациентов с ИП, с одной стороны, зависит как от выраженности поражения почек, так и от этиологии заболевания. Необходимо отметить, что у больных с эпизодом тромбоза почечной артерии значительно увеличивается риск повторных потенциально фатальных тромбозов другой локализации, как артериальных, так и венозных. В ближайший период после ИП отмечается максимальный риск летального исхода: так, в течение первых 30 дней смертность составляла 11,8% [23]. В дальнейшем более чем 50% пациентов удается добиться полного или чаще частичного восстановления функции почек.
Таким образом, тромбоз почечной артерии – редкое патологическое состояние, требующее особого внимания в связи с высоким риском потери функции почек. Как и для всех патологических состояний, важным аспектом является своевременная диагностика и правильное лечение. Тактику лечения целесообразно выбирать, исходя из степени тромбоза. В случае неполного тромбоза консервативная антикоагулянтная терапия показывает хорошие результаты (снижение функции почек через 2,5 года на 9%), для полного тромбоза требуется эндоваскулярная тромбэктомия (снижение функции почек через год на 27%) [26].
Согласно современным литературным данным, одной из причин острой почечной недостаточности является тромбоз почечных артерий, клинические проявления которого зависят от массивности поражения.
Особенностями этого патологического состояния являются сложность ранней диагностики (менее чем у 30% больных рано диагностируется тромбоз почечной артерии) и кажущаяся бесперспективность лечения при длительной (57 сут.) анурии. Общепринятый протокол диагностики и лечения тромбоза почечных артерий отсутствует. Для уточнения диагноза рекомендуют экскреторную урографию, радионуклидную ренографию, компьютерную томографию с рентгеноконтрастным усилением [29]. До недавнего времени при подозрении на тромбоз почечных артерий пациентам назначалась антикоагулянтная и заместительная почечная терапия гемодиализом, который становился хроническим, поскольку функция почек, как правило, не восстанавливалась, нарушалась необратимо. Хирургическое лечение эффективно лишь в первые часы. Исход нередко бывает неблагоприятным, высока вероятность геморрагических осложнений [40].
Вследствие редкой частоты диагностированного инфаркта почки не было достигнуто консенсуса в отношении диагностики или лечения этого состояния. Лечение пациентов с острым инфарктом почки включает тромболизис, антикоагулянты, а иногда и хирургическое вмешательство в зависимости от продолжительности симптомов. Для улучшения прогноза пациентов с тромбозами почечных артерий необходимо своевременное выявление и устранение причин и предрасполагающих факторов, а также адекватное индивидуальное лечение, основанное на этиологической оценке.



