Распространенность мочекаменной болезни (МКБ) в зависимости от региона может достигать 20%. Наиболее часто встречающимися мочевыми камнями являются кальцийсодержащие: кальций-оксалатные (СаОх), кальций-фосфатные (СаР) и смешанные (СаОх и СаР). Частота их выявления, по данным различных авторов, достигает 60–80% и, согласно результатам современных эпидемиологических исследований, в последние десятилетия отмечается увеличение их встречаемости в общей популяции. [1] Напротив, количество фосфатных «инфекционных» камней имеет тенденцию к снижению. Встречаемость мочекислых камней остается достаточно высокой, составив 2–15%, достигая в эндемичных регионах 50–75% [2]. Большинство специалистов объясняют рост заболеваемости МКБ не столько многогранностью генетически предрасполагающих факторов, приводящих к нарушению метаболических процессов в организме человека, сколько влиянием множественных факторов внешней среды.
К последним следует отнести климатические особенности; пищевые предпочтения питания и питьевой режим; профессиональные особенности, связанные не только с работой в горячих производствах, но и со снижением уровня физической активности; увеличение продолжительности жизни, ассоциированное с увеличением встречаемости сахарного диабета, метаболического синдрома, гормональных нарушений, обусловливающих различные метаболические расстройства, сопровождающиеся нарушением обмена камнеобразующих веществ [1, 3–7].
К особенностям течения мочекислого нефролитиаза относится выраженная тенденция к рецидивному образованию камней, особенно в отсутствие постоянных метафилактических мероприятий. С другой стороны, мочекислые камни являются единственным видом мочевых камней, которые подлежат эффективному растворению и при которых возможно проведение эффективной метафилактики [8–9]. Для выбора действенного метода лечения и предупреждения повторного образования камней первостепенное значение имеет понимание этиопатогенетических процессов, приводящих к образованию мочекислых камней. Не будет лишним напомнить, что при нарушении обмена пуринов образуются камни не только из мочевой кислоты, но и из солей мочевой кислоты (уратов) и редко встречающиеся белковые камни – из цистина, ксантина, 2,8-дигидроксиаденина. Основные факторы развития мочекислого нефролитиаза: нарушение обмена пуриновых оснований, приводящее к образованию и/или выделению повышенного количества мочевой кислоты, и стойко низкий уровень рН мочи на фоне малого объема выделяемой мочи [10–12]. Повышенный уровень мочевой кислоты в сыворотке крови служит достаточно частой клинической находкой. Гиперурикемия чаще встречается среди представителей негроидной расы и мужчин, при этом уровень мочевой кислоты у мужчин довольно стабилен в течение жизни. Относительно низкий уровень урикемии у женщин репродуктивного возраста обусловлен влиянием эстрогенов на канальцевую экскрецию мочевой кислоты. С наступлением климактерического периода уровень мочевой кислоты повышается и приближается к таковому у мужчин соответствующего возраста [13]. Низкий уровень мочевой кислоты также отмечается у детей, он начинает повышаться в период полового созревания, достигая значений у взрослых индивидуумов. Нарушения обмена пуринов в большинстве случаев генетически предрасположены или определены. Дефект передается по наследству как доминантный признак. Гиперурикемия или предрасположенность к ней передается от отцов через здоровых матерей и бабушек или же дедов (прадедов) по материнской линии. При метаболическом типе нарушения пуринового обмена имеет место генетически обусловленный дефект ферментативной активности, приводящий к дисбалансу мочевой кислоты в организме, обусловленному недостаточностью глюкозо-6-фосфатазы, гипоксантингуанинфосфорибозилтрансферазы и повышением активности фосфорибозил-пирофосфатсинтетазы [14]. Определены три основных источника образования мочевой кислоты в организме человека: из пуринов, освобождающихся при тканевом распаде, из синтетически образуемых пуринов и из пуринов, поступающих с продуктами питания. Мочевая кислота образуется преимущественно в печени в результате распада нуклеотидов, дезаминирования аминопуринов (аденин, гуанин) и окисления оксипуринов (гипоксантин, ксантин). Алиментарный фактор обеспечивает третью часть от общего количества пуринов, а их дополнительное поступление в результате повышенного потребления белоксодержащих продуктов как животного, так и растительного происхождения может нарушать весьма жесткий баланс мочевой кислоты в организме. Ожирение, нарушение инсулинорезистентности, подагра, неопластические процессы и генетически обусловленная гиперурикемия служат дополнительным фактором формирования камней из мочевой кислоты. Воспалительные заболевания кишечника, оперативные пособия с использованием терминального отдела подвздошной кишки, илеостомия, резекция кишечника связаны с потерей бикарбоната и обезвоживанием, которое приводит к подкислению мочи и высокой предрасположенности к нефролитиазу. В целом у больных мочекислым нефролитиазом отмечаются высокий уровень мочевой кислоты, уменьшение содержания лимонной кислоты, значительное снижение концентрации глутамина и экскреции натрия и калия, а повышенное содержание аммиака в моче по отношению к натрию и калию связано с постоянным ацидозом мочи [15–18].
Основное количество мочевой кислоты выводится почками, что создает предпосылки для пресыщения мочи мочевой кислотой и активной ее кристаллизации при стабильно кислых значения рН, главным образом в области терминального отдела нефрона и на вершине почечного сосочка по типу пробок Рендалла. Проведение перорального литолиза в большинстве случаев является высокоэффективным методом лечения больных мочекислым нефролитиазом. Впервые смесь цитрата натрия, цитрата калия и лимонной кислоты для лечения мочекислого нефролитиаза была предложена H. Eisenberg в 1955 г. [19].
Возможности литолитической терапии определены химическими свойствами мочевой кислоты и ее солей. Мочевая кислота плохо растворяется в воде. Натриевая соль мочевой кислоты отличается в 17 раз более высокой растворимостью. Растворимость мочевой кислоты контролируется двумя константами диссоциации (рКа) за счет потери одного протона. Первая рКа с рН 5,5 регулирует превращение мочевой кислоты в более растворимый анионный урат, второй рКа с рН 10,3 клинического значения не имеет.
В жидкостях с рН ниже 5,75, что характерно для дистальных канальцев и собирательных трубочек, основной молекулярной формой является мочевая кислота, которая почти в 100% находится в недиссоциированной форме. Моча при рН 5 становится насыщенной уратами при концентрации 15 мг на 100 мл. При рН 5,75 кислота и ее соль присутствуют в эквимолярных количествах. При рН выше 5,75 доминирующая форма – натриевая соль мочевой кислоты. Если рН мочи достигает 7, то в ней может раствориться 150–200 мг уратов на 100 мл. Интенсивность кристаллизации мочевой кислоты и образования камней из нее можно в значительной мере уменьшить, смещая рН мочи в щелочную сторону (при этом будет доминировать более растворимая форма – урат натрия) [20–21].
Таким образом, к ведущим факторам при мочекислом камнеобразовании относятся пресыщение мочи мочевой кислотой и ее солями в результате чрезмерного поступления или производства мочевой кислоты, низкий диурез и стабильно кислая реакция мочи. Многочисленные клинические исследования доказали, что эффективному литолизу подлежат камни, состоящие из мочевой кислоты, дигидрата мочевой кислоты и смешанные камни, состоящие из мочевой кислоты и 25% кальция оксалата. Исходя из вышесказанного, необходимым условием для назначения литолитической терапии и эффективной метафилактики считается знание химического состава камня и результатов полноценного обследования с целью выявления метаболических нарушений и сопутствующих заболеваний. Кроме оценки биохимических показателей крови необходимо минимум двукратное исследование суточных проб мочи, собранных при обычном питьевом и пищевом режиме [22]. Ориентироваться на результаты анализа разовой порции мочи для оценки метаболических нарушений не представляется возможным. Однако исследования последних лет показали, что в некоторых случаях альтернативой исследованию суточной пробы мочи может служить 12-часовая проба ночной мочи. Исследование, проведенное B. D. Hinck et al. [23], показало, что данные 12-часовой ночной порции мочи имеют сильную корреляцию с 24-часовой порцией при оценке метаболических нарушений. Определение множественных обменных нарушений может приводить к ограничению или расширению лекарственной терапии.
Основой растворения камней из мочевой кислоты является ощелачивание мочи до значений, при которых мочевая кислота из нерастворимой лактамной/кетоформы переходит растворимую лактимную/еноформу. В настоящее время рекомендуемыми целевыми значениями рН мочи для растворения камней являются 7,0–7,2, для предупреждения образования рецидивов показано поддержание рН в пределах 6,2–6,8 [12]. Литолитическая терапия проводится цитратными смесями. Дозировка цитратной смеси подбирается индивидуально согласно корректировке колебаний рН мочи в течение суток (утро–обед–вечер); (см. вклейку на обложке). Любые мероприятия, направленные на растворение или предупреждение рецидива мочекислого камня, необходимо начинать с разъяснения условий формирования камня и мер их предотвращения. Основной рекомендацией для снижения пресыщения мочи является увеличение объема потребляемой жидкости до достижения суточного диуреза не менее 2,0–2,5 л. Многочисленными исследованиями доказано, что при диурезе около 100 мл в час вероятность кристаллизации и агрегации мочевых кристаллов резко снижается. Это обусловлено и относительным уменьшением количества кристаллов в единице объема мочи, увеличением расстояния между кристаллами, что нивелирует воздействие Вандер-Вальсовых сил и увеличивает скорость прохождения болюса мочи по нефрону, а соответственно, уменьшает длительность нахождения кристалла в просвете нефрона. При этом следует сказать, что цель увеличения потребления жидкости не только в разведении концентрации камнеобразующих веществ, но и в повышении уровня рН мочи и мочевого цитрата, который повышается при ощелачивании мочи и является мощнейшим ингибитором образования камней. Добиться этого возможно не только увеличением потребления водопроводной воды, рН которой приближается к нейтральным значениям. Целесообразно рекомендовать употребление гидрокарбонатных минеральных вод, обладающих мощным подщелачивающим эффектом, в объеме 0,5–1,0 л в сутки. Рекомендованы нейтральные (6,8–7,2), слабощелочные (7,2–8,5) и щелочные (рН выше 8,5) минеральные воды с низкой минерализацией – Смирновская, Славяновская, Рычал-Су, Архыз, Бжни, Есентуки, Нарзан, Черелия, Боржоми, Пролом и т.д. [24].
В рамках оценки колебаний pH мочи на фоне приема минеральной воды и цитратных смесей (Блемарен: лимонная кислота 1,197 г + калия бикарбонат 967,5 мг + натрия цитрат 835,5 мг) нами проведен анализ результатов обследования и лечения 98 пациентов с мочекислым нефролитиазом. Среди пациентов были 53 (54,1%) мужчины и 45 (45,9%) женщин, их средний возраст составил 43,32 года.
Всем пациентам до начала исследования проведено суточное мониторирование колебаний рН мочи при обычном питьевом и пищевом режиме троекратно через равные промежутки времени (I – 8.00, II – 14.00, III – 20.00) в течение 3–5 дней. рН мочи измеряли с помощью индикаторной бумаги с последующим сравнением со шкалой.
Пациенты были распределены нами в три группы.
В первой группе (n=33) питьевой режим предусматривал прием низкоминерализованной щелочной минеральной воды (рН выше 8,5) в объеме 1000 мл/сут, разделенном на 3 порции. Пациенты второй группы (n=33) принимали цитратные смеси в стандартной дозировке 3 раза в сутки. Пациенты третьей группы (n=32) одновременно употребляли щелочные минеральные воды в объеме 1000 мл/сут и цитратные смеси в стандартной дозировке 3 раза в сутки. Во всех группах проводили измерения показателей рН мочи на фоне терапии троекратно в течение суток в те же часы. Исходный уровень рН мочи во всех группах составил в среднем 5,5±0,5.
Добавление в рацион питания минеральной воды приводило к смещению колебаний рН мочи до уровня 5,5–6,0; 5,8–6,2; 5,6–6,2 со средним значением 5,8, 6,0, 5,9 в утреннее, дневное и вечернее время соответственно (рис. 1).
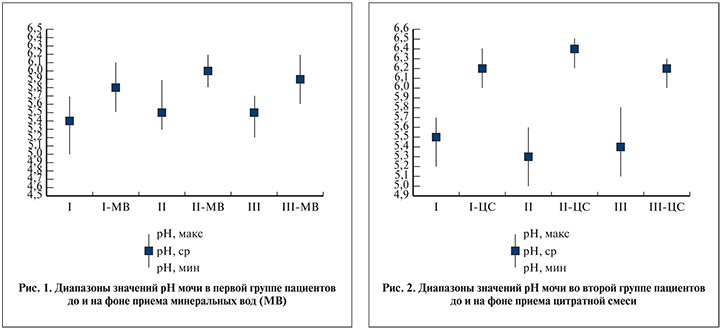
Добавление минеральной воды в питьевой рацион приводит к стойкому повышению уровня рН мочи в среднем на 0,4–0,5. Такие изменения рН мочи не приводят к литолитическому эффекту, однако у пациентов со слабокислой реакцией мочи это может позволить добиваться ее нейтрализации, что может быть использовано пациентами со свободными мочевыми путями как профилактика рецидива камнеобразования.
Применение пациентами второй группы цитратных смесей в стандартной дозе (1 шипучая таблетка) 3 раза в день приводило к смещению колебания рН мочи до уровня 6,0–6,4; 6,2–6,5; 6,0–6,3 со средним значением 6,2; 6,4; 6,2 в утреннее, дневное и вечернее время соответственно. Проведение цитратной терапии в указанной дозировке приводило к повышению уровня рН мочи в среднем на 0,7–1,1 (рис. 2).
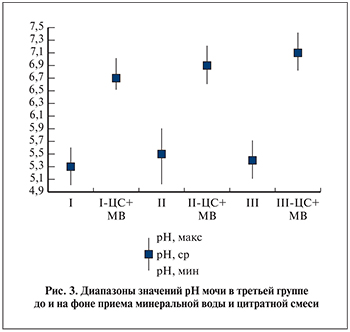 Повышение уровня рН в пределах указанного интервала не всегда позволяет достигать целевых показателей рН при проведении литолитической терапии, что диктует необходимость продолжения коррекции дозирования препарата в каждом индивидуальном случае.
Повышение уровня рН в пределах указанного интервала не всегда позволяет достигать целевых показателей рН при проведении литолитической терапии, что диктует необходимость продолжения коррекции дозирования препарата в каждом индивидуальном случае.
Пациенты третьей группы, получавшие комбинированную терапию, отметили смещение колебаний рН мочи до уровня 6,5–7,0; 6,6–7,2; 6,8–7,4 со средним значением 6,7; 6,9; 7,1 в утреннее, дневное и вечернее время соответственно (рис. 3).
У пациентов третьей группы уровень рН мочи оказался значимо выше, чем у пациентов первой и второй групп. Соответственно, сочетанное применение щелочных минеральных вод и цитратных смесей позволяет повышать уровень рН мочи до целевых значений.
Мочевой цитрат служит важным фактором ингибирования образования мочевых камней за счет подавления агрегации и агглютинации камнеобразующих веществ, ощелачивания мочи и подавления оксидативного стресса. Кишечная абсорбция служит важнейшим фактором поступления цитрата, а печень и почки — это главные органы, где происходят метаболизм и экскреция. Механизм подщелачивающего действия цитратов обусловлен двумя факторами: 1) цитраты в организме метаболизируются в бикарбонат и выступают в качестве системных подщелачивающих средств; выделяясь в неизменном виде с мочой, 2) цитраты являются дополнительной буферной системой, способствующей связыванию избытка ионов водорода и смещению pH в щелочную сторону. При проведении литолитической терапии и метафилактики обязательно существенное увеличение потребления фруктов – источников жидкости, растительных волокон, лимонной кислоты. Предпочтение надо отдавать фруктам с высоким содержанием цитрата – цитрусовым, винограду, бананам и т.д. [25, 26]. Свежевыжатые соки, лимонады, компоты без подсластителей, консервантов и не обогащенные витамином С, в сезон – арбузы, дыни и т.п. обладают доказанным эффектом повышения рН мочи, уровня мочевого цитрата и снижения экскреции камнеобразующих веществ [27, 28]. Изменение уровня рН мочи носит выраженный индивидуальный характер. В целом комбинированное применение минеральных вод, фруктов/соков с высоким содержанием цитрата позволяет увеличить объем потребляемой жидкости, уровень рН и мочевого цитрата.
Цитраты не воздействуют непосредственно на мочекислые камни. Механизм действия цитратов нельзя рассматривать как простое подщелачивание мочи. Растворение мочекислых камней происходит вследствие замещения водорода гидроксильных групп мочевой кислоты во 2-м и 6-м положениях пуринового ядра на щелочные металлы, поступающие из цитратов. Литолиз – это сложный биохимический процесс. И только после нормализации пуринового обмена можно рассчитывать на эффективность цитратной терапии.
Важным аспектом снижения влияния алиментарного фактора на уровень мочевой кислоты является изменение пищевых пристрастий. В исследовании M. Q. Fakhoury et al. показано, что информированность пациентов в плане диетических рекомендаций является крайне ограниченной. При этом показано, что более 70% пациентов готовы внести изменения в свой рацион при наличии соответствующей информированности. И авторы подчеркивают необходимость комплексных стратегий обучения пациентов по изменяемым факторам риска развития нефролитиаза [29]. При мочекислом камнеобразовании ведущим является существенное снижение потребления белоксодержащих продуктов. В перечень белоксодержащих продуктов входит не только «красное» мясо (говядина, свинина, баранина), но и птица, рыба, морепродукты, наваристые бульоны, студень, фасоль, бобовые и т.д. Употребление продуктов, содержащих массу белка, должно быть ограничено 2–3 разами в неделю, причем их прием должен обязательно сочетаться со значительным количеством растительной составляющей – овощами. Известно, что белок способствует подкислению мочи, растительная составляющая – ощелачиванию. Необходимо адекватное нивелирование этих эффектов пищевых продуктов. Зная, что длительное проведение литолитической терапии может приводить к увеличению производства оксалата, рекомендуем нашим пациентам не злоупотреблять продуктами, содержащими высокое количество оксалата. При употреблении же оксалатсодержащих продуктов рекомендуется сочетать их с продуктами, содержащими значительное количество кальция. Такое сочетание целесообразно для уменьшения всасывания оксалата в кишечнике за счет образования кальцийоксалатных комплексов.
На фоне нормализации питьевого режима, создания условий для ощелачивания мочи и уменьшения влияния алиментарного фактора назначается лекарственная терапия. Вопрос о целесообразности обязательного назначения ингибиторов ксантиноксидазы при проведении липолитической терапии остается дискутабельным. Согласно рекомендациям Европейского общества урологов, назначение аллопуринола в минимальной дозе показано всем пациентам с мочекислым нефролитиазом и выявленной гиперурикурией [30]. В рекомендациях же Американской ассоциации урологов говорится, что назначение аллопуринола показано лишь в случае неэффективности цитратной терапии (например, при воспалительных заболеваниях кишечника, хронической диарее, наличии илеостомы) или при рецидивирующем, несмотря на адекватно проводимую цитратную терапию, течении МКБ. Несомненен тот факт, что назначение ингибиторов ксантиоксидазы показано всем пациентам с выявленной гиперурикемией. Доза лекарственного препарата подбирается индивидуально. Терапия проводится длительно или на постоянной основе.
Контроль эффективности литолиза проводится регулярным (каждые 1–2 месяца) ультразвуковым исследованием почек, при необходимости нативным (без контрастирования) компьютерным исследованием. Не менее важным остается вопрос длительности проводимой лекарственной терапии. Исходя из того что нарушения пуринового обмена чаще всего генетически предопределены, становится понятным, что прекращение проведения метафилактических мероприятий как общего, так и специального (лекарственного) характера в кратчайшие сроки приведет к восстановлению условий для камнеобразования.
Заключение. Изменения питьевого и пищевого режимов должны стать образом жизни и лишь это позволит сократить, а в некоторых ситуациях и избавить от лекарственной составляющей для эффективной метафилактики мочекислого нефролитиаза. Применение щелочных минеральных вод приводит к ощелачиванию мочи, а совместное применение их с цитратными смесями облегчает подбор целевых значений рН мочи в период не только литолиза, но и метафилактики. Также целесообразно не отказываться от микродоз цитратных смесей, которые будут служить по меньшей мере донатором цитрата, даже не оказывая существенного влияния на pH мочи [31].



