Гиперактивный мочевой пузырь (ГМП) относится к изнурительным хроническим расстройствам и встречается примерно у 17% мужчин и женщин в возрасте старше 40 лет, причем распространенность увеличивается с возрастом [1, 2]. Пациенты с ГМП обычно страдают от императивных позывов к мочеиспусканию, учащенного мочеиспускания и ноктурии с/без недержания мочи [3]. Результаты проведенного в США исследования по выявлению ГМП (NOBEL) показали, что ГМП распространен больше, чем другие хронические состояния, такие, например, как болезни сердечно-сосудистой системы, синуситы и астма [2].
Гиперактивный мочевой пузырь – это синдром, оказывающий серьезное негативное влияние на качество жизни, особенно связанное с ограничениями в повседневной жизни, с которыми сталкиваются пациенты [4]. Симптомы ГМП влияют на все аспекты жизни, в том числе социальные (необходимость частых мочеиспусканий вне зависимости от местонахождения, что приводит к постоянному поиску туалетов и значительно ухудшает качество жизни пациентов), психологические (снижение самооценки, связанное с недержанием мочи), физические (ограничения физической активности из-за страха недержания мочи) и профессиональные (снижение производительности) [3].
В США затраты на лечение пациентов с ГМП за 2000 г. оценены в пределах от 12 до 17,5 млрд долл. Это делает экономические последствия ГМП сопоставимыми с такими заболваниями, как грипп, артрит и остеоартрит [5].
Краеугольным симптомом ГМП служит ургентность [1, 6], которая определяется как жалоба на внезапное повелительное желание пойти помочиться, которое трудно отложить [3]. Этот симптом связан с частотой мочеиспусканий и ноктурией. Приблизительно 66% пациентов с ГМП не имеют недержания мочи, и заболевание при этом классифицируется как «сухой» ГМП. У остальных 33% присутствует ургентность, связанная с недержанием мочи, и ГМП при этом называют «мокрым» [2]. Уродинамическое исследование демонстрирует, что у пациентов с «мокрым» ГМП существует чрезмерная активность детрузора, когда потеря мочи возникает из-за непроизвольного сокращения последнего [3].
Существует множество вариантов лечения пациентов с ГМП, включая биологическую обратную связь, электрическую стимуляцию, тренировку мочевого пузыря и фармакотерапию, которые могут быть использованы как самостоятельно, так и в сочетании. Однако первичной терапией ГМП остается фармакотерапия антагонистами мускариновых рецепторов [7–9], которые применялись в течение многих лет.
Оксибутинин – первый антагонист мускариновых рецепторов, использованный для лечения ГМП. Новые антимускариновые препараты включают селективные антагонисты м3-холинорецепторов (дарифенацин и солифенацин) и селективные антагонисты м2 и м3-холинорецепторов – толтеродин и родственный ему фезотеродин, обладающие сбалансированной аффинностью к м2- и м3-мускариновым рецепторам.
Роль мускариновых рецепторов в физиологии мочевого пузыря
Традиционная догма лечения ГМП антагонистами мускариновых рецепторов основана на нашем понимании иннервации мочевого пузыря и его физиологической функции. Во время наполнения мочевого пузыря мышца детрузора расширяется при низком давлении. За это время участок стенки мочевого пузыря инициирует высвобождение медиаторов (таких, как АТФ) из уротелия, который сигнализирует о полноте мочевого пузыря посредством афферентной иннервации [10]. Сигналы от этих афферентных нервов обрабатываются в центре мочеиспускания в стволе головного мозга и в соответствующее время активируют эфферентные парасимпатические нервные волокна. Эфферентные парасимпатические волокна, расположенные в детрузоре, высвобождают ацетилхолин [11].
Существует 5 подтипов мускариновых рецепторов (м1–м5), клонированные и фармакологически охарактеризованные [12]. В мочевом пузыре, как и в других гладких мышечных волокнах, было идентифицировано несколько подтипов мускариновых рецепторов [13]. Исследования по связыванию и иммунопреципитации [14–17] продемонстрировали, что большинство мускариновых рецепторов, присутствующих в мышцах детрузора человека, относится к подтипу м2 (около 70%), доля м3- и м1-холинорецепторов существенно ниже – 20 и 10% соответственно [17]. Активация мускариновых рецепторов ацетилхолином приводит к сокращению мышцы детрузора и последующему опорожнению мочевого пузыря. Функциональные исследования м3-холинорецепторов, проведенные на мышах [18] и человеке [19, 20], показали, что рецепторы данного подтипа ответственны за сокращение мышцы детрузора. Тем не менее есть доказательства того, что м2-холинорецепторы также имеют некоторую функциональную значимость [21, 22]. Традиционно антагонисты мускаринов используют для лечения ГМП, полагая, что они ингибируют активацию мускариновых рецепторов, ответственных за сокращения детрузора. Поскольку оба подтипа холинорецепторов, м2 и м3, связаны с сокращением детрузора, антагонисты мускариновых рецепторов были охарактеризованы в зависимости от их сродства к этим подтипам рецепторов.
Антимускариновая терапия ГМП
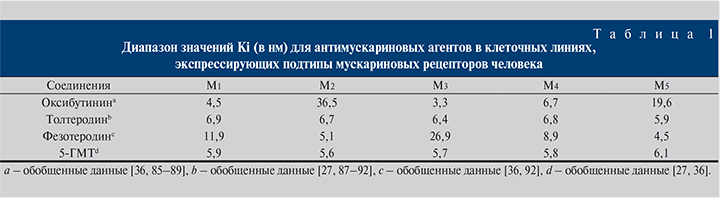
Началом эры терапии ГМП послужило доказательство, что оксибутинин уменьшает сокращения детрузора кролика в ответ на мускариновый агонист карбохол [23], хотя оксибутинин не является селективным для какого-либо подтипа мускариновых рецепторов (табл. 1).
Затем было показано, что оксибутинин эффективно предотвращает спазмы (спонтанные сокращения) детрузора после трансуретральных вмешательств [24]. Вскоре в начале 1980-х гг. последовало много сообщений об оксибутинине, который обеспечивает симптоматическое облегчение для пациентов с нестабильностью детрузора [25, 26].
В 1998 г. был впервые представлен еще один антагонист мускариновых рецепторов – толтеродин. Подобно оксибутинину толтеродин считается селективным для отдельных подтипов мускариновых рецепторов (см. табл. 1, Ki на рецепторах м3 и м2, равных 6,4 и 6,7 нМ соответственно) [27]. Так же как оксибутинин, толтеродин эффективен в лечении ГМП [28–32]. Было показано, что клиническая эффективность толтеродина ассоциируется как с самим толтеродином, так и с его активным метаболитом 5-гидроксиметилтолтеродином (5-ГMT) [33–35]. Как и толетеродин, 5-ГMT демонстрирует сходное сродство к отдельным подтипам мускариновых рецепторов (см. табл. 1 Ki на рецепторах м3 и м2 5,7 и 5,6 нМ соответственно [27, 36]. Новейшим мускариновым антагонистом для терапии ГМП является фезотеродин. Фезотеродин, структурно схожий с толтеродином, характеризуется образованием того же активного метаболита, 5-ГMT [37, 38], хотя механизм, лежащий в основе производства 5-ГMT, значительно отличается.
 Фармакокинетика фезотеродина и толтеродина
Фармакокинетика фезотеродина и толтеродина
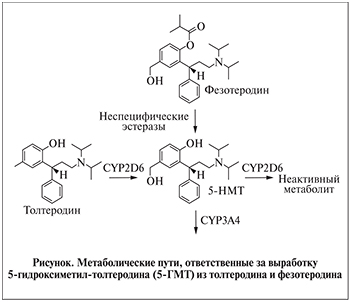
Активный метаболит толтеродина – это 5-ГMT, который образуется под действием цитохромома P450 2D6 (CYP2D6) [34] (рис. 1), генетический полиморфизм которого имеет высокую клиническую значимость. CYP2D6 отвечает за изменчивость в метаболизме более 100 различных лекарственных препаратов [39, 40]. На основании фенотипа CYP2D6 пациенты характеризуются как экстенсивные метаболизаторы, если у них есть два функциональных аллеля CYP2D6, или бедные метаболизаторы, которым не хватает функциональных аллелей CYP2D6 [40]. До 10% пациентов в белых популяциях и 19% – в черных характеризуются как бедные метаболизаторы [40]. У пациентов, классифицированных как экстенсивные метаболизаторы, 81% поглощенного толтеродина экстрагируется при метаболизме первого прохода через печень и гидролизуется до 5-ГМТ со средней максимальной концентрацией в плазме толтеродина и 5-ГМТ 5,2 и 4,8 нг/мл соответственно [39]. Напротив, у бедных метаболизаторов только 18% толтеродина выделяются при метаболизме первого прохода через печень, а средняя максимальная концентрация в плазме толтеродина повышается до 38 нг/мл, тогда как 5-ГМТ не обнаруживается [39]. Кроме того, концентрация 5-ГМТ, высвобождаемого при метаболизме толтеродина, сильно варьируется (от 1 до 100 нг/мл) и эта изменчивость в выработке активного метаболита делает необходимым индивидуальный подбор дозы для некоторых пациентов [39, 41].
Фезотеродин был разработан как препарат пролонгированного высвобождения с максимальными концентрациями 5-ГМТ в плазме в течение 4–6 ч после перорального приема [42]. В отличие от толтеродина образование активного метаболита из фезотеродина не зависит от активности CYP2D6 (см. рисунок), а происходит из-за гидролиза фезотеродина неспецифическими эстеразами. Отсутствие фезотеродина в плазме пациентов указывает на его быстрый и полный метаболизм [41, 43]. Кроме того, в отличие от толтеродина концентрация 5-ГMT в плазме при использовании фезотеродина имеет низкие межиндивидуальные различия, так как активность неспецифических эстераз одинакова для всех людей [37, 44]. Пероральное введение разовой дозы 4 мг фезотеродина приводит к максимальной концентрации в плазме 5-ГМТ – от 1 до 10 нг/мл. Кроме того, плазменные концентрации 5-ГMT линейно возрастают с увеличением дозы фезотеродина [41]. Большая доля активного метаболита 5-ГMT переносится плазмой в несвязанном виде (36–54%) [39, 42] в отличие от толтеродина, который почти полностью связан с сывороточным альбумином (3,7% несвязанных) [39].
Дальнейший метаболизм 5-ГMT, являющегося производным толтеродина или фезотеродина, происходит под воздействием цитохрома P450 3A4 и CYP2D6 (см. рисунок) и поэтому отличается от экстенсивных и плохих метаболизаторов [45, 46]. Примерно 70% дозы фезотеродина выводится посредством мочи и примерно 16%, как 5-ГMT, остальное – как неактивные метаболиты [42, 43]. Выделение 5-ГMT с мочой увеличивается пропорционально дозе фезотеродина [43]. Экскреция 5-ГMT замедляется у пациентов с почечной недостаточностью, однако эта задержка в экскреции не была связана со значительным увеличением побочных эффектов у данных пациентов [42].
Эффективность фезотеродина и толтеродина в клинических испытаниях
Недавние рандомизированные контролируемые исследования сравнивали клиническую эффективность фезотеродина с плацебо и толтеродином [37, 47–49]. Как видно из табл. 2, фезотеродин и толтеродин эффективны в отношении симптомов, связанных с наполнением мочевого пузыря (учащенное мочеиспускание и средний объем мочеиспускания) и ургентностью (эпизоды императивного недержания мочи).

Что касается симптомов, связанных с наполнением мочевого пузыря, лечение в течение 12 нед. однократной суточной дозой фезотеродина (4 мг) приводило к значительному уменьшению частоты мочеиспускания (на 5,5% больше, чем средний эффект плацебо), что соответствует снижению на 1,7 мочеиспусканий в течение суток. Прием фезотеродина (4 мг) также был связан с увеличением среднего объема мочеиспускания на 25,1 мл против среднего увеличения в группе плацебо на 9,3 мл. Полученные клинические результаты применения фезотеродина (4 мг) были сопоставимыми с таковыми толтеродина (4 мг; см. табл. 2) [47, 49].
Фезотеродин также эффективен в отношении симптомов, связанных с ургентностью. Лечение фезотеродином 4 мг приводило к значительному уменьшению числа эпизодов ургентного недержания мочи и ургентности. У пациентов с «мокрым» ГМП частота эпизодов недержания при мочеиспускании снижалась на 26,6% больше, чем на фоне приема плацебо, что меньше на 1,9 эпизода недержания мочи за 24 ч (см. табл. 2). Кроме того, наблюдалось значительное снижение ургентных эпизодов, что на 8,2% больше, чем средний эффект плацебо (табл. 2).
Одна из интересных особенностей лечения фезотеродином заключается в том, что повышения клинического эффекта можно достичь путем увеличения дозы препарата с 4 до 8 мг (табл. 2). Так, лечение с использованием 8 мг фезотеродина приводило к значительному уменьшению эпизодов недержания мочи в течение 24 ч (на 9,1% больше, чем при применении 4 мг фезотеродина), а также увеличению среднего объема мочеиспускания (на 8 мл превышало среднее улучшение при применении 4 мг препарата). Кроме того, лечение 8 мг фезотеродина связано с увеличением числа дней без недержания мочи в неделю – до 3,1 дня по сравнению с 2,7 дня на фоне приема 4 мг [47–49].
Фезотеродин демонстрирует эту зависимость дозировка–ответ, так как подобная связь не была продемонстрирована для некоторых других антимускариновых агентов, включая толтеродин [50–52], или селективный препарат для м3-холинорецепторов, дарифенацин и солифенацин [53, 54]. Вполне вероятно, что эта зависимость от дозы является результатом простого метаболизма фезотеродина неспецифическими эстеразами и связанной с этим линейной взаимосвязью между дозой фезотеродина и концентрациями активного соединения в плазме 5-ГMT [41, 43].
Наряду с улучшением клинических результатов прием фезотеродина также был связан с улучшением качества жизни (HRQoL). Вопросник по оценке качества жизни King’s Health Questionnaire (KHQ), который состоит из 9 групп различных вопросов, связанных с качеством жизни пациента, был использован для оценки улучшений со стороны качества жизни пациентов, страдающих от ГМП, после 12-недельного лечения фезотеродином [55–57]. Значительное улучшение в пяти или более областях данного опросника KHQ указывает на значимое улучшение качества жизни пациентов [58]. Подобный эффект был обусловлен принимаемой дозой препарата. Так, прием 8 мг фезотеродина сопровождался значительным улучшением по 8 из 9 групп вопросов, тогда как назнчение 4 мг – в 7 из 9 [59]. Все улучшения кроме пользы для личных отношений наблюдались у пациентов, классифицированные как ГМП с потерей мочи [56]. Кроме того, анкетирование с помощью того же опросника KHQ показало более выраженное улучшение качества жизни (эмоции, состояние режима сна/бодроствования) на фоне приема 8 мг по сравнению с 4 мг [57].
Неблагоприятные явления, связанные с фезотеродином
Несмотря на то что мускариновые антагонисты могут использоваться для эффективного лечения ГМП примерно у 65% пациентов, многие пациенты прекращают длительную терапию из-за неблагоприятных явлений, включая сухость во рту и запоры [59]. Эти побочные эффекты обусловлены отсутствием органоспецифичности антимускариновых препаратов, так как холинорецепторы расположены не только в детрузоре, но и в слюнных железах и гладких мышцах желудочно-кишечного тракта [13, 60–62]. Встречаемость этих неблагоприятных событий в клинических исследованиях представлена в табл. 3 [37, 47–49].
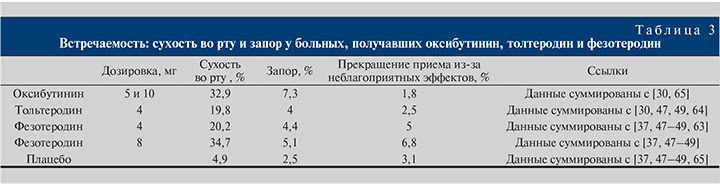
Сухость во рту остается наиболее распространенным побочным эффектом, связанным с использованием фезотеродина (см. табл. 3), хотя большинство пациентов описали ее как умеренную. Двадцать процентов пациентов, получавших 4 мг фезотеродина, сообщили о сухости во рту [37, 47–49, 63]. Это число увеличилось до 35% у пациентов, получавших фезотеродин в дозировке 8 мг [37, 47–49], по сравнению с 6% случаев в группе плацебо. Частота возникновения сухости во рту с использованием фезотеродина 4 мг была сопоставимой с частотой возникновения у пациентов, получавших толетродин в дозе 4 мг [47, 49, 64], однако она была значительно ниже, чем в группе оксибутинина (см. табл. 3) [30, 65].
Причиной снижения частоты появления сухости во рту при лечении фезотеродином по сравнению с оксибутинином может быть более высокая селективность 5-ГМТ к рецепторам мочевого пузыря по сравнению с слюнными железами (табл. 4). Исследования с радиофармпрепаратом показали, что оксибутинин имеет в 3 раза более высокое сродство к слюнной железе, чем к мочевому пузырю (см. табл. 4).
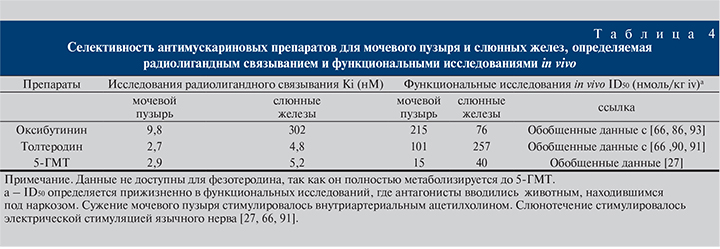
Кроме того, были проведены функциональные исследования, в которых изучали селективность оксибутинина, толтеродина и 5-ГМТ к мочевому пузырю и слюнным железам путем сравнения концентраций, необходимых для ингибирования сокращения детрузора и слюноотделения in vivo. Установлено, что 5-ГMT ингибирует сокращения мочевого пузыря при более низкой концентрации, чем той, необходимой для ингибирования слюноотделения, что указывает на некоторую степень избирательности по отношению к мочевому пузырю [66].
Влияние антимускариновых препаратов на ургентность
Согласно результатам клинических исследований фезотеродин и толтеродин в ряду других антагонистов антимускариновых рецепторов продемонстрировали эффективность в отношении симптомов ургентности, что подтверждается уменьшением частоты эпизодов недержания мочи и снижением числа ургентных позывов в течение 24 ч (см. табл. 2) [37, 47–49, 67]. Это похоже на отчеты клинических испытаний с другими антагонистами мускариновых рецепторов, включая селективный м3-холиноблокатор солифенацин [68–70] и троспиум [71]. Однако это положительное влияние на симптомы ургентности ставит вопрос: насколько актуальна чувствительность к рецепторам и почему антимускариновые агенты эффективны в отношении ургентности? Важно ответить на эти вопросы и понять: насколько эффективны эти антимускариновые препараты против ургентности, так как она является краеугольным симптомом ГМП и одновременно ведущим симптомом, который пациенты считают наиболее неприятным [6]?
Фезотеродин – пролекарство, разработанное для производства активного метаболита, 5-гидроксиметил-толтеродина (5-ГMT), посредством действия неспецифических эстераз. Этот метаболизм фезотеродина приводит к полному расщеплению исходного соединения и отвечает за связанные с дозой улучшения клинической эффективности и качества жизни пациентов. Показано, что фезотеродин, как и другие антимускариновые препараты, обладает клинической эффективностью для лечения пациентов, страдающих ГМП. Лечение фезотеродином связано с улучшением клинических показателей, связанных как с наполнением мочевого пузыря (снижение частоты мочеиспускания и увеличение среднего объема мочеиспускания), так и с ургентностью (эпизоды ургентности и императивное недержание мочи). Фезотеродин также связан со значительными улучшениями качества жизни, о чем свидетельствуют улучшения по крайней мере в 7 из 9 переменных, измеренных в опроснике King’s Health Questionnaire. Прием фезотеродина, как и других антимускариновых препаратов, связан с побочными эффектами, такими как сухость во рту и запор. Однако частота этих нежелательных явлений снижается по сравнению с исходным мускариновым антагонистом оксибутинином благодаря улучшенной селективности 5-ГMT.



