Введение. Доброкачественная гиперплазия предстательной железы (ДГПЖ) – с возрастом прогрессирующее заболевание мужчин, проявляющееся постепенным увеличением объема предстательной железы (ПЖ) вследствие разрастания ее периуретральной железистой зоны и сопровождающееся симптомами нижних мочевыводящих путей (СНМП), что ухудшает качество жизни (КЖ) и нередко приводит к необходимости оперативного вмешательства. ДГПЖ выявляется в 11,3% у мужчин в возрасте до 50 лет, в 40% – до 60, в 80% – до 80 лет [1]. У 75% мужчин старше 50 лет СНМП служат следствием ДГПЖ. Увеличение продолжительности жизни и числа мужчин пожилого и старческого возраста, улучшение качества медицинской помощи и социально-экономических показателей во многих странах мира, к сожалению, способствовали и росту числа больных ДГПЖ [2].
В патогенезе ДГПЖ наряду с другими механизмами установлено повышение активности 5α-оксиредуктазы, что приводит к снижению концентрации 5α-андростендиола, представляющего адренорецепторы, и способствует повышению уровня эстрогенов, количества и активности α1-адренорецепторов (α1-АР) [3]. При ДГПЖ наиболее распространенным в ткани ПЖ является подтип α1Аадренорецепторов [1]. Стимуляция α1А-адренорецепторов клинически проявляется ирритативной симптоматикой (увеличением частоты мочеиспусканий, ургентными позывами, ноктурией), как следствие – ухудшением КЖ пациента. Чрезмерная стимуляция α1А-АР повышает тонус гладкой мускулатуры шейки мочевого пузыря, простатического отдела уретры и ПЖ, а также поддерживает высокое внутриуретральное давление [1]. Поскольку α1АР в основном представлены в стромальном компоненте ПЖ, и увеличение их числа, и их активация приводят к динамическому компоненту инфравезикальной обструкции (ИВО). По мере прогрессирования заболевания развиваются функциональные и морфологические изменения детрузора с нарушением кровообращения и гипоксией тканей [4].
Первоочередная задача лечения СНМП/ДГПЖ заключается в быстром и эффективном контроле над СНМП. До недавнего времени основным методом лечения больных ДГПЖ был преимущественно оперативный. Однако достижения фундаментальной науки в изучении основных механизмов патогенеза этого заболевания настолько велики, а успехи фармацевтической промышленности в разработке современных медикаментозных средств настолько значимы, что в 80–90% случаев первой линией терапии этой категории больных стало назначение лекарственных средств [5]. Цели медикаментозного лечения больных СНМП/ДГПЖ условно делятся на краткои долгосрочные. К краткосрочным целям можно отнести устранение СНМП, улучшение скорости потока мочи, улучшение КЖ или подготовка пациента к оперативному лечению. Долгосрочные цели предполагают снижение как риска развития осложнений, связанных с ИВО, так и необходимости оперативного вмешательства, что особенно важно в случаях наличия серьезных сопутствующих заболеваний. Определены основные принципы консервативного лечения больных ДГПЖ [6].
Современный арсенал специфических лекарственных препаратов для ДГПЖ разнообразен и в зависимости от показаний позволяет проводить как моно-, так и комбинированную терапию. Выбор препарата, основанный на преобладании и тяжести симптомов опорожнения или накопления, позволяет врачу осуществлять персонифицированный подход к лечению. Исходя из патогенеза ДГПЖ, в настоящее время α1-адреноблокаторы (α1-АБ) занимают ведущее место. Их применение способствует снижению тонуса гладкой мускулатуры предстательной железы и уретры, что приводит к снижению уретрального сопротивления току мочи, нивелированию динамической составляющей ИВО, улучшению кровообращения в мочевом пузыре и простате. Назначение α1-АБ можно отнести к «золотому» стандарту консервативной терапии ДГПЖ [7]. Однако следует отметить, что монотерапия α1-АБ на ранних стадиях ДГПЖ рекомендуется больным без факторов риска прогрессирования заболевания [8]. При объеме простаты >40 см3 и наличии других факторов риска прогрессирования заболевания для пациентов с ДГПЖ предпочтительна комбинированная терапия (сочетание α1-АБ и ингибиторов 5 альфа-редуктазы) [9].
Современные α1-АБ имеют разную простатотропность, обусловливающую выраженность возможных побочных эффектов (в основном влияние на сердечно-сосудистую систему и половую функцию). Алфузозин обладает максимальным по сравнению с другими α1-АБ индексом простатоселективности (простатотропности), быстро вымывается из плазмы крови и накапливается в тканях простаты [10, 11].
Проявления СД считаются распространенной проблемой среди пациентов, принимающих α1-АБ. Эффективно купируя СНМП, применение α1-АБ может сопровождаться рядом побочных эффектов, включая нарушения в сексуальной сфере. Тем временем международные исследования показали, что многие больные СНМП вследствие ДГПЖ считают для себя важным сохранение половой активности [12]. Однако, по данным Mondul et al., при наличии у мужчин СНМП риск развития ЭД оказался выше на 40%. У многих пациентов с ДГПЖ возникает необходимость в коррекции ЭД при проведении консервативного лечения [12]. По данным другого исследования, у 17,4% больных, принимающих тамсулозин, и 14,2% – силодозин, развитие расстройств в сексуальной сфере, по мнению респондентов, может стать даже причиной отказа от дальнейшего лечения [13]. У других представителей группы α1-адреноблокаторов этот показатель находится в пределах 7–8% [13]. Из-за возникновения подобных НР назначение данной группы препаратов требует индивидуального подхода.
Исходя из вышесказанного, становится очевидным, что зарегистрированные на фармацевтическом рынке препараты для консервативного лечения СНМП при ДГПЖ требуют их дальнейшего изучения в условиях реальной практики – для оценки их влияния на частоту и выраженность побочных эффектов, на сексуальную функцию мужчины, а также изучения влияния α1-АБ на качество жизни пациентов.
Целью проведенного неинтервенционного исследования была оценка в реальной клинической практике влияния препарата Алфупрост® МР 10 мг однократно в сутки на сексуальную функцию пациентов с функциональными СНМП, обусловленными ДГПЖ, при длительности его применения в течение 3 мес.
Задачи исследования включали оценку на фоне терапии алфузозином (препарат Алфупрост® МР в дозировке 10 мг однократно в сутки) динамики выраженности СНМП, качества жизни больных ДГПЖ по данным опросника Международного индекса симптомов при заболеваниях простаты (IPSS) и шкалы качества жизни (QoL), частоты и выраженности ночной поллакиурии, динамики максимальной скорости потока мочи (Qmax) по данным урофлоуметрии и объема остаточной мочи по данным ультразвукового исследования (УЗИ). Основное внимание уделено влиянию препарата на сексуальную функцию этих больных (по данным опросника для оценки Международного индекса эректильной функции, МИЭФ), а также влиянию на различные аспекты сексуальной функции: эректильную, оргазм, сексуальное желание, удовлетворение половым актом и общую сексуальную удовлетворенность. Нами проведен анализ удовлетворенности пациентов лечением (по шкале Лайкерта для пациента) и анализ удовлетворенности результатами лечением врачей-наблюдателей (по шкале Лайкерта для врача). Кроме того, изучалась частота возникновения, структура, выраженность, сроки появления и продолжительность нежелательных реакций, а также частота отказов от лечения в связи с приемом препарата. Вторичной конечной точкой была оценка влияния препарата на систолическое, диастолическое артериальное давление и частоту сердечных сокращений.
Материалы и методы. В неинтервенционное исследование были включены 537 мужчин с диагнозом ДГПЖ, соответствующих критериям включения: факт назначения препарата Алфупрост® МР для лечения СНМП при ДГПЖ (в соответствии с действующей инструкцией по применению препарата Алфупрост® МР); расстройство мочеиспускания умеренной степени выраженности (8–19 баллов по IPSS); возраст мужчин 50–65 лет; объем ПЖ (по данным УЗИ) 30–80 см3, стадия компенсации; Qmax 6–13 мл/с; сексуальная активность в любом ее проявлении; уровень ПСА <4 нг/мл; добровольное изъявление согласия на участие в исследовании (информированное согласие пациента, собственноручно подписанное).
Наличие эректильной дисфункции (ЭД), соответствующей от 12 до 16 баллов (промежуточная степень между легкой и среднетяжелой ЭД) по шкале МИЭФ не cлужило противопоказанием к включению (на усмотрение исследователя).
В исследование включались только пациенты, которым уже был назначен препарат Алфупрост® МР, таблетки с пролонгированным высвобождением алфузозина, 10 мг 1 раз в сутки после еды. Длительность периода наблюдения составила 3 мес. Все включенные в исследование пациенты (100%) подписали форму информированного согласия.
Исследование проводилось урологами в 21-м амбулаторно-поликлиническом лечебно-профилактическом учреждении (ЛПУ) Российской Федерации. Наблюдение включило три визита: исходный визит включения в программу (визит 0), визит 1 – через 30 (±5) дней после включения в программу и визит 2 – через 90 (±5) дней после включения в программу (60 [±5] дней после визита 1).
На каждом визите фиксировали жалобы, проводился физикальный осмотр (наружные половые органы, пальцевое ректальное исследование [ПРИ]). Использовали опросники: IPSS и QoL; полная версия опросника МИЭФ; опросник удовлетворенности пациентом проведенным лечением (шкала Лайкерта для пациента) и опросник удовлетворенности врача проведенным лечением (шкала Лайкерта для врача). Также фиксировали данные используемых в рутинной клинической практике лабораторных и инструментальных исследований: ПСА крови общий; УЗИ мочевого пузыря (объем остаточной мочи, мл); урофлоуметрия (Qmax); трансабдоминальное УЗИ (ТРУЗИ) простаты (объем, см3), измерение систолического и диастолического артериального давления; измерение частоты сердечных сокращений (ЧСС).
Для обработки полученных результатов применены методы описательной статистики. Количественные данные, имевшие нормальное распределение, описывали с использованием среднего арифметического (М) и стандартного отклонения (SD), представленных в формате М (SD). При распределении признаков, отличающемся от нормального, описывали в виде медианы (Me) и квартилей Q1 и Q3в формате Me (Q1;Q3). Качественные показатели представлены как в абсолютных, так и в относительных величинах (%). Проверку выборок на нормальность осуществляли при помощи теста Колмогорова–Смирнова. Сравнение выборок производили с применением t-критериев Стьюдента, U-критерия Манна-Уитни и Т-критерия Уилкоксона. Взаимосвязь параметров выявляли с помощью методов корреляционного анализа Пирсона и Спирмена. Анализ различия частот признаков в независимых группах производили с использованием критериев Мак-Немара и Хи-квадрат. Также для ряда факторов применяли расчет показателей относительного риска по Mantel-Haensel (ОР или RR). Отношение шансов (OR) и доверительного интервала (CI) производили путем сопоставления частоты бинарного признака в группах с помощью четырехпольных таблиц. Математическую и статистическую обработку полученных данных проводили с использованием стандартных пакетов программ Statistica (V7.0) и SPSS Statistics (V17.0).
Результаты. Средний возраст вошедших в исследование мужчин составил 58,7 (±4,29) года, что, согласно классификации Всемирной организации здравоохранения (ВОЗ) от 2021 г., соответствует средней возрастной группе.
У 358 (66,67%) включенных в исследование мужчин уровень ПСА составил <2,5 и у 179 (33,33%) – 2,5–4,0 нг/мл. Исходный средний объем простаты (визит «0»), по данным ТРУЗИ, составил 53,0 (±12,9) см3 (от 28 до 88 см3).
Средний показатель индекса массы тела (ИМТ) включенных в исследование пациентов составил 27,6±3,7 кг/м2, что, согласно классификации ВОЗ (2021), соответствует избыточной массе тела.
У 32,40% пациентов присутствовали сопутствующие заболевания (табл. 1), в структуре которых достоверно (p<0,05) чаще отмечены гипертоническая болезнь, хронический гастродуоденит, хроническая обструктивная болезнь легких.

Среди жалоб пациентов на «0» визите преобладали симптомы затруднения мочеиспускания у 429 (79,89%) пациентов, поллакиурия – у 537 (100%), ноктурия – у 376 (70,02%) и ургентные позывы у 131 (24,39%) пациента; 12 мужчин (2,23%) отмечали наличие эпизодов недержания мочи (рис. 1). Болевые ощущения в надлобковой области и при мочеиспускании, характерные для воспалительных процессов ПЖ, были на «0» визите у 79 (14,6%) пациентов. Таким образом, те или иные симптомы нарушенного мочеиспускания к началу терапии, среди которых преобладали поллакиурия, ноктурия и затрудненное мочеиспускание, присутствовали у всех (100%) включенных в исследование пациентов. На визите 1 (рис. 2) у 11,73% пациентов число жалоб на СНМП достоверно (p<0,05) уменьшилось на 39,32% от общего количества жалоб. Так, на визите 1 симптомы затруднения мочеиспускания уже отмечались только в 269 (56,75%) наблюдениях, поллакиурия – у 361 (76,16%), ноктурия – у 251 (52,95%) и ургентные позывы – у 45 (9,49%), а 4 (0,84%) пациента отмечали эпизоды недержания мочи. Болевые ощущения в надлобковой области и при мочеиспускании, характерные для воспалительных процессов ПЖ, были у 19 (4,01%) пациентов на визите 1.
Позитивная динамика снижения числа жалоб продолжилась ко 2-му визиту, на котором их количество по сравнению с 0-м визитом уменьшилось уже на 69,82%. В том числе жалобы на поллакиурию сократились на 45%, на ноктурию на 23,5%, на затрудненное мочеиспускание на 44,8%, на ургентные позывы на 20,5% и на болевой синдром на 13,7%.
Средний суммарный показатель IPSS (рис. 2) на 0-м визите составил 14,9 (±3,2) балла (колебания от 8 до 19), что соответствует умеренным нарушениям, на визите 1 этот показатель уменьшился до 10,3 (±3,4) (колебания от 1 до 19) и далее продолжил тенденцию к снижению на визите 2 до 6,7 (± 3,1) балла (колебания от 0 до 15), что соответствует незначительным нарушениям. Суммарно за 3 мес. терапии средний показатель IPSS достоверно (p<0,05) уменьшился на 55,04%.
Средний показатель индекса качества жизни QoL (рис. 3) на 0-м визите составил 4,06 (±0,95) балла (диапазон – 1–6 баллов), что соответствует показателю «неудовлетворительно», на визите 1 составил 2,58 (±0,92) (0–6), что соответствует показателю между «удовлетворительно» и «смешанное чувство», а на визите 2 составил 1,06 (±0,92) балла (0–6), что соответствует показателю «хорошо». Суммарно достоверное (p<0,05) улучшение качества жизни пациентов к концу наблюдения улучшилось в 2,5 раза.
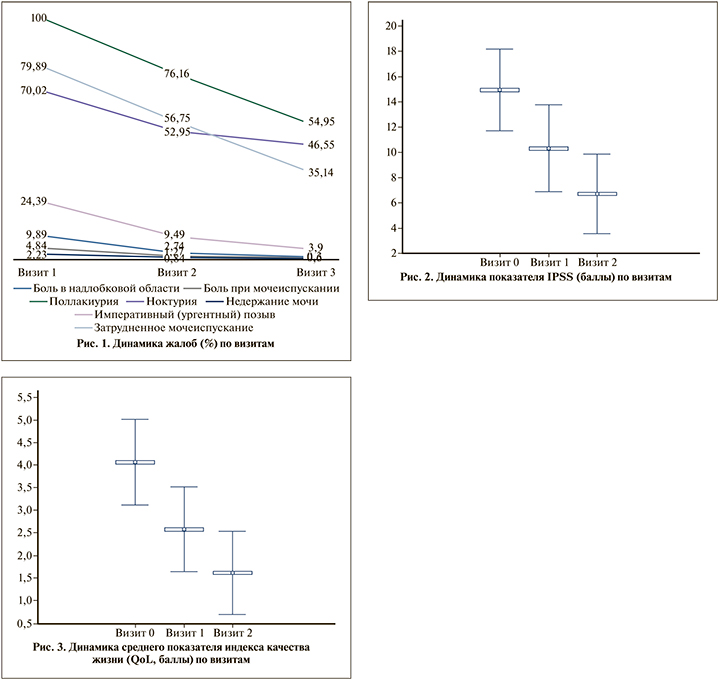
На протяжении 3 мес. терапии отмечалась достоверная (p<0,05) положительная динамика максимальной скорости потока мочи (Qmax) (рис. 4): на визите 0 она составила в среднем 10,1(±1,9) мл/с (4–17), на визите 1 – уже 13,2 (±3,0) мл/с и далее увеличилась до 15,5 (±3,7) мл/с на визите 2. Суммарно средний показатель Qmax после 3 мес. терапии увеличился на 5,35 мл/с (на 52,7%).
Отмечено достоверное (p<0,05) увеличение объема мочеиспускания (VV) в динамике по визитам: от 209 (±83,6) мл (диапазон – 197–660 мл) на 0-м визите до 222 (±73), на визите 1 до 236,3 (±74,0) мл; диапазон – 230–570 мл на 2-м визите. Суммарно средний показатель VV после 3 мес. терапии увеличился на 12,9%.
На протяжении 3 мес. терапии отмечалась достоверно положительная динамика в уменьшении среднего показателя объема остаточной мочи (ООМ): на визите 0 ООМ в среднем составил 48,4 мл (±32,5), диапазон – 0–240,0 мл; показатель значительно уменьшился на визите 1 до 28,3 мл (±22,2) и на визите 2 показатель ООМ составил в среднем 15,3 мл (±15,1), диапазон от 0 до 90 мл. Суммарно ООМ через 3 мес. терапии достоверно уменьшился на 23,05 мл (в 3 раза).
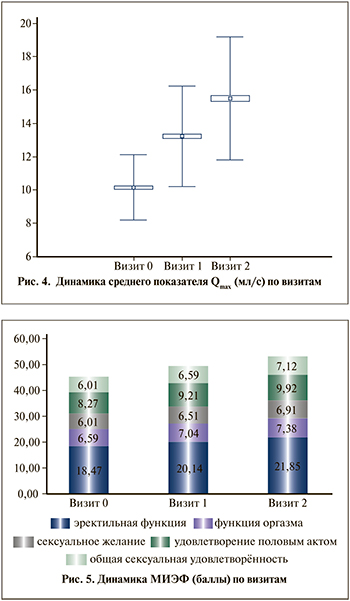
В целом достоверно (p<0,05) отмечена положительная динамика основных показателей половой функции мужчин в наблюдательном исследовании. Средний балл тяжести эректильной дисфункции (ЭД) у наблюдаемых пациентов на визите 0 составил 18,47 (±7.0) балла (от 1 до 30), что указывает на умеренную степень выраженности ЭД. На визите 1 отмечено достоверное (p<0,05) улучшение эрекции на 2 балла (20,14 [±6,58]) и на визите 2 улучшение до 21,8 (±6,6) балла, что соответствует легкой степени ЭД и улучшению показателя на 18,29%. Достоверно (p<0,05) улучшалась функция оргазма с 6,59 (±2,7) балла на визите 0 до 7,04 (±2,51) на визите 1 и до 7,38 (±2,4) балла на визите 2, при этом общее улучшение функции оргазма составило 11,98%. Сексуальное желание в ходе терапии также улучшалось: с 6,01(±2,0) на визите 0 до 6,51 (±1,98) на визите 1 и до 6,9 (±1,9) балла на визите 2, при этом общее улучшение сексуального желания составило 15,14%. Лечение привело и к улучшению показателя удовлетворения половым актом: с 8,27 (±3,3) на визите 0 до 9,21 (±3,29) на визите 1 и до 9,9 (±3,3) балла на визите 2; суммарно улучшение показателя удовлетворения половым актом составило 19,7%. Общая сексуальная удовлетворенность увеличилась с 6,01 (±2,37) балла на визите 0 до 6,59 (±2,23) на визите 1 и до 7,12 (±2,2) балла на визите 2; суммарно улучшение показателя общей сексуальной удовлетворенности составило 18,46%. Средний суммарный показатель по шкале МИЭФ достоверно (p<0,05) вырос с 45,35 до 53,18 баллов (рис. 5).
На визите 1 пациенты отметили удовлетворенность проведенным лечением, средний балл по шкале Лайкерта составил 3,8 (±0,64), диапазон от 2 до 5 баллов. На визите 2 пациенты также отметили достоверное увеличение показателя среднего балла удовлетворенности проведенным лечением, средний балл вырос до 4,3 (±0.56), диапазон от 2 до 5 баллов.
На визите 1 врачи также отметили удовлетворенность проведенным лечением, средний балл по шкале Лайкерта составил 4,05 (±0,64), диапазон от 2 до 5 баллов. Достоверное увеличение показателя среднего балла удовлетворенности врачом проведенным лечением продолжилось, и к визиту 2 его средний балл вырос до 4,41 (±0.6), диапазон от 2 до 5 баллов.
Вторичной конечной точкой было изучение возможного влияния проводимой терапии препаратом Алфупрост® МР на гемодинамические показатели в течение всего периода наблюдения. Гемодинамические показатели на протяжении 3 мес. наблюдения оставались стабильными: отмечалось клинически незначимое достоверное снижение систолического артериального давления (САД) не более чем на 2 мм рт.ст.: на визите 0 показатель САД составил в среднем 131(±9,6) мм рт.ст. (от 130 до 175 мм рт.ст.), на визите 1 составил 127,9+ (±8,4) (130–160 мм рт.ст.) и на 2-м визите – 130 (±7,9) мм рт.ст. (130–170 мм рт. ст.).
В то же время не было отмечено влияния терапии на показатель диастолического артериального давления (ДАД): на визите 0 показатель составил в среднем 85 (±7,3) (80–110м рт.ст.); на визите 1 – 81,76+ (±25.44) (130–160) и на 2-м визите – 81,9 (±33) мм рт.ст. (80–110 мм рт.ст.).
На протяжении 3 мес. лечения наблюдалось клинически незначимое, но достоверное урежение частоты сердечных сокращений (ЧСС) – не более чем на 1 удар в минуту. Средние показатели на визите 0 составили 76,1 (±6,9) удара в минуту (от 57 до 98 уд. в мин), на визите 1 составили 75 (±5) (54–104 уд. в мин) и на визите 2 – 75,2 (±5,9) (62–104 уд. в мин).
Нежелательные реакции (НР) за весь период наблюдения отмечались только у 7 (1,3%) из 537 пациентов (табл. 2); на визите 1 4 НР у 4 (0,7%) пациентов; на визите 2 у 4, при этом в 4 анкетах 5 НР. Ретроградная эякуляция на протяжении всего периода наблюдения отмечена только у 1 (0,19%) пациента. Артериальная гипотензия зафиксирована у 2 (0,37%) пациентов на визите 1. Головокружение зафиксировано у 1 (0,19%) мужчины на визите 1 и у 3 (0,56%) на визите 2.

Слабость на визите 2 отмечена у 1 (0,19%) мужчины.
Обсуждение. Научные достижения в изучении патогенеза ДГПЖ позволили фармацевтической индустрии разработать для эффективной симптоматической терапии нарушений мочеиспускания у больных ДГПЖ такие лекарства, которые остаются первой линией назначений как в режимах монотерапии, так и в комбинированной терапии. Эффективность α1-АБ в отношении ирритативных и обструктивных симптомов при любых размерах простаты подтверждена многочисленными плацебо-контролируемыми исследованиями. Однако косвенные и ограниченные прямые сравнения продемонстрировали, что при применении в соответствующих дозах все α1-АБ имеют схожую эффективность. В контролируемых исследованиях показано, что введение α1-АБ обычно сопровождается снижением IPSS от 25 до 40 % и повышением Qmax примерно на 20–25% [14].
Полученные результаты данного проспективного неинтервенционного исследования продемонстрировали высокую эффективность проведенной терапии: за 3 мес. лечения зафиксировано уменьшение среднего балла по шкале IPSS на 55%, увеличение Qmax на 53% и уменьшение среднего ООМ до нормальных значений, что позволило улучшить качество жизни пациентов, согласно результатам заполнения опросника QoL, в среднем на 2,46 балла. Таким образом, полученные в реальной клинической практике данные по применению препарата Алфупрост® МР в дозировке 10 мг однократно в сутки свидетельствуют о более высоких показателях эффективности монотерапии Алфупрост® МР в купировании СНМП при ДГПЖ, чем данные, до сих пор имевшиеся в научной литературе.
Проявления сексуальной дисфункции (СД) – распространенная проблема среди пациентов, принимающих α1-АБ. Эффективно купируя СНМП, применение α1-АБ может сопровождаться рядом побочных эффектов, включая нарушения в сексуальной сфере. Тем временем международные исследования показали, что многие больные СНМП вследствие ДГПЖ считают для себя важным сохранение половой активности [15]. В длительном (2-летнем) открытом проспективном исследовании эффективности и безопасности применения алфузозина (10 мг 1 раз в день) продемонстрировано клинически значимое улучшение параметров Краткого перечня мужской сексуальной функции (BSFI), таких как эрекция, эякуляция и удовлетворение сексуальной жизни по сравнению с исходным уровнем [16]. Эти улучшения более выражены у мужчин с тяжелыми СНМП на момент включения в исследование. По данным другого исследования, Sol Yoon (2014), применение алфузозина (10 мг в день) в течение 2 лет продемонстрировало улучшение показателей шкалы MSHQ-EjD (сокращенная версия Анкеты мужского сексуального здоровья (MSHQ) [17].
По результатам настоящего проспективного неинтервенционного исследования, на фоне существенного улучшения качества мочеиспускания у пациентов положительной была и динамика сексуального здоровья мужчин. При рассмотрении составляющих мужской копулятивной функции также отмечена достоверная (p<0,05) положительная динамика всех показателей: общее улучшение функции оргазма составило 11,98%; улучшение сексуального желания – 15,14%; улучшение показателя удовлетворения половым актом – 19,7%; улучшение показателя общей сексуальной удовлетворенности – 18,46%.
Наиболее частые вазодилятирующие побочныеэффекты при применении α1-АБ – астения, головокружение и гипотензия (ортостатическая). Несмотря на то что алфузозин, доксазозин и теразозин схожи с точки зрения молекулярной структуры, вазодилатирующие факторы наиболее выражены при применении доксазозина и теразозина и гораздо реже встречаются при применении алфузозина. В многоцентровом открытом обсервационном исследовании (Sánchez-Chapado et al., 2000) [18], куда вошли 3095 пациентов испанских клиник с СНМП при ДГПЖ, проведена оценка безопасности и эффективности 60-дневной терапии алфузозином с пролонгированным высвобождением (10 мг в сутки) в реальной клинической практике. Терапия алфузозином продемонстрировала минимальное влияние на АД: оно снижалось в среднем на 5–6 мм рт.ст. (4%) во время лечения алфузозином; различия САД и ДАД не изменялись на протяжении всего периода наблюдения; бессимптомная постуральная гипотензия (снижение САД минимум на 20 мм рт.ст. и/или ДАД) зарегистрирована менее чем у 1% (у 28 пациентов); средняя ЧСС была в пределах нормы на протяжении всего исследования.
Согласно полученным результатам настоящего исследования, гемодинамические показатели на протяжении 3 мес. наблюдения оставались стабильными: отмечено клинически незначимое достоверное (p<0,05) снижение САД не более чем на 2 мм рт.ст. в течение всего периода наблюдения. В то же время не отмечено влияния терапии на показатели ДАД (p<0,05). Изменения ЧСС на протяжении 3 мес. терапии Алфупрост® МР были также достоверными (p<0,05), клинически незначимыми и в среднем составили не более 1 удара в минуту.
Заключение. На основании проведенного проспективного обсервационного исследования подтверждены высокая эффективность и благоприятный профиль безопасности применения препарата Алфупрост® МР 10 мг/сут. для пациентов с функциональными СНМП, обусловленными ДГПЖ, а также позитивное влияние проводимой в течение 3 мес. терапии на сексуальную функцию пациентов.
Результаты неинтервенционного исследования позволяют рекомендовать Алфупрост® МР как препарат первой линии терапии СНМП при ДГПЖ, в том числе для сексуально активных мужчин и пациентов, которые уже жалуются на ухудшение эякуляции.
Минимальные и клинически незначимые вазодилатирующие эффекты при применении Алфупрост® МР делают возможным рекомендовать препарат в том числе коморбидным пациентам.



