Введение. Мочевой пузырь – это полый мышечный орган, служащий для накопления поступающей по мочеточникам мочи и выделения ее по мочеиспускательному каналу.
К сожалению, в определенных случаях (рак, травма, туберкулез, нейрогенные расстройства, ятрогенные повреждения, аномалии развития, последствия лучевой терапии и т.д.) возникает необходимость в хирургическом вмешательстве с полным или частичным удалением мочевого пузыря с последующим формированием нового пути отвода мочи. Основной задачей реконструктивной операции является воссоздание мочевого резервуара низкого давления и обеспечение беспрепятственного оттока мочи от почек до неопузыря и далее по мочеиспускательному каналу, что значительно повышает качество жизни пациента [1, 2].
 Существует много различных способов реконструкции мочевого пузыря, каждый из которых обладает своими преимуществами и недостатками. Это и методики отведения мочи без формирования механизма удержания: цистостомия, уретерокутанеостомия, уретеросигмостомия, уретероилеостомия – операция Бриккера и т.д. Для формирования резервуаров чаще всего используются различные отделы желудочно-кишечного тракта – желудок, тонкая кишка, илеоцекальный отдел, толстая и прямая кишка. Широко известны способы замещения мочевого пузыря с использованием подвздошно-кишечного сегмента: методика Камея, при которой мочевой пузырь формируется из детубуляризованного U-образного сегмента; методика Хаутмана, при которой мочевой пузырь формируется из W-образного сегмента; методика Монти с использованием механического шва; методика Кокка с формированием полурезервуара мочевого пузыря; методика Зингга с формированием мочевого пузыря из S-образного сегмента; методика Штудера с формированием мочевого пузыря из поперечно сложенного подвздошно-кишечного сегмента. Для формирования мочевого пузыря также было предложено использовать илеоцекальный сегмент – методики Майнца и Лайта для мужчин и женщин соответственно. Использование ободочно-кишечного сегмента реализовано в методиках Голдвассера – замещение пузыря сегментом правой половины ободочной кишки, Редди – замещение сегментом левой половины ободочной кишки, Олссона – замещение сигмовидной кишкой с применением механического шва. Сегмент желудка применяется в методике, предложенной Митчеллом (замещение сегментом желудка) [3–11].
Существует много различных способов реконструкции мочевого пузыря, каждый из которых обладает своими преимуществами и недостатками. Это и методики отведения мочи без формирования механизма удержания: цистостомия, уретерокутанеостомия, уретеросигмостомия, уретероилеостомия – операция Бриккера и т.д. Для формирования резервуаров чаще всего используются различные отделы желудочно-кишечного тракта – желудок, тонкая кишка, илеоцекальный отдел, толстая и прямая кишка. Широко известны способы замещения мочевого пузыря с использованием подвздошно-кишечного сегмента: методика Камея, при которой мочевой пузырь формируется из детубуляризованного U-образного сегмента; методика Хаутмана, при которой мочевой пузырь формируется из W-образного сегмента; методика Монти с использованием механического шва; методика Кокка с формированием полурезервуара мочевого пузыря; методика Зингга с формированием мочевого пузыря из S-образного сегмента; методика Штудера с формированием мочевого пузыря из поперечно сложенного подвздошно-кишечного сегмента. Для формирования мочевого пузыря также было предложено использовать илеоцекальный сегмент – методики Майнца и Лайта для мужчин и женщин соответственно. Использование ободочно-кишечного сегмента реализовано в методиках Голдвассера – замещение пузыря сегментом правой половины ободочной кишки, Редди – замещение сегментом левой половины ободочной кишки, Олссона – замещение сигмовидной кишкой с применением механического шва. Сегмент желудка применяется в методике, предложенной Митчеллом (замещение сегментом желудка) [3–11].
Анализ результатов использования данных методик позволяет заключить, что большинство осложнений у пациентов, перенесших радикальную цистэктомию с последующим созданием механизма деривации мочи, обусловлено нарушением целостности желудочно-кишечного тракта – перитонит, непроходимость кишечника, несостоятельность анастомозов, стриктуры, образование камней в искусственном пузыре, недержание мочи, рефлюкс в верхние отделы мочевыводящих путей, рубцовые изменения соустьев трансплантата с уретрой и мочеточниками, мочевые свищи, дневное и ночное недержание мочи [12]. Также остается открытым вопрос произвольного опорожнения созданного мочевого пузыря, так как во всех методиках с использованием кишечника у вновь создаваемого мочевого пузыря отсутствует функция детрузора. Это в свою очередь обосновывает изучение и внедрение в практику альтернативных методик формирования мочевого пузыря. Экспериментальное изучение различных пластических материалов для замещения мочевого пузыря показало недостаточную их эффективность. Мышечно-апоневротический лоскут передней брюшной стенки подвергался атрофии, сальник на ножке замещался соединительной тканью, гомотрансплантат желчного пузыря склерозировался, гомотрансплантат мочевого пузыря и твердой мозговой оболочки сморщивался [13].
Р. Т. Адамян и соавт. предложили использовать для формирования резервуара мочевого пузыря торакодорсальный микрохирургический аутотрансплантат и провели экспериментально-анатомическое исследование, в котором было доказано, что созданный из торакодорсального аутотрансплантата артифициальный мочевой пузырь обладает хорошей прочностью (максимальное внутрирезервуарное давление до 86 см водн. ст.) и приемлемой емкостью (до 300 мл), что немаловажно для искусственного резервуара [14, 15].
Данную методику мы реализовали в своей практике на базе кафедры пластической хирургии, отделения реконструктивной и пластической хирургии УКБ № 1, совместно с НИИ уронефрологии и УКБ № 2 ФГАОУ ВО «Первый МГМУ им. И. М. Сеченова» Минздрава России. Представляем собственное клиническое наблюдение.
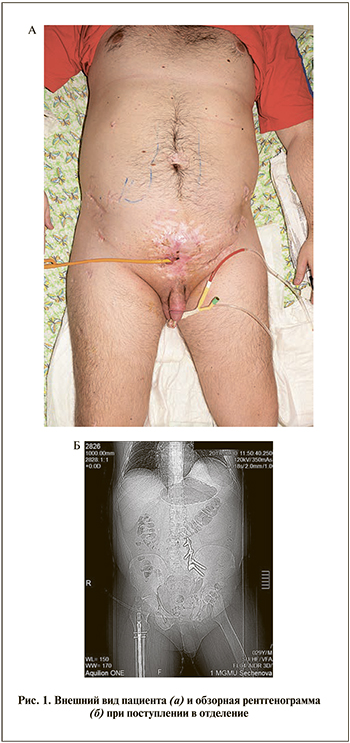
П а ц и е н т А. 29 лет находился в отделении реконструктивной и пластической хирургии УКБ № 1 с диагнозом: последствия травм, захватывающих несколько областей тела: сочетанная травма костей таза и грудной клетки. Цистостома. Микроцистис. Поступил с жалобами на невозможность самостоятельного мочеиспускания, наличие эпицистостомы, ограничение двигательной активности, обусловленной переломом костей таза.
Анамнез заболевания. Пациент пострадал в дорожно-транспортном происшествии и был госпитализирован в одну из городских клинических больниц. По данным рентгенографии были выявлены переломы VI, VII и VIII ребер слева со смещением отломков, закрытый перелом седалищной и лонной костей с двух сторон с разрывом лонного и левого крестцово-подвздошного сочленения с нарушением целостности тазового кольца. По экстренным показаниям выполнены диагностическая лапароскопия, дренирование брюшной полости, фиксация переломов таза и правого бедра стержневыми аппаратами. Кроме этого выявлена гематома мошонки, с учетом нежизнеспособности левого яичка выполнена орхфуникулэктомия. В связи с гнойным уретритом выполнена цистостомия. Учитывая несостоятельность стержневых аппаратов, выполнены демонтаж и повторная фиксация переднего полукольца таза и правого бедра стержневыми аппаратами, хирургическая обработка раны правого бедра, ревизия ран параректальной области. По данным мультиспиральной компьютерной томографии с контрастированием определены пневмомедиастинум, инфильтративно-воспалительные изменения в заднебазальных сегментах обоих легких на фоне гиповентиляции, двусторонний гидроторакс, небольшое количество свободной жидкости под диафрагмой, параколон с обеих сторон, гепатоспленомегалия, застойный желчный пузырь, жидкостные скопления в паравезикальной клетчатке слева, инфильтративные изменения мягких тканей промежности и наружных половых органов. При ультразвуковом исследоваии брюшной полости отмечена отрицательная динамика холецистита, по поводу чего была выполнена чрескожная чреспеченочная микрохолецистостомия. В дальнейшем по данным мультиспиральной компьютерной томографии органов брюшной полости и малого таза отмечено формирование наружного свища, дефект передней брюшной стенки, сообщающийся с мочевым пузырем. Пациенту были выполнены стентирование обеих почек, пластика дефекта мочевого пузыря и передней брюшной стенки. Течение послеоперационного периода осложнилось развитием неокклюзивного тромбоза малой подкожной вены, окклюзивного тромбоза суральных вен медиальной группы, неокклюзивного тромбоза справа поверхностной бедренной вены, задней большеберцовой вены, слева неокклюзивного (пристеночного) тромбоза общей бедренной вены, поверхностной бедренной вены в верхней трети и глубокой бедренной вены. В динамике на фоне проводимого консервативного лечения достигнута реканализация.
С целью профилактики гипостатических осложнений, учитывая сохраняющееся смещение отломков правой бедренной кости, не устранимое ни консервативно, ни при помощи стержневого аппарата, и принимая во внимание высокий риск гнойно-септических осложнений, пациенту были выполнены демонтаж стержневого аппарата с правой бедренной кости и остеосинтез правой бедренной кости штифтом с антибактериальным покрытием. Дальнейшие реконструктивные вмешательства на костях таза не проводились до настоящего момента по причине высокого риска гнойной-септических осложнений. Пациенту была выполнена открытая репозиция костных отломков с их фиксацией на уровне позвонков S1, S2, S3 и крестцово-подвздошного сустава слева. Фораменотомия S2, S3, позвоночно-крестцово-подвздошная фиксация L4–S3 системой для илеосакральной фиксации uBase™ (Ulrich Medical, Германия). В отдаленном послеоперационном периоде у пациента сформировалась костно-мышечная деформация левой нижней конечности, сопровождавшаяся выраженным болевым синдромом, значительно ограничивавшим двигательную активность. Пациент обратился за консультативной помощью и лечением в отделение реконструктивной и пластической хирургии УКБ № 1. Было рекомендовано хирургическое лечение – реконструкция мочевого пузыря с использованием реваскуляризированного микрохирургического торакодорсального аутотрансплантата.
Предоперационное обследование и подготовка. Кожные покровы надлобковой области бледно-розовой окраски с множественными нормотрофическими рубцами и зоной формирующейся рубцовой ткани вокруг выходного отверстия эпицистостомы. В области эпицистостомы определялся фрагмент блестящей слизистой мочевого пузыря бледно-розовой окраски. Перифокально – следы мочи. По мочевому катетеру – отделяемое светло-желтого цвета, прозрачное. Пальпаторно в гипогастральной области определялся мышечный диастаз в проекции мочевого пузыря с формированием грыжевого выпячивания (рис. 1). При лабораторном обследовании в общем анализе крови, в биохимическом анализе крови, общем анализе мочи, коагулограмме значимых отклонений от нормы не выявлено. Ультразвуковое исследование органов брюшной полости и малого таза: мочевой пузырь округлой формы, стенки не изменены, камней, образований не отмечается, в просвете – цистостомический катетер. Незначительное увеличение печени, диффузные изменения паренхимы печени и поджелудочной железы. Состояние после холецистэктомии. Нельзя исключить камень правой почки. Дуплексное сканирование артерий и вен нижних конечностей: картина посттромбофлебитического синдрома в системе глубоких вен правой нижней конечности, в бедренной и других сегментах проходимость глубоких и подкожных вен не нарушена. Ультразвуковая картина окклюзии наружной подвздошной артерии слева, кровоток не регистрируется. Данные УЗИ донорских и реципиентных сосудов: справа – a. thorocodorsalis визуализирована в проксимальном сегменте: диаметр – 2,2 мм, ЛСК (линейная скорость кровотока) – 0,2 м/с; a. epigastrica inferior визуализирована в проксимальном сегменте, диаметр – 1,3 мм, ЛСК – 0,17 м/с. Слева – a. thorocodorsalis визуализирована в проксимальном сегменте: диаметр – 1,3 мм, ЛСК – 0,27 м/с; a. epigastrica inferior не определялся. При рентгенографии грудной клетки очаговых и инфильтративных изменений не выявлено.
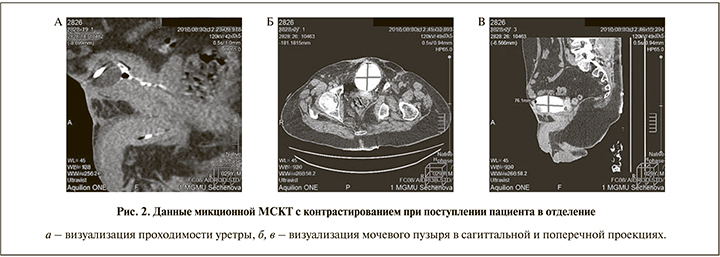
При микционной МСКТ с контрастированием определены емкость мочевого пузыря (130 мл), проходимость уретры и отсутствие стриктур (рис. 2).
Учитывая удовлетворительное общесоматическое состояние пациента, было решено провести реконструкцию мочевого пузыря с увеличением его емкости с помощью свободного реваскуляризированного микрохирургического торакодорсального аутотрансплантата. В качестве предоперационной подготовки пациенту были установлены мочеточниковые катетеры и уретральный катетер для обеспечения «сухости» мочевого пузыря в послеоперационном периоде. Чрескожную нефростомию выполнить не удалось из-за анатомических особенностей чашечно-лоханочной системы (внутрипочечные лоханки малых размеров).
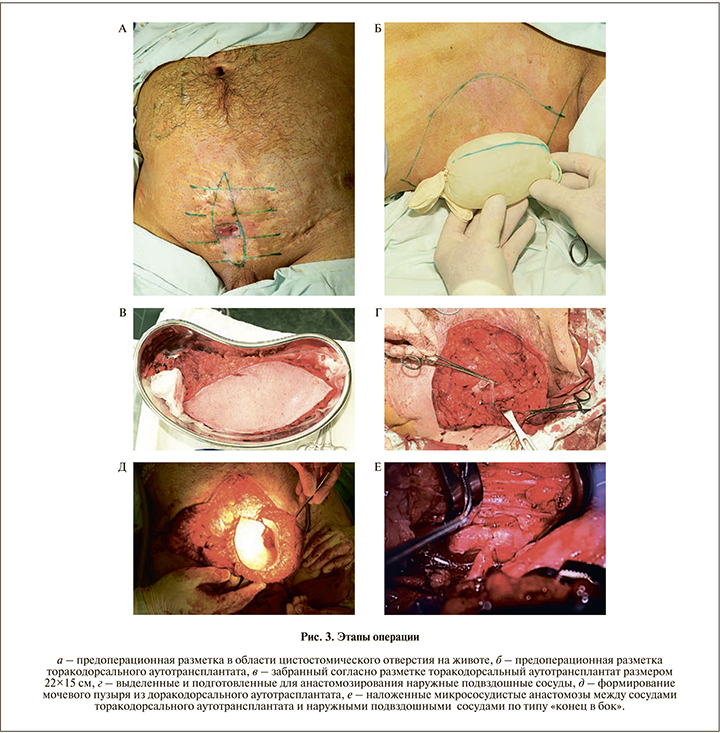
Хирургическое вмешательство. Операция начата двумя бригадами. Первой бригадой выполнена разметка на передней брюшной стенке, иссечена рубцовая ткань по средней линии ниже пупка (рис. 3, а). При ревизии передней брюшной стенки в области мезо- и гипогастрия передняя стенка мочевого пузыря располагалась непосредственно под кожей, дефект апоневроза до 20 см в ширину, дистальные отделы прямых мышц живота не визуализировались, нижние глубокие эпигастральные сосудистые пучки отсутствовали. Принято решение в качестве реципиентных сосудов использовать правые наружные подвздошные сосуды. При осуществлении к ним доступа обнаружено, что анатомический ход их нарушен в результате травмы и ранее перенесенных оперативных вмешательств (рис. 3, г). Рубцовая ткань удалена с лимфатическими узлами. Второй бригадой выполнен забор торакодорсального аутотрансплантата по стандартной методике. Площадь и размер торакодорсального лоскута (22×15 см) были определены с использованием латексной модели мочевого пузыря объемом 500 мл (рис. 3, б, в). После забора лоскута донорская зона ушита с помощью ротированного со спины кожного аутотрансплантата нитью пролен 2/0. Торакодорсальный аутотрансплантат с сосудистой ножкой перемещен на переднюю брюшную стенку. Наложены венозный и артериальный микроанастомозы с наружными подвздошными сосудами по типу «конец в бок» нитью пролен 7/0 узловыми швами (рис. 3, е). После пуска кровотока кожная часть торакодорсального аутотрансплантата приобрела бледно-розовую окраску с отчетливой капиллярной реакцией, отток по вене получен, микроанастомозы состоятельны. Произведено рассечение передней стенки мочевого пузыря в поперечном направлении, в просвете мочевого пузыря визуализированы мочеточниковый и уретральный катетеры. Из торакодорсального аутотрансплантата сформирован купол кожной частью внутрь, который по своей окружности фиксирован к краям мочевого пузыря нитью пролен 3/0 (рис. 3, д). Мышечная часть торакодорсального лоскута фиксирована по периметру к остаткам апоневроза и укрыта свободным расправленным кожным аутотрансплантатом. Свободный расщепленный кожный аутотрансплантат был забран с передней поверхности правого бедра дисковым дерматомом. Кожный трансплантат фиксирован отдельными узловыми швами нитью ПДС 5/0 к кожным краям раны передней брюшной стенки.
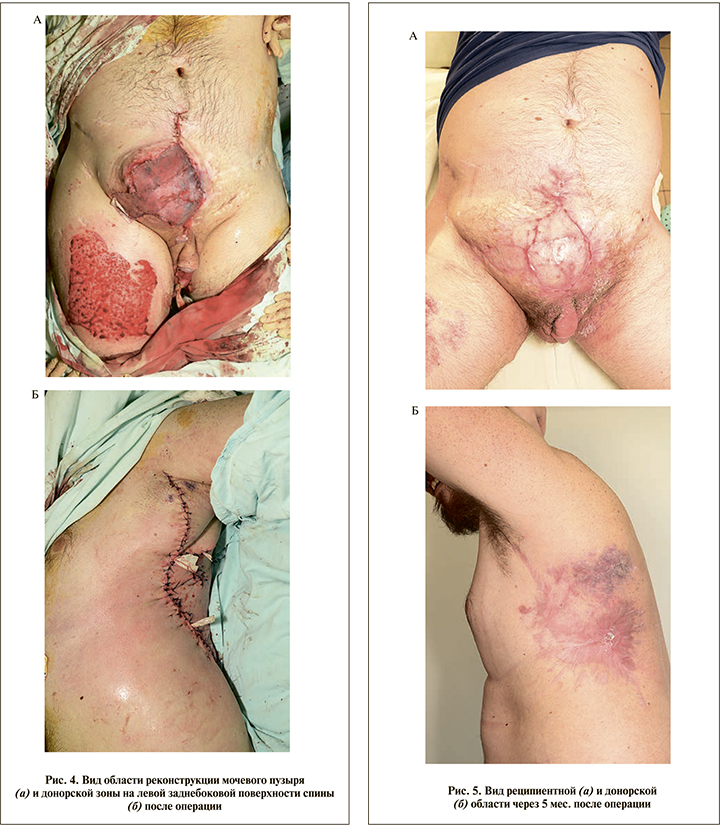
Послеоперационное ведение и результаты. В послеоперационном периоде пациенту проводили антибактериальную, противовоспалительную терапию, а также терапию, направленную на улучшение реологических свойств крови. Ежедневно осуществляли перевязки с антисептическими растворами и ранозаживляющими мазями. При выполнении контрольной УЗДГ в послеоперацоинном периоде была подтверждена состоятельность микрососудистых анастомозов торакодорсального аутотрансплантата с сохранностью кровотока. Ближайший послеоперационный период осложнился инфицированием послеоперационной раны с частичным расхождением швов и формированием нескольких мочевых свищей. Однако консервативная терапия с применением современных перевязочных материалов позволило санировать инфекционные очаги и добиться заживления ран (рис. 5).
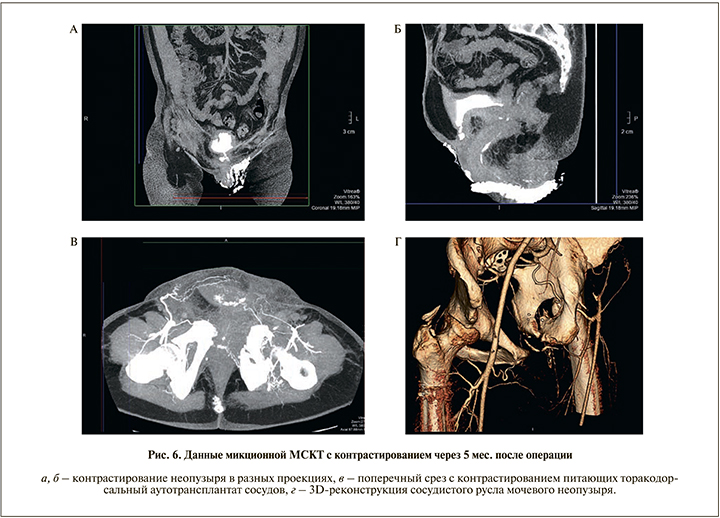
В послеоперационном периоде отмечено удовлетворительное дренирование нижних мочевых путей. При контрольной урографии выделительная функция почек была сохранена. Отток мочи осуществлен по мочеточниковым и уретральному катетеру, составив около 1500 мл/сут. Дважды производили замену мочеточниковых катетеров в связи с их плохим функционированием. Через 1,5 мес. сформированный мочевой пузырь удерживал около 250 мл мочи, самостоятельное мочеиспускание восстановлено полностью и осуществлялось как с помощью оставшейся части мочевого пузыря, так и путем напряжения передней брюшной стенки и/или надавливанием верхней конечностью в надлобковой области (рис. 6).
Обсуждение. Преимуществом использованного нами способа реконструкции мочевого пузыря служит сохранение возможности физиологического отведения мочи, что значительно повышает качество жизни пациента и социальную адаптацию. Топография подвздошных артерий и вен позволяет создавать надежный сосудистый анастомоз, что способствует хорошему приживлению перемещенного торакодорсального лоскута, используемого для создания артифициального мочевого пузыря.
В представленном клиническом наблюдении мы столкнулись с техническими сложностями, связанными с отсутствием нижних глубоких эпигастральных сосудистых пучков вследствие травмы и предшествовавших оперативных вмешательств. При использовании данной методики можно отказаться от применения фрагментов желудочно-кишечного тракта, что полностью исключает ряд грозных, а в некоторых случаях и летальных осложнений. Такие свойства торакодорсального аутотрансплантата, как большие размеры и пластичность, позволяют формировать мочевой резервуар объемом около 250–300 мл. При этом сохраняется возможность произвольного опорожнения, соответствующего оригинальному органу, обладающему высокой сопротивляемостью к бактериальной инфекции. Методика реконструкции мочевого пузыря с помощью свободного реваскуляризируемого и реиннервируемого торакодорсального аутотрансплантата, несомненно, полезна и перспективна. В то же время она нуждается в доработке и изучении, в частности, возможности создания произвольного детрузора за счет реиннервируемого фрагмента широчайшей мышцы спины, входящего в состав аутотрансплантата.
Заключение. В результате проведенного лечения нами была осуществлена реконструкция мочевого пузыря с использованием микрохирургического торакодорсального аутотрансплантата, которая позволила создать артифициальный мочевой пузырь с включением в него элементов собственного мочевого пузыря (задней стенки и шейки) достаточной емкости (250–300 мл) и избавить пациента от цистостомы с улучшением качества жизни.



