Преждевременная эякуляция – это нарушение сексуальной функции мужчин, характеризующееся ранним семяизвержением до либо в течение 1 мин после вагинального проникновения. При таком состоянии пациент не способен отсрочить эякуляцию, что влечет за собой ряд негативных последствий, таких как стресс, беспокойство и/или уход от сексуальных отношений [1].
Отмечается, что ПЭ – частая сексуальная жалоба и распространенная проблема, возникающая у 20–30% мужского населения в мире. Наибольшая заболеваемость выявлена в США и составляет 32% в группе пациентов от 18 до 59 лет. В Великобритании этот показатель соответствует 31%, во Франции – 16% во всех возрастных группах [2].
В 2008 г. M. Waldinger et al. [3] была предложена классификация, в которой выделено 4 основные формы ПЭ:
- первичная, возникающая при первом и последующих сексуальных контактах;
- вторичная, или приобретенная, характеризующаяся появлением ПЭ при ранее нормальной эякуляции;
- «естественно изменяющаяся ПЭ», связанная с непостоянным и нерегулярным преждевременным семяизвержением;
- «нарушение эякуляторной функции в форме преждевременной эякуляции» с субъективным восприятием постоянной или непостоянной быстрой эякуляции во время сексуального контакта, тогда как время до эякуляции находится в пределах нормы или может быть даже больше. Такое состояние не следует рассматривать как симптом или проявление какого-либо заболевания.
По данным европейских исследований, распространенность первичной формы ПЭ составила 2,3%, вторичной – 3,9%, естественно изменяющейся – 8,5% и нарушения эякуляторной функции в форме ПЭ – 5,1% [1].
Механизмы эякуляторного рефлекса
Эякуляция представляет собой сложный рефлекс, контролируемый спинальным центром эякуляции, который координирует автономные и соматические выходы, интегрирует их с сенсорными входами, связанными со стимуляцией сексуальной активности (рис. 1) [4].

В основе процесса эякуляции лежит упорядоченный каскад рефлексов супраспинальных, спинальных центров и периферической (симпатической, парасимпатической и соматической) нервной системы [5]. Афферентные стимулы, запускающие начальные звенья эякуляции, идут от головки, тела и крайней плоти полового члена в составе дорсального нерва пениса [6]. Исследования показали, что двустороннее пересечение дорсального нерва полового члена полностью прекращает эякуляцию при спаривании крыс [7]. Напротив, его стимуляция вызывает эякуляцию у млекопитающих: крыс, приматов, человека [8–10]. Дендриты афферентов оканчиваются в так называемом спинальном центре эякуляции [11].
 Спинальный центр эякуляции – самый «древний» уровень нервной регуляции полового акта, содержащий ряд интернейронов, расположенных в пояснично-крестцовом отделе спинного мозга (рис. 2) [6, 12]. Ключевым посредником в процессе эякуляции является особая популяция клеток в центральном сером веществе поясничных сегментов L3–L4, в пластинке X и медиальной части пластинки VII. Согласно их расположению и связи с таламусом, они были названы поясничными спиноталамическими клетками – LSt cells [6, 11, 13, 14]. Их прямая электрическая микростимуляция запускает каскад эякуляторного рефлекса, в то время как повреждение этих клеток не дает ему реализоваться даже при стимуляции афферентных волокон [15, 16].
Спинальный центр эякуляции – самый «древний» уровень нервной регуляции полового акта, содержащий ряд интернейронов, расположенных в пояснично-крестцовом отделе спинного мозга (рис. 2) [6, 12]. Ключевым посредником в процессе эякуляции является особая популяция клеток в центральном сером веществе поясничных сегментов L3–L4, в пластинке X и медиальной части пластинки VII. Согласно их расположению и связи с таламусом, они были названы поясничными спиноталамическими клетками – LSt cells [6, 11, 13, 14]. Их прямая электрическая микростимуляция запускает каскад эякуляторного рефлекса, в то время как повреждение этих клеток не дает ему реализоваться даже при стимуляции афферентных волокон [15, 16].
LSt cells имеют прямые аксональные интраспинальные связи с автономными симпатическими (IML и CAN) и парасимпатическими (SPN) ядрами спинного мозга, а также с половыми (пудендальными) мотонейронами в IX пластинке на уровне L5–L6 [6].
Важную роль в регуляции эякуляции играют медиаторы, опосредующие взаимодействие между симпатическими и парасимпатическими ядрами спинного мозга. В настоящее время идут исследования на уровне физиологии клетки, при том что многие посредники взаимодействия центральных структур до сих пор остаются неизвестными, однако исследования в этой области уже имеют определенную базу и активно продолжаются.
Галанин, холецистокинин, гастрин-рилизинг-пептид, энкефалин. Спинальный центр эякуляции содержит ряд нейропептидов, таких как галанин, холецистокинин (ССК), гастрин-рилизинг пептид (GRP) и энкефалин (Enk) [4, 11, 17]. С целью определения роли каждой из этих субстанций N. Kozyrev et al. провели ряд исследований по изучению их влияния на эякуляцию крыс.
В 2012 г. они изучали влияние GRP. В ходе эксперимента установлено, что введение антагониста GRP препятствует эякуляции даже при стимуляции чувствительных волокон, а инъекция самого GRP в 43–66% случаев вызывает ее даже в отсутствие сигналов от афферентов [11]. Подобное исследование с энкефалином проведено N. Kozyrev et al. в 2015 г. Аналогично вышеописанным результатам, введение агонистов энкефалина в спинной мозг вызывало стимуляцию эякуляции при активации афферентов, а антагонистов – ее торможение. При этом отмечено, что μ-рецепторы, в отличие от Δ-рецепторов, в 75% случаев способны вызывать рефлекс самостоятельно в отсутствие чувствительных стимулов [18].
Позднее, в 2016 г., в аналогичном эксперименте продемонстрировано влияние холецистокинина и галанина на спинальный центр эякуляции. Антагонисты нейромедиаторов существенно уменьшали давление в семенных пузырьках и сокращение бульбокавернозной мышцы, тем самым тормозя семяизвержение. А галанин и холецистокинин, наоборот, запускали эякуляцию, но не самопроизвольно, как GRP, а при стимуляции дорсального нерва полового члена. В отсутствие импульсов от афферентов рефлекс запускался только у отдельных особей, что может стать косвенным доказательством наличия индивидуальных различий в плотности экспрессии рецепторов галанина и ССК [19].
Галанин представляет собой нейропептид, экспрессия которого широко представлена в головном и спинном мозге млекопитающих [20, 21]. Галанин реализует свое действие через 3 основных типа рецепторов: GALR1, GALR2 и GALR3 [22]. Согласно некоторым данным, в области X-пластинки, дорсальных и вентральных рогов и латерального ядра спинного мозга GALR1 представлены гораздо шире, чем два других типа, однако мРНК GALR2 определяется и в области SPN и IML [19].
Холецистокинин продуцируется в области X-пластинки спинного мозга в аксонах LSt cells и в нейронах спинальных ганглиев, а наличие его рецепторов описано в мотонейронах передних рогов [23–25]. Активация постсинаптических ССК-рецепторов, вероятно, повышает возбудимость мотонейронов в передних рогах спинного мозга, что может быть механизмом, посредством которого ССК стимулирует сокращение бульбоспонгиозной мышцы [26].
Гастрин-рилизинг пептид в ЦНС экспрессируется как в телах LSt cells, так и в терминалях аксонов, а его рецептор обнаружен в SPN и мотонейронах передних рогов пояснично-крестцовых сегментов спинного мозга. Вопрос о наличии рецептора GRP (GRPR) в других зонах влияния LSt cells остается открытым [11, 27].
Энкефалин представляет собой опиоидный пептид, обладающий морфиноподобным эффектом [28]. Он экспрессируется в аксонах LSt cells и, как было сказано, играет важную роль в регуляции эякуляции [18]. μ- и Δ-опиоидные рецепторы энкефалина сопряжены с Gi-белками. Возможно, именно запуск каскада Gi-белков приводит к ингибированию действия тормозных интернейронов на LSt cells, что вызывает растормаживание последних [18]. Так, например, опиоиды могут вызывать анальгезию через торможение ГАМК-эргических нейронов, которые были обнаружены в области спинального центра эякуляции [29, 30].
Серотонин. Серотонин, или 5-гидрокситриптамин (5-НТ), относящийся к семейству биогенных аминов, содержится в структурах ЦНС, выделяясь преимущественно 5-HT-эргическими нейронами ядра шва и расположенной рядом ретикулярной формацией. Каудальная группа клеток посылает свои аксоны в продолговатый и спинной мозг [31, 32]. В последнем серотонин регулирует активность клеток IML и мотонейронов передних рогов [33].
Считается, что 5-HT оказывает ингибирующее влияние на эякуляцию, удлиняя латентное время и постэякуляторный интервал [34]. Ингибиторы обратного нейронального захвата серотонина усиливают эти эффекты путем повышения концентрации серотонина в синаптической щели, что применяется при лечении ПЭ [34, 35].
Влияние серотонина на процессы эякуляции опосредовано тремя основными подтипами рецепторов – 1А, 1В и 2С, каждый из которых ассоциирован с G-белками [36, 37]. При этом считается, что активация 5-HT1A-рецепторов, в отличие от двух других, уменьшает порог эякуляции, что, возможно, связано с его пресинаптическим расположением, однако точный механизм такого эффекта до конца не изучен [33, 38]. Помимо этого проэякуляторный эффект 5-HT1A рецепторов связан с действие дофамина. Так, агонист серотониновых рецепторов типа 1А, 8-OH-DPAT, стимулирует сокращения бульбоспонгиозной мышцы и этот эффект блокируется антагонистом D2-рецепторов, но, что странно, не уменьшается при назначении антагониста 5-HT1A, WAY 100635 [39].
Три типа рецепторов серотонина были найдены в пояснично-крестцовом отделе спинного мозга, а также в ампулах семенных пузырьков и в семявыносящих протоках.
В двух последних внутривенное введение 5-НТ ингибирует сокращение в ответ на стимуляцию гипогастрального нерва [40]. Однако, согласно более поздним данным 2006 г., периферическое действие серотонина главным образом стимулирующее, что подтверждается опытом, где внутривенное назначение пара-хлорамфетамина, стимулирующего выброс серотонина, запускает эякуляцию у крыс даже после пересечения спинного мозга на уровне грудных сегментов [41]. Таким образом, периферическое действие серотонина требует дальнейшего изучения, в то время как центральное, опосредуемое не до конца понятными механизмами, преимущественно тормозное.
Дофамин. Известно, что дофамин играет важную роль в нормальном сексуальном поведении мужчины, действуя на разные участки ЦНС и регулируя процессы полового влечения, возбуждения, эрекции и эякуляции [34, 42, 43].
Дофамин осуществляет свое действие преимущественно через D2- и D3-рецепторы. Так, системное введение апоморфина, агониста дофаминовых рецепторов, стимулирует возникновение потенциалов действия в нервах, идущих от семявыносящих протоков, однако такой эффект полностью прекращается при пересечении спинного мозга, что говорит о наличии исключительного центрального механизма действия дофамина. Подобные результаты повторяются и при инъекции другого агониста D2- и D3-рецепторов, пирибедила, тогда как назначение антагонистов, наоборот, снижает активность периферических нервов [44].
Еще одним доказательством в пользу стимулирующего действия дофамина служат результаты исследования [45], согласно которым введение в участок MPOA селективного агониста D3-рецепторов, 7-OH-DPAT, вызывает дозозависимое увеличение сократительной способности бульбоспонгиозной мышцы.
Лечение ПЭ
В основе патогенеза ПЭ лежит патологическая импульсация в спинальный центр эякуляции из разных уровней регуляции – соматосенсорного, спинального, супраспинального и коры головного мозга, что может быть связано с нарушением работы вышеописанных нейромедиаторных систем [46]. Предотвратить патологическую импульсацию, «прервать сигнал», в настоящее время удается несколькими методами: от консервативных до хирургических [47, 48].
Медикаментозное лечение. На сегодняшний день первой линией терапии ПЭ остаются фармакологические средства. В Европейских рекомендациях в качестве «золотого» стандарта лечения рекомендуют применять препараты, относящиеся к фармакотерапевтической группе трициклических антидепрессантов, а именно селективных ингибиторов обратного захвата серотонина (СИОЗС) [1]. Их действие основано на повышении концентрации 5-НТ в структурах ЦНС, что в дальнейшем приводит к торможению процесса эякуляции. Селективные ингибиторы обратного захвата серотонина – препараты, имеющие на сегодняшний день наибольшую доказательную базу и достоверно увеличивающие интравагинальное латентное время эякуляции (IELT) в 3–4 раза по сравнению с исходным значением [49].
Несмотря на широкое использование медикаментозной терапии, она имеет ряд недостатков. Во-первых, наличие побочных эффектов, таких как повышение тревоги и нервозности, бессонница, тошнота, рвота, головная боль, насморк, расстройства аппетита [50]. Во-вторых, после отмены препарата в большинстве случаев наблюдается рецидив ПЭ, что заставляет пациента продлевать терапию, тем самым усиливая вышеописанные побочные эффекты [51]. В связи с этим приобретают актуальность хирургические и немедикаментозные методы коррекции, среди которых есть и различные технологии рефлексо- и реабилитационной терапии.
Поведенческая терапия. В психотерапевтической практике наиболее популярным способом лечения ПЭ является психосексуальная, или поведенческая, терапия, а именно методы «стоп–старт» и «сжатие» [52]. Метод «стоп–старт» заключается в концентрации мужчины на собственных ощущениях с остановкой стимуляции полового члена при приближении оргазма. При ослаблении позыва к эякуляции половой акт или мануальная стимуляция продолжаются [53]. Второй метод основан на сжатии полового члена для ослабления эрекции при появлении предвестников эякуляции. Оба метода обычно используются в цикле трех пауз до наступления оргазма [54].
Хирургическое лечение. Современная хирургическая методика лечения ПЭ основана на замедлении проведения импульса по соматическим нервным волокнам от чувствительных рецепторов головки полового члена. История хирургических вмешательств началась с операции циркумцизио. Тем не менее она не закрепилась в практике урологов, так как имела невысокую эффективность [55].
В настоящее время для лечения ПЭ с успехом применяется микрохирургическая денервация головки полового члена. Техника операции заключается в выделении ветвей дорсального нерва полового члена с их последующим пересечением. Данный метод зарекомендовал себя как исключительно эффективный и безопасный, обеспечивающий улучшение качества интимной жизни мужчин в 90% наблюдений [56, 57].
Еще одной методикой, способствующей увеличению продолжительности полового акта, является аугментация головки полового члена препаратами на основе гиалуроновой кислоты, которые вводят под кожу его гландулярной части проксимальнее венечной борозды. В 2003 г. была доказана безопасность подкожного введения гиалуроновой кислоты, отсутствие местных и системных побочных эффектов в течение 6 мес. наблюдения [58]. Следующим шагом стали работы J. J. Kim et al. [51, 59], показавшие, что аугментация головки полового члена гиалуроновой кислотой у пациентов с преждевременным семяизвержением значительно увеличивает латентное время эякуляции. Данная процедура, согласно опросу, улучшает качество полового акта, по мнению как мужчин, так и их партнеров, что, вероятно, может быть также связано с увеличением размеров головки за счет аугментации.
Введение ботулотокстина. Одним из многообещающих методов лечения ПЭ является введение в бульбоспонгиозную мышцу ботулотоксина типа А – селективного блокатора выделения ацетилхолина [60]. В отсутствие ацетилхолина в синаптической щели не происходит сокращения мышцы, за счет чего увеличивается продолжительность полового акта [61]. Эффективность данного метода продемонстрирована в исследовании E. Serefoglu et al. [62], проведенном в 2014 г. Было показано, что внутримышечная инъекция ботулотоксина ингибирует ритмичные сокращения бульбоспонгиозной мышцы у крыс, в то время как введение солевого раствора в контрольной группе никак не влияет на этот процесс и, соответственно, не изменяет латентное время эякуляции.
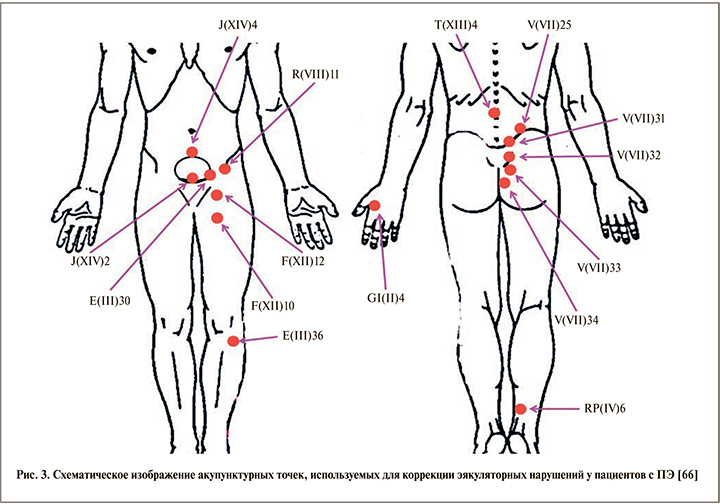
Иглорефлексотерапия. В последние годы основная масса научно-практических исследований по проблеме ПЭ посвящена оценке аппаратных технологий рефлексотерапии [63]. В связи с этим определенный вклад в развитие представлений о лечении заболевания вносит нейрофизиология. С учетом опыта нейроурологов применение методик, связанных со стимуляцией проекционных зон сосудисто-нервных пучков, может дать положительные результаты. Одной из таких методик является иглорефлексотерапия. Стимулируемые при этом зоны называются точками акупунктуры [64, 65]. Исходя из основных положений рефлексологии, при действии внешнего стимула на эти зоны формируется рефлекторный ответ, возникающий из ряда последовательных реакций – местной, сегментарной и общей (системной) [66, 67]. С попаданием сигнала в головной мозг начинается этап системной реакции, включающей основные нейрогуморальные механизмы адаптации и гомеостаза, что влияет на содержание в крови адреналина, норадреналина, серотонина, ацетилхолина, гистамина и других гормонов [66].
Для оценки эффективности коррекции ПЭ с использованием иглорефлексотерапии проведен ряд плацебо-контролируемых исследований, согласно данным которых акупунктурное воздействие может увеличивать латентное время эякуляции [63, 68–70]. В одном из таких исследований 90 пациентов с ПЭ были разделены на 3 группы по 30 человек. Первая группа ежедневно получала пароксетин в дозе 20 мг в течение 4 нед. Участники второй группы 2 раза в неделю на протяжении 4 нед. проходили сеансы билатерального иглоукалывания с использованием четырех акупунктурных точек: ST36, LI4, KI3, LR3. Третьей группе пациентов проводилась так называемая фальшивая акупунктура, при которой кончик иглы втягивался в ее рукоятку без проникновения в кожные покровы. Результаты показали существенное увеличение латентного времени эякуляции у мужчин первой и второй групп по сравнению с плацебо. При этом пароксетин обеспечивал более выраженное увеличение продолжительности полового акта по сравнению с иглорефлексотерапией [68]. Похожие результаты были получены и позже, в 2016 г., однако в качестве лекарственного средства пациенты принимали дапоксетин [69]. Другое исследование, проведенное китайскими коллегами, наоборот, продемонстрировало большую эффективность акупунктуры по сравнению с медикаментозным лечением, что, возможно, связано с использованием разного количества акупунктурных точек [70].
Таким образом, иглорефлексотерапия действительно положительным образом влияет на длительность полового акта пациентов с ПЭ, однако механизм такого действия все еще непонятен. Возможно, воздействие на патогномоничные для эякуляторного рефлекса акупунктурные точки вызывает повышение концентрации серотонина, способствуя пролонгированию полового акта, однако этот вопрос остается открытым [66, 68].
Восстановительная терапия мышц диафрагмы таза, БОС-терапия. Как было сказано выше, эякуляция представляет собой рефлекторный процесс, который в определенной степени поддается произвольному контролю. По мнению H. Kaplan, человек способен задержать оргазм по собственному желанию. Пациент с ПЭ этого сделать не может. У него отсутствует осознание тех ощущений, которые предшествуют оргазму. Понимание этих ощущений служит важным условием развития произвольного контроля над эякуляторным рефлексом, подобно таковому при мочеиспускании или дефекации [52, 71]. Исходя из данного предположения, определенным успехом при лечении ПЭ пользуется так называемая восстановительная терапия мышц диафрагмы таза.
Оценке данной методики посвящено исследование L. Antonio et al., проведенное в 2014 г. Выборка состояла из 40 мужчин в возрасте от 19 до 46 лет с ПЭ с интравагинальным латентным временем меньше 60 с (в среднем 31,7 [16,6–57] с). В течение 12 нед. 3 раза в неделю в течение 40 мин пациенты учились волевым усилием избирательно и автономно работать мышцами тазового дна, выполняя различные упражнения с развитием изотонических и изометрических сокращений, при этом контролируя активность мышц-антагонистов. Последние 20 мин каждого сеанса отводились электростимуляции промежностных мышц, вызывающей каскад реакций, приводящих к сокращению уретрального сфинктера через промежуточную активацию лобково-прямокишечной мышцы. Спустя 12 нед. у 33 (82,5%) из 40 пациентов отмечен существенный прогресс в осуществлении контроля эякуляторного рефлекса. При этом латентное время эякуляции в среднем возросло до 146,2 (123,6–152,4) с [72].
Похожие результаты использования вышеописанной методики получены и ранее, в 1996 г. G. LaPera et al. [73], однако выборка пациентов была существенно меньше – 18 человек. У 11 (61%) из них наблюдалась положительная динамика. В 2014 г. G. La Pera повторил свой эксперимент с привлечением 78 пациентов. Увеличение латентного времени эякуляции отмечено в 54% наблюдений. Отсутствие значимых изменений у остальных участников объясняется неспособностью распознавать ощущение, непосредственно предшествующее эякуляции, с целью сокращения мышц тазового дна для торможения оргазма [74].
Таким образом, восстановительная терапия мышц тазовой диафрагмы, как и БОС-терапия, является многообещающей методикой, которая в будущем при детальном изучении и понимании ее механизмов сможет стать альтернативным терапевтическим вариантом лечения ПЭ [72–74].
Преждевременная эякуляция остается значимой медицинской и социально-экономической проблемой, требующей своевременного лечения у специалистов. Однако отсутствие единого подхода и стандартизированных лечебно-диагностических алгоритмов создает определенные трудности в практике врача-уролога, придавая проблеме раннего семяизвержения еще большую актуальность.
На сегодняшний день для лечения ПЭ используется масса методик: консервативное лечение с применением СИОЗС, хирургические способы коррекции (денервация головки полового члена, имплантация геля гиалуроновой кислоты под кожу головки, введение ботулотоксина в бульбоспонгиозную мышцу), поведенческая терапия, восстановительная терапия мышц тазового дна в сочетании с БОС-терапией, а также различные технологии рефлексотерапии. Каждая из вышеописанных методик имеет определенную доказательную базу, однако ее обоснованность служит предметом широких дискуссий.
На основании проанализированных данных литературы нами был сделан вывод об успешном применении каждого метода лечения, так как все они в той или иной степени вызывают увеличение латентного времени эякуляции с удлинением полового акта. Однако наиболее значимые результаты были получены при применении хирургического и медикаментозного способа. Тем не менее, по некоторым данным, иглорефлексотерапия показывает большую эффективность по сравнению с приемом СИОЗС, что необходимо учитывать при назначении лечения, особенно в тех случаях, когда лекарственная терапия противопоказана. Подобный эффект связывают с повышением концентрации серотонина при действии на патогномоничные для эякуляторного рефлекса акупунктурные точки, что помогает в понимании молекулярных механизмов, лежащих в основе эякуляторного рефлекса.
Использование восстановительной терапии мышц тазового дна в сочетании с БОС-терапией удлиняет латентное время эякуляции в 2,0–2,5 раза (медикаментозное лечение – в 3–4 раза), однако исследования по сравнению данных методик с другими так и не проводились, что делает полученные результаты недостаточно убедительными.
Таким образом, проведенный анализ литературы позволяет с определенной долей уверенности утверждать, что на сегодняшний день рефлексотерапия может стать достойной альтернативой двум основным способам лечения ПЭ: хирургическому и медикаментозному. Иглорефлексотерапия, в отличие от СИОЗС, не имеет побочных эффектов, характерных для последних, а также может быть с успехом применена при отказе пациента от оперативного вмешательства. Следующей линией лечения является восстановительная терапия мышц тазового дна в сочетании с БОС-терапией, которые при подтверждении их эффективности в более масштабных исследованиях смогут стать не просто эмпирическим методом лечения, а первым этапом лечебных мероприятий, направленных на коррекцию ПЭ.
Внедрение в практику врача-уролога различных методик иглорефлексотерапии и БОС-терапии поможет существенно сократить использование медикаментозных и хирургических методов коррекции, а также стать отличной основой для проведения рандомизированных клинических исследований по сравнению различных методик с оценкой их эффективности. Это в свою очередь будет способствовать разработке и усовершенствованию лечебно-диагностических алгоритмов и протоколов ведения пациентов с преждевременным семяизвержением.



