Введение. Интерстициальный цистит (ИЦ), или синдром болезненного мочевого пузыря (СБМП), – это хроническое поражение мочевого пузыря, проявляющееся выраженной дизурией [1–5]. В классических представлениях о патогенезе СБМП доминируют гипотезы об уротелиальной дисфункции, гиперактивации тучных клеток, нейрогенном воспалении и аутоиммунном процессе [2], в частности, нарушение целостности уротелиального барьера в сочетании с аберрантной иннервацией в субуротелиальном мышечном слое формирует условия для персистенции воспаления [6]. Это сопровождается изменениями в гликозаминогликановом слое на поверхности уротелия, повышением внеклеточной концентрации калия и деполяризацией нервных окончаний, секрецией провоспалительных медиаторов и формированием чувства боли [7, 8]. Как следствие – нарушаются механизмы восстановления уротелиального барьера, формируемого клетками эпителия, дифференцировки и апоптоза эпителиальных клеток [7], механочувствительности и коммуникации интерстициальных клеток [9]. В зоне повреждения регистрируется аномальная продукция пептидных факторов роста, цитокинов, нейромедиаторов, газообразных мессенджеров, в числе которых особая роль отводится оксиду азота (NO). Так, пациенты с СБМП с гуннеровскими повреждениями характеризуются высоким уровнем NO в уротелии, что способствует повышению проницаемости уротелиального барьера, в том числе в результате аккумуляции нитрозилированных белков [10]. Интересно, что гиперактивность мочевого пузыря может быть спровоцирована аккумуляцией побочного продукта гликолиза и одновременно конечного продукта неферментативного гликозилирования – метилглиоксаля, что сопряжено с высокой экспрессией синтазы оксида азота в клетках уротелия [11]. Участие данного механизма предполагается в патогенезе не только диабетической дисфункции мочевого пузыря, но и СБМП.
Для изучения СБМП предложены экспериментальные модели in vivo на животных (например, на основе повреждающего действия экзогенно добавляемого NO) [12], модели in vitro с фокусом на воспроизведение механизмов повреждения уротелиального барьера (в частности, развития оксидативного и нитрозативного стрессов) или его защиты (например, за счет применения гиалуроновой кислоты) [13–16]. Поиск способов контролируемой реализации эффектов активных форм кислорода или азота приводит к выбору экзогенного источника последних. В этом контексте перспективно применение так называемой неравновесной плазмы [17, 18]. Однако для устранения влияния температурных и радиационных факторов требуется промежуточный носитель, в качестве которого выступает вода, обработанная неравновесной плазмой, известной в литературе как плазменная кислота [19]. В состав плазменной кислоты входят такие стабильные продукты, как перекись водорода и азотная кислота, а также ряд нестабильных продуктов: пероксинитрит, супероксид анион радикал, азотистая кислота, моноксид азота и др. [20].
Цель исследования: анализ некоторых эффектов плазменной кислоты на ткани мочевого пузыря лабораторных животных in vitro и оценка возможности ее применения для моделирования in vitro ИЦ/СБМП.
Материалы и методы. В исследованиях использованы образцы тканей стенки мочевого пузыря 16 самок крыс линии Wistar в возрасте 3 мес. и массой 180–200 г. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, проводились с соблюдением принципов гуманности, изложенных в Директиве Европейского сообщества (2010/63/ ЕС) и в Приказе Минздрава России «Об утверждении правил лабораторной практики в Российской Федерации» № 267 от 19.06.2003, рекомендациях биоэтической комиссии по работе с лабораторными животными при Локальном этическом комитете и Локальным этическим комитетом КрасГМУ.
После эвтаназии осуществляли забор мочевого пузыря. Образцы стенки мочевого пузыря рамером 5×5 мм после обработки в плазменной кислоте в течение 1 ч фиксировали в 4%-ном растворе забуференного параформальдегида, после чего выполняли приготовление и нарезку срезов.
Плазменную кислоту получали в искровом плазменном реакторе с использованием 5 мл воды для инъекций в закрытой негерметичной стеклянной кювете. Частота следования импульсов составила 10 Гц. Использовали экспозицию 200 тыс. импульсов. Для формирования искрового разряда использовали униполярный наносекундный высоковольтный генератор импульсов (напряжение – 40 кВ, энергия импульса – 0,2 Дж, длительность – 50 нс). После обработки определяли pH раствора с помощью pH-метра Анион 4100 (Инфраспа-Аналит), Россия. Полученное в результате обработки значение pH составило 1,3±0,1. В качестве контрольной группы использовали приготовленные аналогичным образом образцы ткани мочевого пузыря без обработки раствором плазменной кислоты.
Иммуногистохимически в образцах стенки мочевого пузыря оценивали экспрессию следующих молекул: DUOX2 – фермент семейства НАДФН-оксидаз, генерирующий перекись водорода, MG – метилглиоксаль, Ki-67 – маркер митотической активности клеток, CD-133 – маркер стволовых и прогениторных клеток, NT (нитротирозин) – маркер нитрозилирования клеточных белков, VEGF – сосудистый эндотелиальный фактор роста. Количество ядерных клеток регистрировали с помощью красителя DAPI. Оценку экспрессии перечисленных молекул проводили согласно стандартным протоколам непрямого метода иммуногистохимии (иммунофлуоресцентный вариант) c cоответствующими первичными и вторичными антителами, с последующей визуализацией на флуоресцентном микроскопе ZOE™ Fluorescent Cell Imager (Bio-Rad, США). Подсчет клеток выполняли с применением пакета программного обеспечения ImageJ, версия 1.47 (Research Services Branch, США), и плагина для пакетной обработки [21]. При обработке результатов учитывали относительное количество клеток, несущих интересующую метку. Статистический анализ проводили с использованием пакета Statsoft Statistica и с применением методов описательной и непараметрической статистики.
Результаты иследования. Данные статистической значимости, ранговые суммы, размеры выборок для контрольной (К) и эспериментальной (PL) групп по результатам анализа методом U-критерия Манна–Уитни распознанных изображений, полученных при иммунногистохимическом окрашивании образцов тканей мочевого пузыря для различных меток, представлены в таблице. На рисунке приведены диаграммы нормированных по DAPI средних уровней экспрессии изучаемых меток с учетом ошибки среднего.
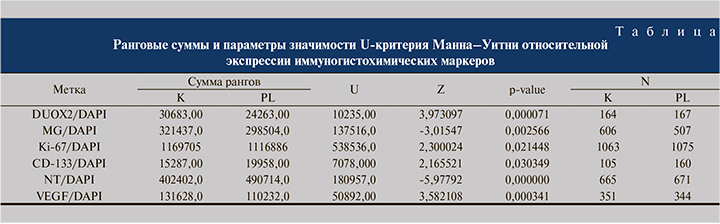
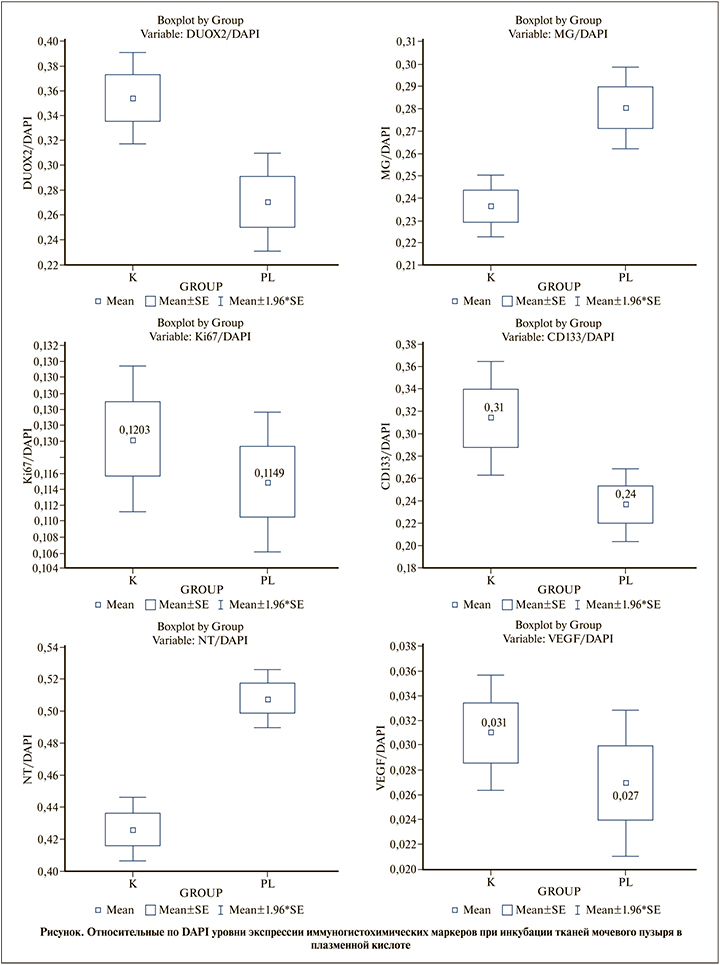
Обсуждение. При оценке влияния плазменной кислоты на экспрессию DUOX2 НАДФН-оксидазы в клетках эпителия мочевого пузыря in vitro мы выявили достоверное снижение экспрессия этого фермента. Известно, что в клетках эпителия слизистых различных локализаций и в опухолевых клетках экспрессия DUOX2 может увеличиваться, что обычно интерпретируют как признак иммуновоспаления [22] или высокой пролиферативной активности клеток [23], тогда как снижение экспрессии DUOX2 свидетельствует о приобретении клетками резистентности к действию факторов, провоцирующих продукцию активных форм кислорода [24]. Известно, что в условиях патологии, в частности при воспалении, клетки эпителия мочевого пузыря способны генерировать массу активных форм кислорода [24]. В связи с этим логично предположить, что вызванное плазменной кислотой снижение экспрессии DUOX2 может носить защитный характер для предотвращения избыточной продукции свободных радикалов и развития окислительного стресса.
Примечательно, что на действие плазменной кислоты клетки эпителия мочевого пузыря реагировали достоверным увеличением продукции метилглиоксаля (MG). MG – предшественник конечных продуктов гликирования белков [24]. Будучи аккумулированным в тканях, MG проявляет цитотоксические свойства [24] вследствие развития дикарбонильного стресса [25], который в свою очередь провоцируется развитием окислительного стресса [26]. Значительное увеличение продукции MG в клетках эпителия мочевого пузыря при действии плазменной кислоты подтверждает ее повреждающее действие на ткань за счет индукции окислительного повреждения биомолекул.
Данные по снижению экспрессии DUOX2 при действии плазменной кислоты ожидаемо соответствуют подавлению пролиферативной активности клеток эпителия мочевого пузыря, подтвержденному результатами оценки экспрессии Ki-67 – маркера митотической активности клеток. Таким образом, подавление экспрессии DUOX2 может быть не только адаптивной реакцией клеток на избыточное количество активных форм кислорода, присутствующих в их микроокружении вследствие экспозиции плазменной кислоты, но и отражением событий, приводящих к редуцированию их пролиферативной активности.
Иммуногистохимический анализ выявил снижение экспрессии CD-133 в эпителии мочевого пузыря под действием плазменной кислоты. Есть основания полагать, что снижение пролиферативной активности в эпителии мочевого пузыря связано с подавлением пролиферативной активности CD-133-иммунопозитивных стволовых и прогениторных клеток, присутствующих в этой ткани в качестве источника вновь образующихся клеток эпителия [27]. Вместе с тем следует отметить, что и дифференцированные клетки эпителия могут экспрессировать CD133 [28], поэтому антипролиферативная активность плазменной кислоты в эпителии мочевого пузыря может быть ассоциирована не только с влиянием на популяцию стволовых и прогениторных клеток, но и с прямым действием на клетки эпителия.
Цитотоксическая активность плазменной кислоты, опосредованная индукцией окислительного и дикарбонильного стресса, дополнялась развитием нитрозативного стресса, так как в клетках эпителия мочевого пузыря мы регистрировали значительно достоверное увеличение экспрессии нитротирозина как маркера нитрозилирования клеточных белков. Таким образом, в эпителии мочевого пузыря результатом действия плазменной кислоты оказалось развитие окислительного нитрозативного дикарбонильного стресса, которое, с одной стороны, привело к подавлению экспрессии собственного Н О -генерирующего фермента (DUOX2 НАДФН-оксидазы), с другой – вызвали снижение пролиферативной активности клеток.
Примечательно, что описанные выше эффекты сопровождались снижением экспрессии в ткани эпителия мочевого пузыря проангиогенного фактора роста – VEGF. Полагаем, что на фоне снижения митотической активности клеток эпителия редуцирование продукции VEGF означает дополнительное уменьшение пролиферативного потенциала ткани вследствие подавления процессов неоангиогенеза. Известно, что неангиогенез провоцирует в эпителии эпителиально-мезенхимальные взаимодействия [29], поэтому все перечисленные эффекты плазменной кислоты могут интерпретироваться как антипролиферативные и препятствующие эффективному восстановлению уротелиального барьера.
Заключение. Исходя из анализа изменений экспрессионного профиля клеток мочевого пузыря экспериментальных животных при действии плазменной кислоты in vitro, можно сделать вывод, согласно которому в эпителии мочевого пузыря доминирует антипролиферативный эффект на фоне развития окислительного, дикарбонильного и нитрозативного стрессов, что соответствует основным механизмам повреждения уротелия при ИЦ/СБМП. Такие эффекты подтверждают возможность применения плазменной кислоты в качестве индуктора повреждения клеток уротелия, характерного для развития ИЦ/СБМП, в моделях in vitro.



