В течение последних десятилетий отмечается рост заболеваемости мочекаменной болезнью (МКБ) во всех странах мира, в том числе и в России [1]. К счастью, современная медицина может предложить пациентам с МКБ ряд малоинвазивных методов избавления от камней мочевой системы.
В частности, с появлением перкутанных вмешательств на верхних мочевых путях открытые операции по поводу МКБ стали крайне редкими. Так, с момента первой чрескожной операции, выполненной E. Rupel и R. Braun [2], ПНЛ постоянно совершенствовалась и на сегодняшний день, согласно Российским клиническим рекомендациям [3] и Европейскому руководству по мочекаменной болезни [4], ПНЛ является первой линией лечения крупных (более 2 см) и коралловидных камней почек. Однако на этапе освоения данного метода урологическое общество относилось к нему с некоторым скепсисом в связи с травматичностью операции, а также потенциальной и вполне реальной опасностью таких осложнений, как кровотечение, повреждения смежных органов, а также инфекционных осложнений. Между тем совершенствование оборудования, улучшение хирургической техники привели не только к превосходству данного метода лечения в плане достижения состояния «stone free» по сравнению с дистанционной ударно-волновой литотрипсией и ретроградной нефролитотрипсией, но и сделали эти операции относительно безопасными для пациента.
Цель нашей работы: обобщить современные данные, касающиеся осложнений после ПНЛ, и способах их разрешения.
В базе данных PubMed был выполнен поиск статей, касающихся осложнений ПНЛ, опубликованных за период с января 2001 по июнь 2016 г. Поисковая стратегия заключалась в применении свободного текстового поиска. Были использованы следующие ключевые слова: PCNL, percutaneous nephrolithotomy, complication. При формировании поискового запроса исключались работы, посвященные педиатрической популяции пациентов, и работы, опубликованные не на английском языке.
Первичный поиск выявил 289 публикаций. В дальнейшем были исключены следующие виды публикаций: комментарии к статьям, тезисы конференций, а также публикации типа «описание клинических случаев». Оставшиеся 74 публикации включали 42 сравнительных исследования, 24 обзора литературы, 8 мета-анализов. Были изучены аннотации данных статей и отобрано 58 статей для дальнейшего изучения в полном объеме. Интерес представляли работы, выполненные на большом количестве пациентов (более 50), с описанием осложнений в соответствии с классификацией Clavien или имеющие детальное описание осложнений, которое может быть без труда оценено при помощи этой классификации. Также интерес представляли публикации, посвященные методам разрешения осложнений.
Частота осложнений
В двух исследованиях, выполненных в 2005 и 2006 гг. в Германии [5, 6], продемонстрировано, что частота послеоперационной лихорадки после перкутанных вмешательств может варьироваться от 21 до 32%, гемотрансфузии – от 11,2 до 17,5%, септицемии – достигать 4,7%, затеков мочи – 7,2%, повреждения кишечника – 0,2–0,8%, повреждения плевры – 3,1%. При этом группа M. Michel et al. [6], проанализировавшая данные 315 пациентов, отметила, что, несмотря на то что эпизод послеоперационной лихорадки наблюдался у 27,6% прооперированных, развернутая клиническая картина пиелонефрита выявлена лишь у 3,5%. Случай смерти от уросепсиса имел место лишь в 1 случае. Также авторы акцентировали внимание на том, что клинически значимое кровотечение развилось у 7,6% пациентов, почечная колика наблюдалась у 3,2%.
За последние годы отделение клинических исследований эндоурологического общества (Clinical Research Office of the Endourological Society – CROES) провело ряд масштабных исследований по изучению безопасности и частоты осложнений, возникающих после ПНЛ. В исследовании группы G. Labate et al. [7] была собрана информация из 96 центров по всему миру и включенs 5724 пациента, получивших ПНЛ, осложнения которых оценивали по шкале Clavien. Согласно полученным данным у 1175 (20,5%) пациентов наблюдалось одно или больше осложнений. У 634 (54,0%) пациентов наблюдались осложнения категории I по Clavien, у 301 (25,6%) – категории II, у 210 (17,9%) – категории III и лишь у 28 (2,4%) пациентов – категории IV. Авторы отметили два летальных исхода от уросепсиса.
D. la Rossette et al. [8] в аналогичном исследовании CROES, включившем 5803 пациента, показано, что наиболее частыми осложнениями были послеоперационная лихорадка (подъем температуры тела выше 38 С) – 598 (10,5%) человек и кровотечение – 446 (7,8%). При этом авторы отмечают, что проведение гемотрансфузии потребовалjсь только 328 (5,7%) пациентам. Уросепсис, гидроторакс, гематурия, инфекция мочевыводящих путей, перфорация органов таза и мочевые свищи наблюдались у небольшого числа пациентов.
В обзоре [9], в котором были проанализированы данные 11 929 пациентов, показано, что частота послеоперационной лихорадки составила всего 10,8%, гемотрансфузии – 7%, в то время как частота таких осложнений, как сепсис и повреждение внутренних органов, не превышала 1%.
Таким образом, большинство осложнений ПНЛ относятся к Clavien I–II и не требуют какого-либо лечения, что позволяет сделать вывод об относительной безопасности ПНЛ как метода хирургического лечения МКБ.
Факторы риска
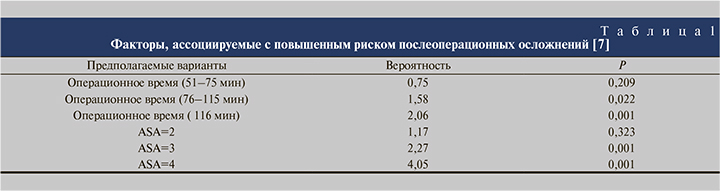
Согласно данным [7], риск осложнений, классифицированных по Clavien, имеет прямую связь со степенью анестезиологического риска по шкале ASA. Установлено, что при увеличении балла по шкале ASA увеличивалась степень осложнения по Clavien, т.е. вероятность хирургических осложнений напрямую зависела от физического состояния пациента. Так, при ASA=4 риск развития послеоперационных осложнений составил 58,1%, при ASA=3 – 26,4%. Другими факторами риска, выявленными в данном исследовании, были прием антикоагулянтов (21,5%), положительный посев мочи (18,1%) и сопутствующие сердечно-сосудистые заболевания (11,3%). Еще к одному значимому фактору риска развития осложнений авторы отнесли продолжительность операции, показав, что таковая более 116 мин увеличивает риск развития осложнений почти в 2 раза [7] (табл. 1). Следует также отметить, что ряд авторов относит к факторам риска сахарный диабет [10].
Не менее важным фактором, определяющим число осложнений, является количество выполняемых ПНЛ в стационаре. В работе [11] показано, что частота осложнений после ПНЛ в центрах с большим опытом (более 120 в год) подобных операций составляет 3,7%, что существенно ниже среднестатистического значения. Также клиники, имеющие статус специализированного центра по лечению МКБ, путем организации квалифицированной эндоурологической бригады, включая хирургов, медсестер, анестезиологов, и приобретения необходимого оборудования (лазер, пневматический, ультразвуковой литотриптеры, аппарат для дистанционной ударно-волновой литотрипсии), демонстрируют значительное уменьшение частоты осложнений и времени операции по сравнению с предшествовавщим периодом [8].
Инфекционные осложнения
Данные крупных исследований свидетельствуют, что частота послеоперационной лихорадки не превышает 11%. При это авторы отмечают, что даже при наличии эпизода лихорадки частота септицемии остается все же низкой и составляет порядка 0,3–0,4% [9]. По всей видимости, это связано с тем, что в ряде случаев лихорадка может носить реактивный характер и обусловлена резорбцией гематомы [10]. Это также подтверждается данными M. Duvdevani et al. [11], согласно которым лишь у 41% пациентов из 74% с лихорадкой наблюдалась эндотоксинемия.
К факторам риска инфекционных осложнений относятся положительный посев мочи перед операцией, аномалии развития верхних мочевых путей, нейрогенный мочевой пузырь, высокое давление ирригационной жидкости во время операции [12], наличие нефростомы, женский пол [13], размер камня (>20 мм), наличие обструкции, положительный посев камня [14], продолжительность операции и количество использованной ирригационной жидкости [15].
G. Gutierrez et al. [16] проанализировали данные 5354 пациентов, подвергшихся перкутанной нефролитолапаксии и получавших предоперационную антибактериальную профилактику. У 865 (16,2%) пациентов был положительный посев мочи, у 83,8% – отрицательный. Самым частым возбудителем была кишечная палочка – 350 (6,5%) пациентов. У 10% прооперированных лихорадка возникла, несмотря на антибактериальную терапию. Лихорадка имела место у 8,8% пациентов с отрицательным посевом и у 18,2% – с положительным; чаще наблюдалась при высевании грамотрицательной флоры (19,4–23,8%), чем грамположительной (9,7–14,5%). Авторы также отметили, что положительный посев мочи, наличие коралловидного камня, нефростомы до операции и сахарного диабета были ассоциированы с более высоким риском возникновения лихорадки в послеоперационном периоде.
Что касается развития сепсиса, то B. Lojanapiwat et al. [17] показали, что у пациентов с сепсисом положительный посев мочи из мочевого пузыря, из лоханки и положительный посев камня выявлялись достоверно чаще – в 66,1; 46,4 и 48,2% случаев соответственно по сравнению с 10,4; 3,5 и 3,5% у пациентов без сепсиса. Среди пяти пациентов с септическим шоком у четырех все посевы были положительные и только у одного зафиксирован положительный посев камня. По результатам данного исследования, рутинное выполнение посева камня представляется весьма оправданным [17]. P.Mariappan et al. [18] продемонстрировали, что среди пациентов с сепсисом положительный посев мочи из мочевого пузыря наблюдался лишь у 11,1%, тогда как положительный посев мочи из лоханки – у 20,4%, а положительный посев камня – у 35,2%. Риск развития сепсиса у пациентов с положительным посевом мочи из лоханки и положительным посевом камня был в 4 раза выше. Авторы сделали вывод, согласно которому посев мочи из мочевого пузыря является не самым надежным «предсказателем» развития сепсиса в отличие от положительного посева камня, отличающегося наибольшей информативностью, и рекомендовали рутинное выполнение посева камня, полученного во время операции. Таким образом, с целью прогнозирования развития сепсиса рекомендовано рутинное выполнение посева камня и средней порции мочи из мочевого пузыря [18, 19].
Многие исследователи доказали эффективность предоперационной антибактериальной профилактики [14, 20]. Было показано, что даже у пациентов с отрицательным посевом предоперационная антибиотикопрофилактика значительно снижает риск послеоперационных инфекционных осложнений – с 7,4 до 2,5% [21]. Что касается продолжительности курса антибактериальной профилактики, то в ряде исследований было доказано, что однократный прием антибиотика перед операцией равноценен недельному курсу [15, 22, 23].
Кровотечение
Кровотечение было и остается одним из наиболее значимых осложнений ПНЛ. Частота геморрагических осложнений после ПНЛ, требующих гемотрансфузии, варьируется, по данным литературы, от 3 до 23% [24]. Наиболее часто источником значительных кровотечений, требующих дополнительных хирургических манипуляций (селективная эмболизация, реноррафия и т.д.), являются сегментарные артерии, источником же менее интенсивных интраоперационных кровотечений, поддающихся консервативным мерам остановки, служат почечные вены [25]. В крайне редких случаях (0,2%) кровотечение может стать причиной остановки операции [10]. Частота кровотечений после проведения ПНЛ различна. В исследовании CROES кровотечение наблюдалось у 7,8% больных, при этом гемотрансфузия требовалась только в 5,7–7% случаев. Клиника геморрагического шока наблюдается еще реже – у 3% [26–28].
В свою очередь паранефральная гематома наблюдается у 7,6% прооперированных, подкапсульная гематома – у 15% и псевдоаневризма – у 0,5% [29]. Существует серия исследований, посвященных изучению факторов риска развития кровотечения после выполнения ПНЛ. Так, Turna et al. [30] установили, что состав камня, площадь поверхности камня и сахарный диабет ассоциируются с более высоким риском кровотечения и гемотрансфузии. В одном из исследований CROES, включившем 5537 человек, показано, что с повышенным риском кровотечения и гемотрансфузии ассоциированы такие факторы, как продолжительность операции, диаметр кожуха и количество операций, выполняемых ежегодно в стационаре. Кроме того, отмечено, что использование баллонного метода бужирования сопряжено с более высоким риском кровотечения [31].
Ряд авторов рассматрива.т факторы, связанные с выполнением доступа, как факторы риска возникновения кровотечения. Так, A. Muslumanoglu [32] показал, что при надреберном доступе частота кровотечения достигает 39,1%, в то время как при подреберном составляет всего 7,5%. При этом частота кровотечения при создании множественных доступов оказалась достоверно выше, чем у пациентов, которым был выполнен один доступ, – 18,5 против 7,6% соответственно.
Определенным вызовом для уролога является лечение пациентов, перенесших оперативные вмешательства на сердце и коронарных сосудах. Следует помнить, что риск тромбоза коронарного стента достигает 90% после прекращения двойной дезагрегантной терапии (ДАТ) [33], тогда как риск возникновения кровотечения в 3,4 раза выше на фоне проведения дезагрегантной терапии, чем в случае приема только аспирина [34]. Согласно данным [31], из 5537 пациентов антикоагулянтную терапию получали только 5,6%, при этом показатель частоты кровотечения в данной группе был статистически значимо выше.
При лечении пациентов данной группы следует особое внимание обращать на концентрацию тромбоцитов и МНО. Существуют исследования, показывающие, что при концентрации тромбоцитов <80 000/дл показано переливание тромбоцитарной массы [35], а при повышении показателя МНО>1,5 требуется медикаментозная коррекция – переход на более управляемый вариант антикоагуляции: низкомолекулярные гепарины, так называемый бриджинг [36].
В настоящее время особую популярность приобрела классификация Итальянской ассоциации кардиологов [37], согласно которой урологические оперативные вмешательства классифицируются по степени риска кровотечения, также классификация подразумевает разделение пациентов на три группы риска возникновения тромбоза (табл. 2).
В зависимости от степени риска тромбоза и кровотечения в классификации приводятся конкретные рекомендации по коррекции антикоагулянтной и антиагрегантной терапии.
После выполнения операции контроль кровотечения осуществляется в основном путем наблюдения за интенсивностью окрашивания мочи, поступающей по нефростоме; к симптомам продолжающегося кровотечения также относятся боль в поясничной области, пальпируемое болезненное образование во фланках живота (гематома), одышка, слабость, потливость, падение АД, снижение уровня гемоглобина. Для уточнения диагноза (выявления паранефральной гематомы) выполняется УЗИ или КТ почек.
Рекомендуемый алгоритм действий в случае продолжающегося интраоперационного кровотечения или кровотечения в раннем послеоперационном периоде должен включать следующие меры:
- прекращение операции с оставлением нефростомического дренажа;
- быстрый переворот больного на спину;
- установка валика под поясничную область;
- перекрытие нефростомы;
- гемостатическая терапия (транексамовая кислота) первой линии;
- динамический мониторинг АД и уровня гемоглобина;
- контроль нарастания гематомы при помощи УЗИ;
- при необходимости – проведение КТ c контрастированием;
- в случае продолжающегося кровотечения: гемостатическая терапия второго порядка, рекомбинантные факторы свертывания крови;
- при неэффективности консервативных методов показана селективная эмболизация сегментарной артерии, в случае отсутствия технической возможности – выполнение ревизии почки с ушиванием почечной паренхимы.
Если источником кровотечения являются межреберные сосуды, одной компрессии может быть недостаточно. В этом случае гемостаз может быть выполнен под визуальным контролем [36].
Для минимизации риска кровотечения, особенно для пациентов высокого риска, проводить коррекцию коагулопатии следует совместно с кардиологом, а при необходимости и с привлечением гемостазиолога. Также следует минимизировать время операции, использовать по возможности более тонкие инструменты, делать выбор в пользу одного оперативного доступа и отдавать предпочтение подреберному доступу.

Поздние послеоперационные геморрагические осложнения
Одним из видов поздних геморрагических осложнений является формирование субкабсулярной или паранефральной гематомы. Зачастую они протекают бессимптомно, выявляются случайно, при радиологическом обследовании, и не требуют каких-либо вмешательств. В раннем послеоперационном периоде гематому можно заподозрить в случае падения уровня гемоглобина и/или гематокрита в отсутствие выраженного кровотечения по нефростомическому дренажу. В этом случае после стабилизации состояния больного посредством инфузии кристаллоидов и компонентов крови выполняется КТ почек с контрастировавшим, которая позволяет также провести дифференциальный диагноз с уриномой. В случае неэффективности консервативной терапии показано выполнение ангиографии и суперселективной эмболизации. После разжижения содержимого гематомы при необходимости может быть выполнено чрескожное пункционное дренирование [38].
В редких случаях поздние кровотечения развиваются непосредственно после удаления нефростомического дренажа и носят профузный характер. Причиной данного вида кровотечений зачастую являются повреждения вторичных артериальных ветвей. В этом случае необходима внешняя компрессия наружного отверстия нефростомического хода и установка уретрального катетера для предотвращения тампонады мочевого пузыря. Помимо необходимых консервативных мероприятий показано выполнение КТ забрюшинного пространства с контрастированием, которая позволит подтвердить диагноз, определить, остановлено ли кровотечение в результате консервативных мероприятий, и решить вопрос о необходимости эмболизации сосудов [39].
Частой причиной поздних послеоперационных кровотечений служит формирование артериовенозных фистул или артериальных псевдоаневризм. При формировании артериовенозной фистулы истечение крови происходит из поврежденной артерии и прилегающей к ней поврежденной вены, а при артериальной псевдоаневризме – из поврежденной артерии через паренхиму почки в полостную систему.
Данный вид осложнений достаточно редок и встречается примерно в 1,2% случаев [40]; возникает через несколько дней или даже недель после перенесенной операции, зачастую после выписки пациента из стационара, и проявляется персистирующей умеренной гематурией. Ввиду отсутствия резкой массивной кровопотери нарушение гемодинамики возникает очень редко. Компьютерная томография почек с контрастированием позволяет достаточно быстро установить диагноз. Методом выбора при лечении является селективная эмболизация почечных сосудов [41].
Роль эмболизации сосудов почек в лечении геморрагических осложнений перкутанных операций
Первое применение эмболизации сосудов почки для остановки послеоперационного кровотечения после ПНЛ описано в 1973 г. J. Bookstain [42]. С того времени частота выполнения данного вида остановки кровотечения остается постоянной в пределах 0,8–1,3% [43]. Наиболее частыми находками при выполнении ангиографии после ПНЛ являются повреждение сегментных сосудов, артериовенозные фистулы, псевдоаневризмы [44].
Эмболизация почечных сосудов демонстрирует высокую эффективность в лечении геморрагических осложнений после ПНЛ. В мультицентровом исследовании [45] на серии из 144 пациентов продемонстрировано, что у 137 пациентов кровотечение было успешно остановлено после выполнения эмболизации ветвей почечной артерии в отсутствие осложнений, ассоциированных с данным видом лечения.
Возможными побочными эффектами эмболизации выступают боль в поясничной области, тошнота, рвота, лихорадка и артериальная гипертензия [46].
Противопоказания к эмболизации почечных сосудов: сепис, почечная недостаточность и аллергия на йодсодержащие контрастные вещества [47].
В исследовании A. El-Nanas 38 пациентам, перенесшим ПНЛ, выполнялась суперселективная эмболизация. У 6 из них были отмечены осложнения после эмболизации в виде паранефральной гематомы и экстравазации мочи. У 3 из 9 пациентов с единственной почкой отмечено повышение уровня креатинина, что не требовало проведения гемодиализа или трансплантации почки. Выделительная функция почки по данным нефросцинтиграфии улучшилась с 25% при исследовании, выполненном через 3 мес. после операции, до 34% по данным обследования, проведенного через 2,5–3 года после операции [48].
В настоящее время суперселективная эмболизация почечных сосудов является стандартным методом лечения геморрагических осложнений ПНЛ. Необходимость в люмботомии или лапаротомии может возникнуть при повреждении основных стволов почечной артерии или вены, при невозможности выполнения эмболизации почечных сосудов в приемлемые сроки или при ее неэффективности. В таком случае операция должна выполняться по следующему сценарию: после мобилизации почки осуществить временное пережатие почечной ножки, далее в зависимости от интраоперационной картины может быть выполнено ушивание дефекта паренхимы почки – реноррафия или ее резекция [49].
Повреждение смежных органов
Повреждение смежных органов составляет самую малочисленную группу осложнений перкутанных операций, встречаясь с частотой до 0,5% [52]. M. Semins et al. [29], выполнив КТ 196 пациентам, перенесшим ПНЛ, выявили ателектаз у 45% пациентов, плевральную эффузию у 8,6%, пневмоторакс у 1,5%, гемоторакс у 1% и гидроторакс у 0,5% пациентов.
В исследовании R. Munver et al. [51] торакальные осложнения диагностировались в 0,33% наблюдений, у 8 пациентов из 240 больных, причем в 7 случаях из 8 они наблюдались при надреберном доступе. Другие авторы также отмечают, что гидроторакс чаще наблюдается при надреберном доступе – 15,3%, в то время как при подреберном его частота составляет всего 1,4%. Лечение данных осложнений в подавляющем большинстве случаев не требует хирургической коррекции, только в клинически значимых случаях гидро- и гемоторакса необходимо дренирование плевральной полости [52].
В исследовании M. Seminset al. [29] в серии из 197 пациентов описан 1 случай установки нефростомического дренажа через селезенку. По мнению Shahet al. [53], в отсутствие признаков выраженного кровотечения длительное неизвлечение нефростомического дренажа позволяет избежать необходимости оперативной коррекции данного осложнения. Повреждение печени также относится к крайне редким осложнениям перкутанной хирургии, были описаны случаи успешного консервативного лечения данного повреждения [54]. Авторы наблюдений рекомендуют удалять нефростому на 5-е сутки под рентгенконтролем [9].
Частота повреждения толстой кишки не превышает 1% [54, 55]. К наиболее часто встречающимся симптомам интраоперационного повреждения кишечника относятся звук спускающегося воздуха (шипение) при пункции ЧЛС, подозрительный (напоминающий кишечные гаустуры) затек при выполнении антеградной пиелографии, крепитация в зоне нефростомы в раннем послеоперационном периоде, вздутие живота, диарея, неприятный запах мочи или симптомы перитонита.
Основным фактором риска является особенность анатомического расположения ободочной кишки, или так называемый ретроренальный колон. Такое расположение кишки встречается у 1% больных [56]. K. Hopper et al. [57] среди 500 пациентов ретроренальный колон выявили у 1,9%, лежавших на спине, однако при повороте пациента на живот ретроренальное расположение ободочной кишки констатировали уже у 10% пациентов.
При выполнении операции следует учитывать и другие факторы риска, которые могут способствовать повреждению кишечника: левая сторона операции, пункция нижней чашечки, пожилой возраст больного, подковообразная почка и хроническое вздутие кишечника.
Существуют и более специфические факторы риска:
- пункция латеральнее задней подмышечной линии;
- худые женщины с неразвитой забрюшинной жировой клетчаткой;
- мобильная почка;
- кифосколиоз;
- аномалии развития почек [56, 57].
К основным симптомам повреждения кишечника относятся звук спускающегося воздуха (шипение), крепитация в зоне нефростомы после операции, вздутие живота после операции, диарея или отсутствие стула, симптомы перитонита, характерный запах мочи, отхождение кала по нефростоме, подозрительный затек при антеградной пиелографии.
Лечение при внебрюшинных повреждениях сводится к установке почечного стента, временному переводу пациента на парентеральное питание, подтягиванию нефростомического дренажа в забрюшинное пространство, массивной антибиотикотерапии и контрольному исследованию пассажа контраста по кишечнику. При интраперитонеальных повреждениях, при симптомах перитонита показана неотложная лапаротомия и наложение колостомы на 3–6 мес. с последующей реконструктивной операцией.
Выводы
- Перкутанная нефролитотомия, выполненная по показаниям с тщательным отбором пациентов, с соблюдением техники оперативного вмешательства, является безопасным методом лечения камней почек с невысокой частотой осложнений. Уролог, выполняющий ПНЛ, должен быть осведомлен о возможных осложнениях, путях их предотвращения и быть готов к проведению адекватного лечения при необходимости.
- Размер камня, число доступов, размер кожуха, длительность операции, коморбидный фон, опыт хирургической бригады – факторы, способные влиять на частоту развития осложнений.
- На сегодняшний день большинство осложнений ПНЛ может быть разрешено консервативно и только небольшая их часть требует оперативного лечения.
- Незыблемое следование стандартам предоперационной подготовки пациента – санация мочи, коррекция коагулопатии, проведение КТ (для исключения ретроренального колона) – может позволить снизить риск инфекционных, геморрагических осложнений, а также риск повреждения близлежащих органов. Особое место занимает стандартизация выполнения пункции полостной системы почки и формирования нефроскопического доступа – что также вносит свой вклад в обеспечение интраоперационной безопасности пациента.
- Большинство геморрагических осложнений может быть устранено с помощью консервативных мероприятий (гемостатическая, заместительная терапия). При их неэффективности оптимальным методом лечения является селективная эмболизация ветвей почечной артерии, позволяющая снизить риск повреждения ипсилатеральной почки или ее утраты в попытке остановить кровотечение.
- Для дальнейшего повышения безопасности ПНЛ необходимо более углубленное изучение вопросов корреляции тех или иных факторов с риском развития осложнений. Это представляется сложно достижимой задачей без приведения классификации осложнений к общему стандарту. Также необходимо уходить в оценке осложнений от субъективных критериев к более объективным, например, таких как частота гемотрансфузий, уровень снижения гемоглобина в послеоперационном периоде и т.д. Разработка и повсеместное распространение такой классификации, проведение многоцентровых исследований позволят выработать единые рекомендации по предотвращению и лечению осложнений после перкутанных вмешательств на верхних мочевывходящи путях.



