В последние годы отмечается неуклонный рост числа травм различной локализации, которые являются ведущей причиной смерти, а также временной и стойкой нетрудоспособности лиц моложе 40 лет. Характерной чертой современных травм является превалирование множественных и сочетанных повреждений, что обусловливает высокую, не имеющую тенденцию к снижению летальность. Сочетанная травма характеризуется одновременным повреждением нескольких анатомо-функциональных областей и наблюдается у 50–70% пострадавших с тяжелыми механическими повреждениями. Ежегодно в РФ вследствие сочетанной травмы погибают более 35 тыс. человек. Сочетанная травма является одной из трех основных причин смертности населения, причем у людей в возрасте до 40 лет эта причина выходит на первое место. Показатель смертности в России от сочетанной травмы достигает 59–65 случаев на 100 тыс. населения [1].
В деятельности практически всех органов и систем организма механическая травма вызывает отчетливо выраженные изменения. Изменение функции почек при травме может увеличивать продолжительность лечения, ухудшать прогноз, приводить к развитию поздних осложнений.
В патогенезе травматического шока среди многих факторов нарушения деятельности почек занимают постоянное место, определяя нередко в случае развития острой почечной недостаточности (ОПН) исход травматической болезни [2, 3]. Это особенно относится к тем наблюдениям, когда травма носит множественный либо сочетанный характер и сопровождается обширными повреждениями мягких тканей. Острая почечная недостаточность – одно из самых тяжелых осложнений со стороны мочевыделительной системы больных с сочетанной травмой. К сожалению, до сих пор нет единого подхода к ранней диагностике этого заболевания у больных с политравмой. В обычной клинической практике классическими индикаторами ОПН являются повышение сывороточной концентрации креатинина и мочевины, однако они повышаются в крови, когда в патологический процесс вовлечено более 60% нефронов (на 3-й и 4-й день олигурии), поэтому в ранней диагностике ОПН значительной роли не играют. В частности, повышенные уровни сывороточного креатинина не информативны ни в отношении точного времени, когда наступает ОПН, ни в отношении локализации повреждения нефрона, ни тем более в отношении тяжести клубочкового или канальцевого поражения [4–6]. Остаются нерешенными вопросы коррекции изменений и профилактики нарушений функций почек при сочетанной травме. Таким образом, данная работа выполнена вследствие назревшей необходимости разработки методики ранней диагностики нарушений функций почек у больных с сочетанной травмой.
Острое повреждение почек является синдромом, в течение которого быстро развивается почечная дисфункция, приводящая к значимым изменениям в гомеостазе, порой приводящим к летальному исходу. ОПП встречается довольно часто (181–288 случаев на 100 тыс. населения) и обладает склонностью к непрерывному возрастанию [7–9].
Успех превентивных мер напрямую зависит от своевременности определения расстройств функционирования почек. Все методы лабораторной диагностики острого повреждения почек (ОПП) основываются на определении концентрации и/или содержания в биологических средах биомаркеров острого ренального повреждения [10]. Определение функциональной способности почек обычно проводится, основываясь на результатах количественного и качественного выявления сывороточного и креатинина мочи и мочевины. Но в нынешнее время становится ясным, что данные методы диагностики не являются достаточно чувствительными и подходящими для детекции острых ренальных расстройств [11]. В качестве примера можно привести тот факт, что концентрация сывороточного креатинина повышается только спустя 48–72 часа с начала повреждающего воздействия на почки. Это приводит к невозможности ранней диагностики острого повреждения почек [12]. На современном этапе развития медицинской науки разрабатываются инновационные способы, обладающие высокой чувствительностью и надежностью, способные сразу реагировать на повреждение почечной ткани. Данные способы в дальнейшем позволят динамично провести оценку особенностей развития гломерулярно-тубулярной дисфункции почек и использовать результаты при разработке превентивного лечения ОПП [13].
Биологические вещества, уровень которых в моче и крови значим для диагностики и прогнозирования при лечении пациентов с почечной дисфункцией, получили объединенное наименование биомаркеров ОПП. Их своевременное выявление подразумевает применение объединенных методик, доступных в любом лечебно-профилактическом учреждении. Благодаря научным разработкам, выполненным в конце XX–начале XXI вв., стало возможным сорганизовать определенный список возможных биологических маркеров ОПП [14], провести классификацию данных соединений и выявить их положительную роль в информативности выявления патологического процесса. Это включает определение уровня повреждения (гломерулы или тубулы), этиологии биологического синтеза маркера [15].
Биологические соединения, которые применяют в качестве маркеров ОПП, должны соответствовать определенным требованиям [16]. В первую очередь необходима легкодоступность биологического материала, определение проб должны быть неинвазивными и атравматичными. Помимо этого необходима стандартизация используемых методов лабораторной диагностики. Определяемые маркеры должны обладать высокой тропностью к локализации места повреждения нефрона (сосуды, канальцы, гломерулы), соответствовать причинам и продолжительности повреждений, клиническим особенностям развития патологического процесса, нуждаемости больного в гемодиализе, заключительному этапу патологического состояния (реконвалесценция, летальный исход, переход в хроническое течение), наличию адекватного ответа на проводимую терапию [17]. На сегодняшний день есть доказательная база абсолютного соответствия приведенным требованиям ряда маркеров острого повреждения почек [18, 19]. Несмотря на это, концепция научных исследований в поиске биомркеров острого повреждения почек остается злободневной [20–22].
Учеными разработана классификация биомаркеров ОПП (патофизиологическая, топическая, клиническая, рабочая) [23] (табл. 1).

Согласно патофизиологической классификации, маркеры ОПП делятся по возможности определять тот или иной этап развития патологического процесса в почках. Можно определить почечную дисфункцию с помощью креатинина и цистатина С крови. Перекисное окисление жиров детерминируется с помощью 4-ОН-2-ноненала, 8-А2α-изопростана. Повреждающее воздействие на нефроны и межуточную ткань выявляется с помощью IKM-1, L-FABP, NGAL. Реакция иммунитета отслеживается с помощью иммунограммы. Аннексин-5 является маркером апоптоза клеточных структур [24].
Топическая классификация делит маркеры на пять групп. α1-микроглобулин, β2-микроглобулин, альбумин, s-цистатин С указывают на альтерацию клубочков нефроцитов. Маркерами повреждения проксимальных отделов канальцевой системы выступают цистатин С, NGAL (нейтрофильный желатиназоассоциированный липокалин-2), ИЛ-18 (интерлейкин-18), IKM-1 (молекула почечного повреждения-1), α-GST (α-глютатион-S-трансфераза), L-FABP (БСЖК – белоксвязывающие жирные кислоты) и т.д. π-GST (π-глютатион-S-трансфераза) совместно с NGAL могут идентифицировать повреждение дистальных отделов канальцевой системы. При повреждении петли F. G. Henle маркером выступает натрийводородный разменник-3, а индикатором альтерации собирательных трубочек – OPN (остеопонтин) [24].
Клиническая классификация рассматривает способность использования данных маркеров для заблаговременной диагностики ОПП, мониторинг факторов, обусловливающих риск возникновения патологического процесса, выявление характерных особенностей в этиологии и патогенезе ОПП, динамику лечения и эффективность проводимых терапевтических мероприятий и т.д. [25].
Рабочая классификация представлена 4 группами маркеров: I группа – белки, образование которых значимо возрастает при остром повреждении почек (L-FABP, NGAL, ИЛ-18, IKM-1); II группа – маркер почечной дисфункции – сывороточный цистатин С; III группа – ряд уриногенных протеинов с низким молекулярным весом, например, α1-микроглобулин, β2-микроглобулин, цистатин С; IV группа – интрацеллюлярные ферменты (щелочная фосфатаза [ЩФ], лактатдегидрогеназа [ЛДГ], NAG [N-ацетилглутамат], α- и π-GST, ГГТП – γ-глутамилтранспептидаза) [26].
В нынешний период времени стало возможным выявлять при остром повреждении почек (ОПП) повреждение паренхимы за 24–48 ч до появления клиники болезни. Влияние на почки ишемических, токсических и иных причин при ОПП изначально провоцирует молекулярные преобразования, переходящие в повреждения клеточных структур. Последние же начинают образовывать специфические маркеры, и затем только возникает характерная симптоматика ренальной патологии.
С целью превентивного диагностирования ишемического острого канальцевого некроза (ОКН) уместно количественное выявление в моче зернистых цилиндров, канальцевых ферментов (α-глутатион-S-трансферазы, лейцинаминопептидазы, щелочной фосфотазы, N-ацетил-β-D-глюкозаминидазы (НАГ), γ-глутамилтранспептидазы), клеток тубулярного эпителия. В настоящее время наиболее перспективны для раннего выявления острой почечной недостаточности биологические маркеры, связанные с повреждением ренальной паренхимы, пролиферацией клеток, апоптозом, дифференцированием, расстройством иммунитета, образованием хемокинов и цитокинов, а не с понижением скорости клубочковой фильтрации. Изучение процессов выведения биомаркеров становится полезным для исследования превентивной диагностики и иных клинических моментов острой почечной недостаточности, которые не могут быть разрешены с применением обычных функциональных тестов. К последним можно отнести раннюю дифференциацию преренальной, ренальной, постренальной острой почечной недостаточности, исследование причин возникновения (ренальные токсины, сепсис, ишемия, острое воспаление паренхимы почек при нефропатии и инфекциях мочевывыводящих путей, синдром ишемии – реперфузии [СИР]), прогноз возможности смертельного исхода, завершением терминальной уремией, реакция на проводимую терапию.Высокое значение имеют маркеры, связанные с ранней стадией острого повреждения почек.
Среди таких маркеров ОПП, выявление которого находит все большую популяризацию, – липокалин, ассоциированный с желатиназой нейтрофилов (NGAL). Это протеин с молекулярной массой 25кДа, изначально выявленный в нейтрофилах и впоследствии в незначительном объеме эпителия трубочек. Вследствие ишемии и токсического воздействия на почки выведение его в клетках канальцев значительно возрастает, и увеличивается его выведение с мочой, предупреждая на 1–2 сут. нарастание сывороточного креатинина крови. Увеличение количества NGAL в сыворотке крови и моче выявляется после 2–6 ч после кардиохирургического оперативного лечения и отражает начальную стадию постоперационного ОПП. Являясь предиктором системной иммунной реакции (СИР) трансплантата почек, NGAL предвещает отсроченную функциональную способность с нуждаемостью реципиента в срочном гемодиализе (ГД).
Первые клинические исследования выполнены пациентам после кардиохирургических вмешательств в педиатрической практике. Была доказана роль NGAL как чувствительного предиктора развития ОПП после оперативного вмешательства с применением аппарата искусственного кровообращения (АИК), а также после коронарографии.
В клинической практике следует иметь в виду ряд ограничений по возможности использования NGAL в диагностике ОПП. Доказано, что уровень сывороточного NGAL может повышаться при исходном наличии хронической болезни почек (ХБП), артериальной гипертензии, инфекциях, анемии, гипоксии, злокачественных новообразованиях. Кроме того, имеются экспериментальные и клинические данные, демонстрирующие зависимость экскреции NGAL с мочой от уровня протеинурии. Последний факт особенно актуален при диагностике ОПП у пациентов с нефротическим синдромом, которые, как известно, изначально предрасположены к преренальному ОПП. При обследовании 79 пациентов с первичной гломерулярной патологией было показано, что протеинурия выше 3,5 г/сут. достоверно повышает уровень экскреции NGAL с мочой [27]. В табл. 2 представлены статистические показатели диагностической значимости определения NGAL в сыворотке крови и моче с целью диагностики ОПП.
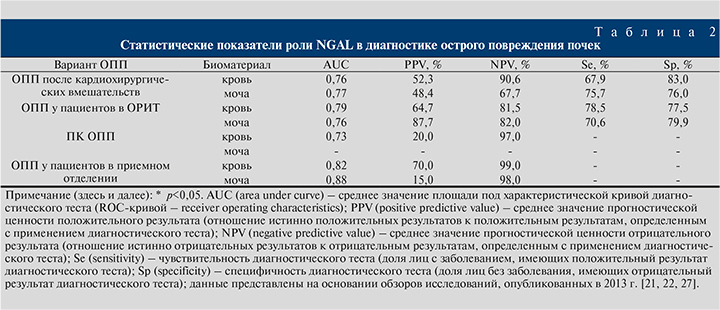
Динамическое отслеживание уровня NGAL в моче информативно при построении прогноза степени тяжести ОПП вследствие постдиарейного гемолитико-уремического синдрома в детском возрасте, у пациентов отделений интенсивной терапии, рентгенконтрастиндуцированных нефропатий. Нарастание в крови сывороточного α1-микроглобулина, который также относится к группе липокалина, специфично для заблаговременного диагностирования острого канальцевого некроза (специфичность – 81%, чувствительность – 88%) и диагностики необходимости острого гемодиализа.
Ниже представлена табл. 3, в которой дается сравнительная характеристика информативности некоторых биомаркеров при ОПП.

Цистатин С – ингибитор цистеиновой протеазы, образующийся в значительном количестве содержащих ядро клеток и фильтрующийся клубочками. Так как сывороточная концентрация цистатина С не связана с возрастом, объемом мышечной массы, гендерной принадлежностью, он значительно лучше определяет функциональное состояние фильтрационной способности почек по сравнению с креатинином. Возрастание сывороточного цистатина С опережает таковое креатинина крови на 24–48 ч, расценивается как I–II стадии ОПП у пациентов после оперативного лечения, у больных отделения интенсивной терапии. Данный метод относится к наиболее специфичным и высокочувствительным способам диагностики, в отличие от определения в моче N – ацетил-β-D-глюкозаминидаза (НАГ) и β1-микроглобулина. Следует отметить, что при остром повреждении почек увеличение сывороточной концентрации цистатина С возникает через 10 ч после выявления повышенного выделения NGAL.
Цистатин С представляет собой полипетидную цепочку массой 13 кДа, состоящую из 120 аминокислот. Цистатин С относится к ингибиторам лизосомальных протеиназ и продуцируется всеми ядерными клетками организма, предохраняя организм от неконтролируемой активации протеолиза собственных белков. Цистатин С поступает из клеток в кровоток равномерно, и его сывороточная концентрация поддерживается на постоянном уровне [13, 27]. Небольшая молекулярная масса и низкое сродство к другим сывороточным белкам определяют способность данной молекулы свободно фильтроваться в почечных клубочках, поступать в канальцы, где она реабсорбируется за счет мегалин-кубулин-опосредованного эндоцитоза и затем полностью метаболизируется в эпителиоцитах проксимальных канальцев, вследствие чего в норме цистатин С экскретируется с мочой в минимальных количествах.
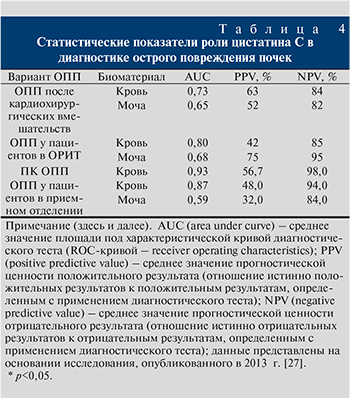 Средние параметры, отражающие диагностическую значимость цистатина С у пациентов c ОПП, отражены в табл. 4.
Средние параметры, отражающие диагностическую значимость цистатина С у пациентов c ОПП, отражены в табл. 4.
L-FABP – печеночный протеин, связывающий жирные кислоты (L-FABP, liver fatty acid binding protein). Это цитоплазматический белок с молекулярной массой 15 кДа, который экспрессируется в тканях с повышенным метаболизмом жирных кислот. Он относится к семейству белков – переносчиков жирных кислот, которые участвуют в транспорте длинноцепочечных жирных кислот между интра- и экстрацеллюлярным пространством, а также регулируют оксидативный стресс, связывая липофильные продукты, ограничивая их повреждающее действие на клеточные мембраны.
В организме человека данная молекула синтезируется в основном в печени, но в небольших количествах обнаруживается в почках и в тонком кишечнике. В нормальных условиях L-FABP отсутствует в моче, так как, фильтруясь в клубочках, затем полностью реабсорбируется в проксимальных канальцах, что позволяет диагностировать ОПП при их повреждении. Впервые это было продемонстрировано на модели ишемического канальцевого некроза у животных. Данный маркер проявил себя в качестве чувствительного предиктора ОПП у детей после кардиохирургических вмешательств с применением АИК. У пациентов с ОПП на фоне септического шока уровень L-FABP повышен и определяет относительный риск смертности. Исследование концентрации этого маркера в моче позволило говорить о нем как о приемлемом биомаркере ОПП у пациентов, поступающих в отделения реанимации (AUC 0,95, PPV 100%, NPV 85%) [20, 27].
KIM-1 – молекула повреждения почек, или клеточный рецептор-1 вируса гепатита А, является также биомаркером раннего повреждения почек. Он представляет собой черезмембранный протеин, который не определяется в нормальной почечной ткани и в моче, однако выявляем в поврежденном эпителии проксимальных канальцев вследствие ишемии или нефротоксического воздействия. Высокая чувствительность определения KIM-1 в моче дает возможность дифференцировать острое повреждение почек ишемического и токсического происхождения от преренальной гиперазотемии, хронической болезни почек, инфекции мочевыделительной системы, рентгенконтрастиндуцированной нефропатии. Высокая концентрация KIM -1 в моче при остром повреждении почек неблагоприятна прогностически.
Интерлейкин-18 (ИЛ-18) – провоспалительный цитокин, который локализуется в ренальных макрофагах, подоцитах и дендритических клетках. Повышение ИЛ-18 провоцирует образование свободных радикалов кислорода, который альтерирует эпителий извитых канальцев. Повышенное выделение с мочой ИЛ-18 при ишемическом остром канальцевом некрозе, СИР взаимосвязано с ферментурией (α-глутатион-S- трансфераза, НАГ) и опережает изменения концентрации сывороточного креатинина. С учетом высокой специфичности (более 90%), динамически отслеживая уровень ИЛ-18, становится возможным различать ишемическое острое повреждение почек, включая СИР трансплантата почек, хроническую болезнь почек, инфекцию мочевыводящих путей, преренальную ОПН. У пациентов, которые находятся в отделении реанимации с респираторным дистресс-синдромом взрослых (РДСВ), возрастание выделения с мочой ИЛ-18 становится маркером ОПН, опережая гиперазотемию на 2 сут.
Другие протеины-маркеры применимы в экспериментальных работах ОПН, и пока не проведены клинические испытания. Например, уромодулин, или белок Тамма-Хорсфалла, находящийся в эпителии дистальных почечных канальцев. На ранних этапах развития ОПН концентрация уромодулина значимо понижается.
Подает большие надежды выявление в моче одномоментно нескольких маркеров. В качестве примера NGAL, KIM-1, матриксная металлопротеиназа дают возможность с высокой чувствительностью заблаговременно диагностировать ОПН у пациентов детского возраста вследствие кардиохирургической операции.
Нами проведено обследование 42 пациентов, получивших сочетанную травму за период с 2019 по 2020 г. Биоматериалом для определения уровня цистатина С стала сыворотка крови. Забор крови осуществлен на 1-й, 3, 7, 14-й дни с момента травмы. Среди пострадавших преобладали мужчины (80%). Для оценки фильтрационно-реабсорбционной функции почек применяли пробу Реберга–Тареева. Определены следующие показатели всех пациентов: креатинин крови, креатинин мочи, количество мочи за 1 ч, минутный диурез, клубочковая фильтрация, канальцевая реабсорбция, количество выделенной мочи за сутки. У 40 (95,3%) обследованных показатели пробы Реберга–Тареева были в пределах нормы, у 2 (4,7%) – ниже нормативных значений, что было связано с развитием у них клиники острой почечной недостаточности. У 2 пациентов исследуемых больных развилась на шестой-седьмой день после травмы острая почечная недостаточность. Подавляющее число (38 человек) пациентов с сочетанной травмой имели нормальный уровень сывороточного креатинина. Уровень же сывороточного цистатина С у 33 (78,6%) пострадавших более чем на 30% превышал нормальные значения. Причем повышение уровня цистатина С наблюдалось в первые 3 сут., затем происходило постепенное его снижение. Скорость клубочковой фильтрации, согласно данным пробы Реберга–Тареева, была снижена только у 4 больных, тогда как при расчете по формуле Хоука – у 33. На 3-и сутки с момента травмы у 12 пострадавших на основании повышения уровня сывороточного цистатина было диагностировано субклиническое острое повреждение почек. При этом показатели азотемии у данной группы больных были в пределах нормы. Полученные данные свидетельствуют о большей информативности определения скорости клубочковой фильтрации по уровню цистатина С, что позволяет диагностировать скрытую почечную дисфункцию [28].
Проводились исследования и с применением других биомаркеров. Так, например, в работе, являющейся многоцентровой, было продемонстрировано, что одновременная оценка мочевых экскреций NGAL и KIM-1 позволяет предсказывать начало заместительной почечной терапии и относительного риска смертности [10]. В двухцентровом исследовании 529 пациентов, поступивших в отделение реанимации, сравнивалась роль 6 мочевых биомаркеров (ГГТП, ЩФ, NGAL, цистатин С, KIM-1, IL-18). NGAL, цистатин С и IL-18 являлись предиктором необходимости проведения диализной терапии, тогда как в отношении риска смертности предикторной ролью обладало большинство маркеров, кроме KIM-1 [15, 27].
Нет ответа на вопрос, какая комбинация биомаркеров оптимальна, но, по мнению некоторых авторов, наиболее оправданно сочетание маркеров с высокой чувствительностью, с одной стороны, и специфичностью – с другой.



