Суправезикальная обструкция различной этиологии остается актуальной проблемой современной урологии и наиболее часто в клинической практике проявляется обструкцией мочеточника. Обструкция мочеточника – собирательный термин, обозначающий наличие препятствия, нарушающего пассаж мочи по мочеточнику. Факторы, приводящие к развитию обструкции, могут быть эндогенными и экзогенными, ятрогенными и не ятрогенными, доброкачественными и злокачественными.
Говоря о причинах и распространенности обструкции мочеточника, следует отметить, что ятрогенные повреждения и лучевая терапия вызывают до 75% всех стриктур мочеточников [1]. Так, на долю гинекологических операций приходится большинство (64–82%) повреждений мочеточников, в то время как на колоректальные, сосудистые и урологические вмешательства приходится до 15–30% [2, 3]. Следует отметить, что с появлением лапароскопии (ретроперитонеоскопии) наблюдалось также и повышение частоты повреждений мочеточников при гинекологических и хирургических вмешательствах. Так, в исследовании Parpala-Sparman et al., ретроспективно проанализированы истории болезней 72 пациентов (60 женщин и 12 мужчин, средний возраст – 52 года) с ятрогенным повреждением мочеточников с 1986 по 2006 гг. Только пять травм произошли в течение первого семилетнего периода (1986–1992 гг.), а заметный рост заболеваемости отмечен в течение следующих двух семилетних периодов: 28 (1993–1999 гг.) и 39 (2000–2006 гг.) соответственно. Травмы в основном носили вторичный характер и наблюдались после гинекологических процедур (64%) или хирургических вмешательств (25%), повреждение в большинстве случаев локализовалось в нижних отделах мочеточника (89%). Только 11% повреждений возникли после урологических манипуляций [4].
Что касается абдоминальной хирургии, то наиболее частыми вмешательствами, при которых возникают повреждения мочеточника, остаются операции на толстой и прямой кишке [4]. За 10-летний период в США было выполнено 2 165 848 колоректальных хирургических вмешательств, при этом выявлено 6027 повреждений мочеточника (0,28%) [5, 6].
Стриктуры, связанные с лучевой терапией, обычно проявляются спустя несколько лет после курса терапии и зависят от примененного метода лечения и полученной дозы облучения. Частота заболеваемости при 10-летнем наблюдении пациентов с раком предстательной железы и раком шейки матки после лучевой терапии составляет 1,8–2,7 и 1,2% соответственно [7].
На урологические вмешательства приходится около 13% повреждений мочеточника с последующим образованием стриктур. Чаще всего повреждение связано с эндоскопическими операциями, выполняемыми по поводу удаления конкрементов [2]. Как показывает статистика, повреждение слизистой оболочки мочеточника при эндоскопических манипуляциях происходит в 0,3–4,1% случаев, перфорация — в 0,2–6,0%, а отрыв мочеточника возникает в 0,3–1,0% уретерореноскопий (УРС). Формирование стриктуры мочеточника наблюдалось в 0,5–2,5% случаев от общего количества повреждений [8]. Широкое использование УРС привело к увеличению числа ятрогенных стриктур мочеточников, частота возникновения которых связана с такими факторами, как длительность операции, размер эндоскопа, размер камня, вколоченные конкременты, перфорация [3,4]. По данным общества CROES (the Clinical Research Office of the Endourological Society), из 9681 пациента, перенесшего УРС, 29 (0,3%) были повторно госпитализированы через 3 месяца из-за стриктур мочеточника. Что касается стриктур мочеточника неятрогенного характера, то они чаще всего связаны с отхождением конкрементов: согласно исследованию Roberts et al., конкременты, находящиеся в мочеточнике более 2 мес., увеличивали риск образования стриктуры мочеточника в 24% случаев [9].
Переходя к методам лечения обструкции мочеточника важно отметить, что традиционные открытые и лапароскопические вмешательства более травматичны, чем эндоскопические методы лечения. «Радикальное» лечение может заключаться в реимплантации мочеточника, уретероуретеростомии, транспозиции подвздошной кишки и аутотрансплантации, замещениb мочеточника сегментом кишечника. При рецидивирующей обструкции лоханочно-мочеточникового сегмента и проксимальных стриктурах мочеточника альтернативой может быть замена мочеточника буккальным трансплантатом. Продолжительность операций колеблется в среднем от 170 до 340 мин. Эти методы требуют длительного времени на восстановление и соответственно стоимость лечения увеличивается [10]. С развитием рентген-эндоскопии в качестве альтернативы открытой или лапаро(ретроперитонео)скопической хирургии появились такие методы как баллонная дилатация, бужирование, эндотомия (в том числе и лазерная) и различные комбинированные методики. Успешные результаты при применении этих методов лечения варьируютcя от 46 до 89% при значительном снижении травматизации тканей и уменьшении сроков пребывания в стационаре и реабилитации пациентов [11, 12].
В настоящее время в абсолютном большинстве клинических наблюдений открытые лапароскопические и рентген-эндоскопические оперативные вмешательства при суправезикальной обструкции различной этиологии заканчиваются установкой внутреннего double-J или double-pigtail стента, гораздо реже – нефростомического дренажа, но следует отметить, что оба метода имеют определенные побочные эффекты и могут снижать качество жизни пациента. Установка внутреннего стента является эффективным методом дренирования почки, однако имеет ряд недостатков, таких как миграция стента, образование инкрустаций с последующей обструкцией стента, кровотечение, боль, симптомы раздражения мочевого пузыря, инфекция и пузырно-мочеточниковый рефлюкс (так называемые стент-зависимые или стент-ассоциированные симптомы) [13, 14]. Полимерные мочеточниковые стенты требуют замены, в зависимости от типа стента они могут находиться в мочеточнике от 3 до 9 мес. В случае обсеменения опухолью или массивного роста забрюшинной опухоли может возникать значительная компрессия стента, что приводит к обструкции мочеточника. Таким образом, все указанные выше факторы приводят к снижению качества жизни пациентов. Нефростомические дренажи отводят мочу из блокированной почки не менее эффективно, чем стенты. Однако в клинической практике предпочтение чаще отдается именно внутренним мочеточниковым стентам, так как наличие наружного дренажа с мочеприемником менее комфортно для пациентов как в быту, так и по психологическим причинам [15].
Используемые в настоящее время внутренние стенты обычно состоят из полиуретана, силикона или патентованных сополимеров, таких как Silitek (Surgitek, Medical Engineering Company, Racine, WI), C-Flex (Cook Medical, Bloomington, IN), Percuflex (Boston Scientific, Marlborough, MA), Tecoflex (PNN Medical, Квистгаард, Дания) и др. Первоначально мочеточниковые стенты изготавливали только из силикона. Хотя силикон является наиболее биосовместимым материалом из испытанных на сегодняшний день, высокий коэффициент трения и мягкость, характерные для силикона, затрудняют прохождение стентов через извилистый или блокированный мочеточник [16].
Для возможного уменьшения стент-зависимых симптомов и увеличения срока их нахождения в организме пациента были разработаны различные модификации внутренних стентов, включившие сверхмягкие стенты, стенты с лекарственным покрытием, стенты без пузырного завитка и локальные стенты различной конструкции. В данной работе мы анализируем публикации, посвященные наиболее часто применяемым локальным стентам длительного стояния без почечного и пузырного завитков, таким как Memokath, Uventa, Allium, Memotherm и нитиноловые стенты производства ООО МИТ.
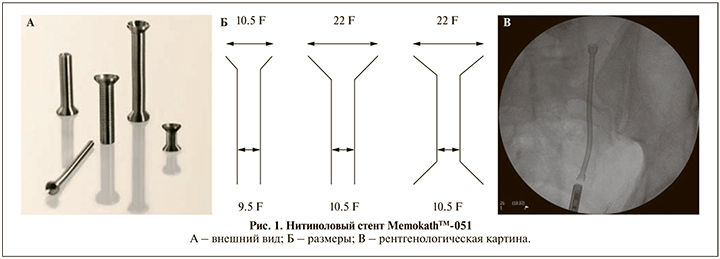
Memokathтм-051 (рис. 1) – терморасширяющийся стент (PNN Medical A/S, Дания). Представляет собой туго закрученную проволоку диаметром 0,4 мм из нитинола (никельтитановый сплав). При температуре 10°С он размягчается, а при 45°С приобретает заданную форму, это означает, что он может расширяться теплой водой и, наоборот, его удаление может быть облегчено подачей холодной ирригационной жидкости. Предполагается, что он менее подвержен инкрустации и прорастанию тканями. Существует три типа этого стента: оригинальный стент имеет диаметр проксимального конца 10,5 Ch и диаметр полой трубки 9,5 Ch; второй стент более широкий с диаметром проксимального конца 22 Ch и диаметром трубки 10,5 Ch, а третий вариант имеет двойное расширение с диаметром проксимального и дистального конца 22 Ch и диаметром трубки 10,5 Ch. Длина стента варьируется от 3 до 20 см [17].
По данным мета-анализа Khoo et al., частота миграции Memokath составила 20%, что является самым высоким показателем среди всех стентов длительного стояния, частота обструкции же составила 23,45%, а частота успеха в установке – 65%, что является самым низким показателем среди подобных стентов (95% CI 44–84%).[18]. Zaman et al. опубликовали исследование, в котором изучалось использование Memokath пациентами со злокачественной обструкцией мочеточника (ЗОМ). Сорок два стента были установлены 37 пациентам, в 30 наблюдениях стриктуры были локализованы в нижней трети мочеточника. 5 стентов вышли из строя из-за миграции, из них 3 мигрировали проксимально (предположительно из-за значительной дилатации мочеточника проксимальнее стента, что привело к расшатыванию анкерного конуса) и 2 дистально (возможно, из-за неправильной установки стента ниже стриктуры). Два стента у пациентов с переходно-клеточной карциномой мочеточника, ранее перенесших лучевую терапию по поводу мышечно-инвазивного рака мочевого пузыря, стали непроходимыми [19]. Papadopoulos et al. сообщают о 4 установках стентов 3 пациентам с ЗОМ. Один из установленных стентов мигрировал через 14 мес., был заменен и в дальнейшем функционировал; следует отметить, что эта пациентка ранее проходила курс лучевой терапии по поводу рака шейки матки. Другие два пациента умерли с функционирующим стентом [20]. Klarskov et al. установили 37 стентов 33 пациентам, из которых 5 были после лучевой терапии, а 7 – с ЗОМ. После установки миграция стента отмечена у 10 пациентов, у 12 отмечена обструкция стента [21].
Uventaтм (рис. 2) представляет собой двуслойный саморасширяющийся металлический сетчатый стент с покрытием из политетрафуроэтилена (ПТФЭ) (Taewoong Medical, Сеул, Корея).
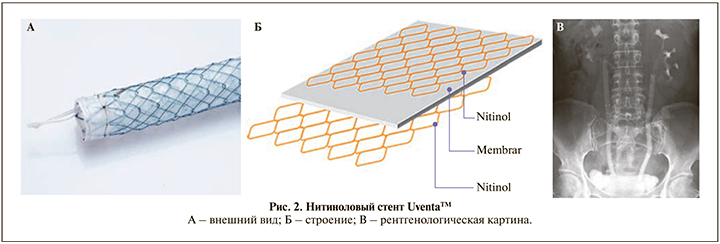
Он состоит из наружного и внутреннего нитиноловых стентов, между которыми располагается мембрана из политетрафторэтилена (ПТФЭ). Наружный стент предотвращает миграцию, внутренний стент повышает устойчивость к радиальному сжатию, тем самым сохраняя его проходимость, а мембрана из ПТФЭ предотвращает врастание тканей. Стент терморасширяющийся, а его плетеное покрытие обеспечивает хорошую пластичность. Внешний диаметр – 20Сh, длина – 6, 8, 10 и 12 см. Данный стент продемонстрировал низкую частоту обструкции – всего в 6% наблюдений (95% CI: 1–15%). Стент успешно установлен в 81% наблюдений [17]. J. H. Kim et al. в своей работе описали установку 20 стентов Uventa 18 пациентfv со стриктурами мочеточника. Большинство стриктур были в нижней трети мочеточника, средняя длина стриктуры составляла 10,6 см. При более протяженных стриктурах производили установку нескольких стентов, перекрывающих друг друга на 2–3 см. При среднем периоде наблюдения 7,3 мес. миграции стентов отмечено не было, что соответствует 100%-ному показателю успеха, однако вторичная обструкция мочеточника на фоне прогрессирования опухоли возникла в четырех случаях [22, 23]. Н. Н. Chung et al. сравнили эффективность стента Uventa с полимерными стентами типа double-J при лечении ЗОМ. Сорок два стента Uventa были установлены 32 пациентам, средний период наблюдения составил 8,5 мес. По результатам наблюдения 1 стент мигрировал, 10 были обтурированы. Проходимость стента через 24 мес. составила 65,3%, что значительно лучше, чем у пациентов в группе с double-J стентом (38%), период наблюдения которых составил 18 мес. [23]. K J. Chung et al. описали результаты установки 71 стента Uventa 54 пациентам с ЗОМ, у которых на фоне установки doubleJ стентов отмечались выраженные стент-ассоциированные симптомы. Медиана наблюдения составила 10,3 мес., а показатель успеха – 64,8% [24].
Alliumтм (рис. 3) (Allium Medical Solutions, Израиль) изготовлен из нитинола и покрыт сополимером, предотвращающим врастание ткани и образование инкрустаций. Стент обладает высоким радиальным сопротивлением. Диаметр стента может составлять 24 или 30 Ch и имеет длину 6, 8, 10 и 12 см [25].
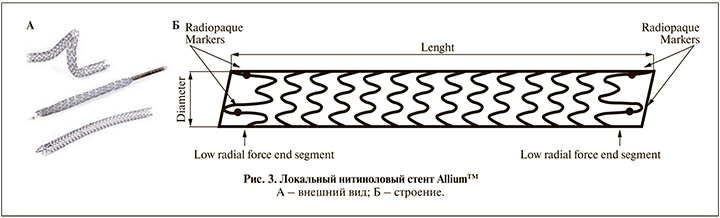
Стент разработан для шинирования стриктур нижней трети мочеточника (имеет переходный мостик для уретеровезикального соустья), но последние модификации без мостика могут применяться в любом отделе мочеточника. Moskovitz et al. опубликовали исследование, в котором изучалась роль стента Allium в лечении ЗОМ. Cорок девять стентов установлено 40 пациентам, из них 33 стента – 25 пациентам с фоновым злокачественным новообразованием. Двадцати пяти пациентам стенты установлены после операции и лучевой терапии по поводу гинекологического злокачественного новообразования и 8 стентов – после операции и местного лечения рака мочевого пузыря. Чктыре стента мигрировали, ни один из них не был обтурирован. Все эти 4 стента установлены в среднюю треть мочеточника [26]. Khoo et al. описали 71 наблюдение установки стентов: Allium – 23 и Memokath-051 – 48. У 47 пациентов (Allium – 16; Memokath – 31) общая медиана наблюдения составила 11,4 мес. для Allium, 5,5 – для Memokath. Успех установки был высоким (Allium – 95,7%; Memokath – 100%). В течение первого года после установки стентов уровень креатинина сыворотки крови колебался от +21,3 до +46,7% для Allium и от -7,8 до +8,9% для Memokath™-051. По результатам наблюдения для 11 пациентов с Allium и 31 с Memokath-051 установка стента оказалась неэффективной [18].
Memothermтм (BARD, США) представляет собой цилиндрический решетчатый стент из нитинола. Он приобретает свою заранее запрограммированную окончательную форму, как только достигает температуры тела. Имеет систему развертывания, состоящую из эргономичного пистолета наружным размером 7Ch, контролирующего расширение стента, внутреннего катетера, внешней оболочки и одного удлинителя, позволяющего вводить контрастное вещество во время процедуры. Длина стента может достигать 2, 3, 4, 5 и 6 см, а диаметр от 12 до 24Ch [17]. В 2007 г. во Франции. Sibert et al. установили 13 стентов Memotherm 12 пациентам, период наблюдения составил 19 мес. Средняя протяженность стеноза мочеточника составляла 37,9 мм. Стеноз рецидивировал у пяти пациентов из-за прогрессирования опухоли. О врастании тканей, инкрустации или миграции стента не сообщалось. Через 6 мес. у 85% пациентов симптомы, ассоциированные со стентом, отсутствовали, а спустя 12–18 мес. 75% пациентов не отмечали боли или гематурии [27].
Стенты из никелида титана (рис. 4) (ООО МИТ, Россия)
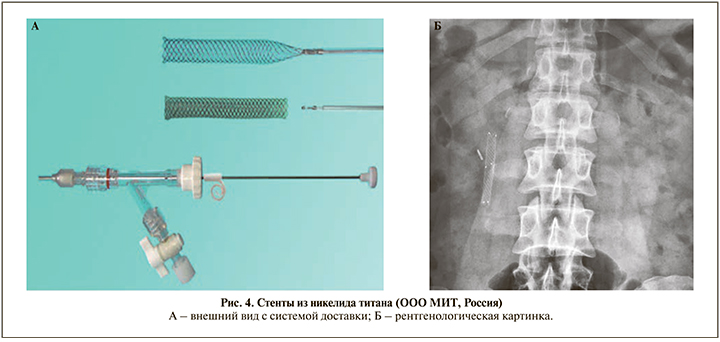
Изготовлены из нитиноловой мононити, обладающей свойствами высокой упругости и термопамяти. Стенты могут изготавливаться как с полиуретановым покрытием, так и без него. Установка производится с помощью доставочной системы с наружным диаметром от 6 до 10 мм, длиной от 30 до 80 мм, фиксированного на толкателе и заправленного в систему доставки, диаметром 8 СН и длиной 180 см.
С. Ю. Яровойи соавт. провели исследование по отдаленным результатам использования стентов ООО МИТ при стриктурах мочеточников различной локализации. Как сообщают авторы, ими выполнена установка 20 стентов 15 пациентам. Пятерым стенты устанавливали в область пузырно-мочеточникового соустья после ТУР стенки мочевого пузыря, Три стента установлены пациентке с обструкцией средней и нижней трети обоих мочеточников, обусловленных сдавлением извне, пять – пяти пациентам со стриктурой верхней трети мочеточника после перенесенных ранее открытых операций на почке и три стента – трем пациентам со стриктурой нижней трети мочеточника. Из 15 оперированных пациентов четырем (27%) стент был удален. 10 (66%) пациентов наблюдались от 5 до 6 лет, из них у 1 пациентки со стентом нижней трети мочеточника через 2 года наблюдения выявлен уретерогидронефроз вследствие обструкции на уровне стента. Одному пациенту по поводу стриктуры нижней трети мочеточника на третьем году наблюдения выполнена установка дополнительного стента в связи с образованием сужения ниже дистального конца ранее установленного стента. Двоим пациентам стенты удалили через 2 года наблюдения вследствие развития выраженной ирритативной симптоматики и наличия пузырно-лоханочного рефлюкса. И у одного пациента при контрольном обследовании на пятом году наблюдения выявлен уретерогидронефроз с облитерацией в области стояния стента без покрытия [28].
Дискуссия. Обструкция мочеточника, обусловленная стриктурой либо сдавлением извне, является актуальной проблемой современной урологии. Выбор «идеального» метода дренирования почки, который сочетал бы как адекватное отведение мочи, так и отсутствие осложнений, может оказаться очень непростым. Представленные в настоящее время на рынке внутренние double-J и double-pigtail-стенты и нефростомические дренажи позволяют обеспечивать адекватное дренирование верхних мочевыводящих путей. Тем не менее оба метода дренирования имеют свои недостатки, которые не позволяют позиционировать их как универсальные.
Говоря о традиционных внутренних стентах, необходимо учитывать, что они недостаточно устойчивые к компрессии внешним агентом (например, забрюшинной опухолью). Также нельзя забывать о стент-ассоциированных симптомах (САС), которые отмечают до 80% пациентов [16]. Наибольшее клиническое значение среди них имеют болевой синдром и расстройства мочеиспускания, которые могут значительно снижать качество жизни пациентов. Для борьбы с САС применяются различные подходы: разные способы установки стента, применение стентов различной длины, внесение изменений в конструкцию дистального завитка стента, использование стентов с различным покрытием, использование материалов с различной жесткостью. Для купирования САС широко применяется и медикаментозная терапия: альфа1-адреноблокаторы, холиноблокаторы, нестероидные противовоспалительные средства (НПВС) и бета3-адреномиметик (мирабегрон). К сожалению, полностью избавиться от САС не помогает ни один из вышеперечисленных методов. Нефростомические дренажи гораздо легче переносятся пациентами, но также имеют свои минусы: риск выпадения из чашечно-лоханочной системы вследствие неаккуратного обращения с дренажом, сложности с соблюдением гигиены (необходимость регулярных перевязок, запах мочи), а также психологический дискомфорт.
Современные локальные стенты практически лишены перечисленных выше недостатков. Материалы, из которых они изготовлены, позволяют эффективно противостоять радиальному сжатию, что особенно важно в ситуациях со злокачественной обструкцией мочеточника. За счет конструктивных особенностей (отсутствие дистального завитка) практически полностью исключены стент-ассоциированные симптомы, а отсутствие необходимости частой замены локальных стентов по сравнению с традиционными стентами также служит значимым преимуществом. При сравнении с нефростомическими дренажами локальные стенты выгодно отличаются отсутствием наружных частей.
Обсуждая преимущества локальных стентов, необходимо упомянуть и об их недостатках. Одним из противопоказаний к их применению является мочекаменная болезнь, необходимо исключить наличие конкрементов верхних мочевыводящих путей перед установкой стентов, так как описаны случаи вторичной обструкции стентов камнями [18]. Необходимо тщательно оценивать протяженность стриктуры с учетом риска миграции стентов. Еще одним немаловажным фактором является высокая стоимость локальных стентов.
Современные локальные стенты являются эффективным методом дренирования, однако требуют тщательного отбора пациентов при определении показаний к установке. Дальнейшие исследования и усовершенствования конструкции и материалов позволят расширить показания к их применению.



