Введение. Как известно, наиболее частой причиной развития пузырно-влагалищных свищей (ПВС) являются акушерско-гинекологические операции. Как минимум 85% случаев образования ПВС возникает вследствие трансабдоминальной гистерэктомии (в 1,4 случая на 1000 операций) или трансвагинальной гистерэктомии (0,2 случая на 1000 операций) [1–3]. Золотым стандартом лечения данной патологии является хирургическое закрытие фистулы. Согласно отчетам ВОЗ, первичная успешность фистулопластики ПВС достигается в 85–87% случаев [4]. Поэтому вопрос рецидива ПВС, а также других ранних и отсроченных осложнений остается крайне актуальным как для современного хирурга, так и для пациенток [5].
Результаты хирургического лечения ПВС, в особенности осложненных форм, не достигают удовлетворительных показателей во многих клиниках мира. Стоит отметить, что эффективность лечения зависит от опыта хирурга, точности соблюдения алгоритма подготовки пациенток и выбора правильной техники оперативного пособия [6]. Для адекватного выбора доступа и объема вмешательства врач должен иметь достаточный опыт не только в трансвагинальной хирургии, но и в лапароскопическом, трансабдоминальном доступах, а также владеть методиками как трансвезикальной, так и экстравезикальной фистулопластики [7]. Известно, что успех закрытия свища во многом зависит также от множества факторов, на которые не могут влиять манипуляционные и стратегические навыки хирурга.
К таким факторам относятся объемная потеря ткани, большой размер свища, распространенный рубцовый процесс, отсутствие хорошо васкуляризированной зоны мягких тканей в пределах парасвищевой резекции при выполнении фистулопластики [8].
Таким образом, с учетом оценки этих факторов в предоперационном периоде возможно проведение прогностического анализа эффективности заживления послеоперационной раны. По нашему мнению, оптимизация вышеуказанных факторов может положительно влиять на результаты хирургического закрытия фистулы путем улучшения трофики тканей, снижения воспалительной инфильтрации, а также адаптации уротелиального слоя к лучшим условиям регенерации.
В процессе поиска методики оптимизации морфологии парасвищевых тканей нами была анализирована статья M.K. Shirvan et al., в которой были отражены результаты местного применения аутоплазмы, обогащенной тромбоцитами (АПОТ) в форме геля, в отношении пациенток с первичными неосложненными ПВС небольших размеров (до 5 мм). Авторы сообщили о самостоятельном закрытии свища на фоне адекватного дренирования мочевого пузыря в течение 10–20 дней у 11 пациенток из 12 [9].
АПОТ – это достаточно новая методика усиления регенеративных способностей мягких тканей [10]. АПОТ представляет собой аутологичную плазму, которая имеет концентрацию тромбоцитов выше базового уровня на единицу объема. Наилучший эффект данной методики реализуется при достижении концентрации тромбоцитов в плазме, превышающей исходный уровень в 3–4 раза [11, 12].
В основе данного метода лежит влияние различных факторов роста, высвобождающихся из разрушенных α-гранул тромбоцитов [13], которые ускоряют все этапы заживления послеоперационной раны, участвуют в уменьшении некроза ткани, хемотаксисе, оптимизируют регенерацию и клеточную пролиферацию, а также участвуют в синтезе межклеточного матрикса, неоангиогенезе и эпителизации [14]. Необходимо отметить, что АПОТ содержит также целый ряд биоактивных химических элементов, которые обеспечивают адекватное питание для собственных стволовых клеток, основная роль которых – регенерация клеток [15]. Белки адгезии, такие как фибрин, фибронектин, витронектин, которые являются компонентом внеклеточного матрикса и играют важную роль в заживлении раны, также в большом количестве определены в АПОТ [16].
Цель исследования: провести сравнительную оценку морфологических параметров парасвищевых тканей до и после местного внутритканевого применения АПОТ-терапии.
Материалы и методы. В исследование включены 52 пациентки, которым была выполнена фистулопластика ПВС в период с 2011 по 2018 г. при свищах различного диаметра – от 3 до 40 мм (среднее значение – 10,23 мм) и локализации. Больные были разделены на две группы: в контрольную вошли 30 женщин, которым было выполнено хирургическое закрытие ПВС по стандартной методике. Во вторую группу включены 22 пациентки, которым до операции проводилась местная внутритканевая парафистульная терапия АПОТ. Критерии исключения: активный онкологический процесс, сложные комбинированные фистулы, постлучевые ПВС, деструкция уретры, клинически значимое уменьшение объема мочевого пузыря (менее 150 мл), тяжелая сопутствующая патология с противопоказанием к анестезии. Возраст пациенток варьировался от 25 до 74 лет (средний показатель – 47,3 года). Во всех клинических случаях применение АПОТ, а также оперативное вмешательство проводилось не ранее чем через 90 дней после образования фистулы.
От всех пациенток получено информированное добровольное согласие. Исследование было одобрено ЛЭК ФГБОУ ВО РостГМУ Минздрава России.
После образования ПВС АПОТ терапию начинали через 6–8 нед. во всех случаях и проводили в течение 5 нед. перед фистулопластикой при еженедельном парафистульном введении свежеприготовленной АПОТ. При этом временной интервал между появлением фистулы и ее хирургическим закрытием составлял более 12 нед. При первичном вагинальном осмотре и верификации ПВС всем пациенткам выполняли щипковую биопсию краев ПВС в трех точках на 12, 5, и 7 часах условного циферблата. Биопсийный материал отправляли на гистологическое исследование в забуференном 10%-ном нейтральном формалине. После выполнения щипковой биопсии больным II группы производили 9–10 парафистульных инъекций активированной АПОТ.
В каждую точку вводили 1,5–2 мл плазмы. Суммарный объем составлял 20–25 мл на один сеанс терапии. Повторную щипковую биопсию производили после завершения АПОТ терапии, т.е. через 5 нед. непосредственно перед оперативным вмешательством.
Приготовление и активацию АПОТ выполняли по методике S.E. Haynesworth et al. [6, 12].
В 41 случае были определены показания к трансвагинальному доступу с целью закрытия свища (84%). В четырех случаях проведена лапароскопическая реконструкция свища (8%). У 2 пациенток выбран роботассистированный доступ (4%), и лишь 2 пациенткам потребовалось выполнение нижнесрединной лапаротомии (4%) для ушивания ПВС. Подобное распределение по определению доступа соответствует выбору многих авторов, описывающих хирургическую методику закрытия ПВФ [17].
Для гистологического исследования срезы ткани окрашивали гематоксилином и эозином по стандартной технологии. Окрашенные препараты сканировали на сканирующем микроскопе Pannoramic FLASH (Zeiss). Первичную оценку морфологических характеристик производили посредством изучения гистологических срезов, приготовленных из парафистульных тканей после первичной щипковой биопсии пациенткам обеих групп (n=52). Кроме того, проводилось сравнение морфологических параметров во 2-й группе до и после применения АПОТ. Производили оценку эпителиального покрова, наличие или отсутствие эрозий и изъязвлений, выраженность фиброза, хронической воспалительной инфильтрации, микрососудистой плотности на цифровых изображениях в программе CaseViewer (3D HISTECH, Ltd., Венгрия) Обозначение степени клеточной плотности проводилось по морфометрическому подсчету количества клеток с использованием программного обеспечения Image-PRO, Media Cybernetics, США.
Статистическую обработку полученных параметров проводили с применением пакета прикладных программ Statistica 10.0. Значимым принимали уровень р≤0,05. Сравнение проводили с использованием t-критерия сравнения средних (для количественно измеренных характеристик), дополненных расчетами непараметрических критериев Манна–Уитни, Уилкоксона и Z-критерия Колмогорова–Смирнова. Для характеристик, имевших качественное измерение, также был использован инструментарий таблиц сопряженности.
Результаты. С целью анализа морфологических параметров парасвищевых тканей при первичной биопсии и оценке сопоставимости I и II групп по характеристикам ПВС было произведено сравнение больных по возрасту (лет), расстоянию между свищем и шейкой мочевого пузыря (см), наибольшему диаметру (мм), объему теряемой мочи (количество прокладок), стадии рубцевания (ст), инфекции МВП (есть/нет). Результаты сравнения представлены в табл. 1.
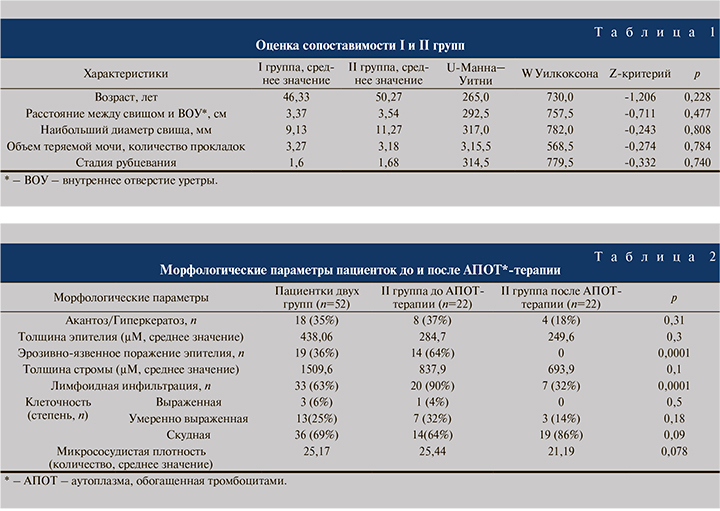
Таким образом, две группы больных сопоставимы по всем параметрам (p>0,05). Следовательно, имеется возможность провести оценку изменения морфологических параметров после лечения АПОТ терапией в исследуемой группе (табл. 2).
При первичной биопсии среди 52 пациенток нарушение кератинизации было зафиксировано у 18 (35%), причем у 12 из них были обнаружены признаки акантоза, у 6 – гиперкератоза. Толщина эпителия варьировалась от 52 до 1870 µМ (среднее значение – 438,06 µМ). В 19 случаях визуализированы признаки эрозивно-язвенного поражения эпителия. Толщина стромы составила 207–5980 µМ (среднее значение – 1509,6 µМ), среднее значение толщины фиброза в обеих группах – 524 µМ, (минимальный показатель – 25 µМ, максимальный – 1100, медиана – 596,0 µМ). Лимфоидная инфильтрация наблюдалась у 33 больных (63%). По выраженности клеточной плотности случаи распределились следующим образом: выраженная степень – у 3 (6%) пациенток , умеренно выраженная – у 13 (25%) и низкая плотность – у 36 (69%). Микрососудистая плотность составила 25,17.
При первичной биопсии у 8 (37%) пациенток II группы выявлены нарушения кератинизации, причем после завершения АПОТтерапии данный признак был зафиксирован лишь у 4 (18%) пациенток (p>0,05). Сравнительная оценка эпителиального покрова отдельно взятой пациентки относительно гиперкератоза отражена на рис. 1. Важно отметить тот факт, что у всех пациенток II группы после проведения АПОТ-терапии эпителиальный слой имел нормальное гистологическое строение, что служило статистически значимым параметром (p<0,05).

У 14 (64%) пациенток II группы исходно установлено эрозивно-язвенное поражение покровного эпителия. При контрольной биопсии эрозий ни у одной из пациенток выявлено не было (p<0,05) (рис. 2).
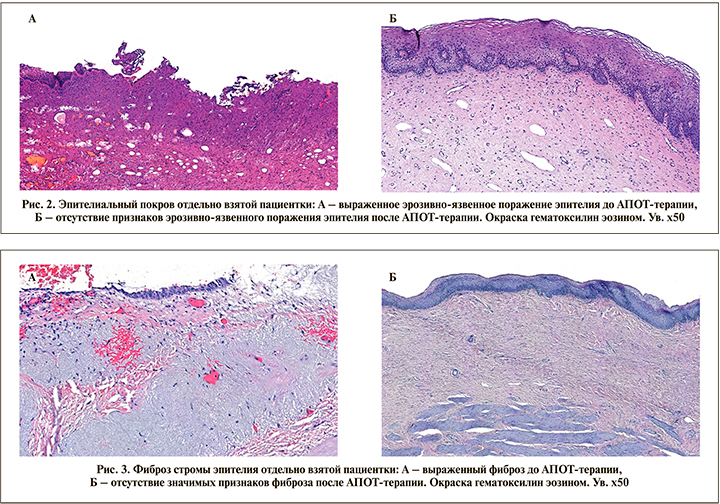
Толщина фиброзной ткани во II группе до терапии составила 886,3±113,5, после – 830,1±119,9 µМ (р=0,66). Однако стоит отметить, что в отдельно взятых случаях отмечено значительное уменьшение фиброза стромы эпителия (рис. 3). Лимфоидная инфильтрация исходно присутствовала у 20 пациенток II группы, у 8 из них (40%) после терапии она уменьшилась с выраженной или умеренно выраженной до полного отсутствия (p<0,05) (рис. 4).

У 7 (32%) пациенток сохранилась слабовыраженная лимфоидная инфильтрация. Стоит отметить статистически значимое различие (p<0,05) при сравнении клеточной плотности: она уменьшилась после АПОТ-терапии у 11 (50%) пациенток, однако у 4 (18%) увеличилась с низкой до умеренной.
В группе АПОТ (n=22) микрососудистая плотность (МСП) до терапии составила 29±3,3 (минимум – 15, максимум – 64,7), после терапии – 19,9±1,9 (минимум – 9, максимум – 36). Различие имеет статистическую достоверность на уровне тенденции (p=0,078).
Обсуждение. Самым распространенным осложнением фистулопластики ПВС является рецидив свища. Во многом вероятность развития данного осложнения зависит от состояния парафистульных тканей, распространенности рубцового процесса, наличия хронического воспаления, эрозивно-язвенного поражения, а также нарушенной трофики тканей. Адаптация морфологических характеристик, уменьшение воспалительного процесса, улучшение трофики тканей и хирургическое пособие, выполненное опытным хирургом, служат залогом успешного закрытия ПВС. Нами была предложена методика использования АПОТ-терапии как фактора, позволяющего подготовить парафистульные ткани, оптимизировать морфологические характеристики перед выполнением реконструкции. Для сравнительной оценки эффективности влияния АПОТ на морфологические характеристики проведена гистологическая оценка парафистульных тканей до и после ее местного внутритканевого применения.
При микроскопическом исследовании свищевого хода после АПОТ-терапии отмечается нормализация состояния выстилающего его эпителия (исчезновение гиперпаракератоза и акантоза, восстановление нормальной морфологической структуры). Обнаружено уменьшение толщины и клеточности фиброзной ткани (p<0,05), что свидетельствует о выраженном неоангиогенезе, улучшении трофики тканей и восстановлении адекватной морфологической структуры. Отмечается уменьшение воспалительной инфильтрации (если она была зафиксирована), что, вероятнее всего, связано с многофакторным влиянием тромбоцитов на противовоспалительные механизмы в местных тканях. Данный эффект может быть следствием образования тромбоцитами метаболитов кислорода, таких как супероксид, перекись водорода, а также выброса свободных радикалов гидроксила [18,19]. Данные механизмы обладают стойкой противовоспалительной и антимикробной активностью.
Было зафиксировано уменьшение МСП при первичной морфологической оценке парафистульных тканей по сравнению с состоянием тканей после завершения курса АПОТ. Полученные данные, по-видимому, связаны с созреванием грануляционной ткани и уменьшением воспалительной инфильтрации, улучшением состояния свищевого хода. Повторный забор материала для исследования проводили однократно – после завершения АПОТ терапии по этическим соображением с целью исключения посттравматического увеличения ПВС в диаметре.
Созревание грануляционной ткани в виде сокращения количества клеток воспаления, фибробластов, капилляров, увеличение размеров и числа волокон коллагена происходят в среднем через 4 нед. Таким образом, через 5 нед.на момент взятия биопсии после АПОТ-терапии имели место признаки зрелого рубца. С учетом механизма действия АПОТ-терапии, улучшения васкуляризации и пролиферации сосудов, изменения фибробластов и эпителия происходят в первую неделю после начала лечения. А через 5 нед. можно наблюдать результат проведенной терапии в виде заживления, эпителизации и финального рубцевания мягких тканей.
Заключение. Морфологическая трансформация парасвищевых тканей ПВС после местной внутритканевой терапии АПОТ улучшает эффективность хирургического лечения и позволяет добиваться в 13,6% случаев самостоятельного закрытия фистул диаметром до 5 мм, а в 50% случаев уменьшить фистулы в диаметре не менее чем в 2 раза. Учитывая статистически значимое снижение активности воспалительного процесса, полное купирование эрозивно-язвенного поражения, уменьшение толщины фиброза в стромальном слое в тканях свища применение АПОТ- терапии при хирургическом лечении ПВС следует считать целесообразным и обоснованным.



