Введение. Хронический простатит (ХП) – гетерогенное поражение с точки зрения этиологии, патофизиологии, клиники и имеет сложную классификационную структуру, отражающую широкий спектр состояний, подлежащих различным подходам к лечению. Особое место среди различных форм ХП занимает так называемый хронический простатит IIIБ, связанный с синдромом хронической тазовой боли (СХТБ).
Многочисленными исследованиями последнего десятилетия убедительно доказано, что эта форма поражения отличается от форм ХП II и СХТБ/ХП IIIА, хотя клинически они во многом схожи [1–6]. Однако причины и механизмы развития формы СХТБ/ХП IIIБ остаются недостаточно исследованными. Ранее нами была продемонстрирована сниженная артериальная перфузия предстательной железы (ПЖ) [7, 8], отсутствие реактивной гиперемии ПЖ в ответ на ее пальцевой массаж [9, 10], идентичность боли и симптомов нижних мочевыводящих путей (СНМП) у больных формой ХП IIIБ и атеросклерозом магистральных артерий таза [11, 12], а также наличие у этих пациентов системных нарушений липидного обмена [13, 14], что послужило основой гипотезы об ишемической природе боли и СНМП, ассоциированных с ПЖ [15–18].
В связи с вышесказанным нами было предпринято морфологическое исследование ПЖ при СХТБ/ХП IIIБ для оценки роли фиброзного и сосудистого факторов в развитии этого процесса.
Материалы и методы. Объектом исследования стали ПЖ 10 пациентов (медиана возраста – 35,5 [32,8; 39,8] лет и диапазон – 22–47 лет) с диагнозом СХТБ/ХП IIIБ и его длительностью 7,5 (4,5; 10) лет в интервале от 2 до 20 лет. Объем ПЖ составил 19,1 (17,7; 24,4) см3 в интервале 13,2–41,6 см3.
Критерии включения в исследование:
- типичная картина боли и СНМП, ассоциированных с ПЖ;
- снижение ≤10 мл/с пиковой скорости кровотока в интрапростатических сосудах по данным цветного допплеровского картирования;
- отсутствие роста пиковой систолической скорости в ответ на однократный лечебный массаж ПЖ;
- определение дислипопротеинемии IIA- и IIБ-типов;
- толерантность к курсу терапии СХТБ/ХП IIIБ 1-й линии.
Тонкоигольчатая пункционная биопсия ПЖ осуществлена под УЗ-контролем в двух точках справа и слева в периферической зоне.
 Морфологическая оценка биоптатов проведена методами световой и электронной микроскопии, а также иммуногистохимически с оценкой антител к CD31, CD34, NSE, S100.
Морфологическая оценка биоптатов проведена методами световой и электронной микроскопии, а также иммуногистохимически с оценкой антител к CD31, CD34, NSE, S100.
Материал для гистологического, гистохимического и иммуногистохимического исследования зафиксировн в 10%-ном забуференном нейтральном формалине с последующей заливкой в парафиновые блоки по классической методике. Срезы окрашивали гематоксилином и эозином, реактивом Шиффа по Хочкиссу, трихромовой окраской по Массону, импрегнировали серебром по Футу.
Для проведения электронной микроскопии биоптаты фиксировали 2,5%-ным глютаральдегидом на фосфатном буфере pH 7,2–7,4, обрабатывали общепринятыми методами для электронно-микроскопического исследования. С полученных блоков получали полутонкие срезы, которые окрашивали толуидиновым синим или азуром II – основным фуксином, изучали в световом микроскопе для прицельной заточки пирамиды перед приготовлением ультратонких срезов. Ультратонкие срезы толщиной 70 нм изготовлены на ультрамикротоме LEICA EM UC 6 («Leica», Германия) с использованием алмазного ножа Diamont (Швейцария), контрастировали уранилацетатом и цитратом свинца и просматривали в трансмиссионном электронном микроскопе Jem 1011 («Jeol», Япония).
Результаты. Изменения паренхимы ПЖ различного характера выявлены во всех исследованных биоптатах, но ни в одном случае не было признаков воспалительной инфильтрации. Одни железы имели почти нормальное строение, в других определены черты парциальной и простой атрофии, при этом в большинстве биоптатов обнаружены признаки очаговой гиперплазии.
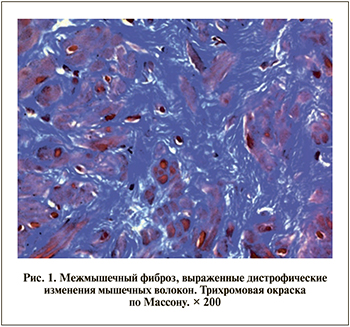
Наиболее значимые изменения отмечены в строме и мышечных волокнах. Во всех случаях обнаружен межмышечный фиброз, чаще тотальный, с замещением мышечной ткани преимущественно грубыми коллагеновыми волокнами. Изменения мышечных волокон мозаичны: в части из них наблюдалась гомогенизация и эозинофилия цитоплазмы, другие были атрофичны, при этом определены и зоны мышечной гипертрофии (рис. 1).
При ультраструктурном исследовании мышечные клетки в основном мелкие с выраженной извилистостью контуров окружены массивными пучками дезориентированных коллагеновых волокон (рис. 2, а). В отдельных лейомиоцитах отмечено нарушение ориентации миофибрилл, количество плотных телец в таких клетках уменьшено, в их цитоплазме встречались вакуоли и гранулы липофусцина (рис. 2, б). Ядра в основном пикнотичные или с маргинированным хроматином, в некоторых клетках встречались резко складчатые или фрагментированные ядра, количество митохондрий снижено (рис. 2, в). Лейомиоциты отделены друг от друга массивными прослойками коллагеновых волокон, что, очевидно, приводит к ишемическому повреждению на фоне выраженной пролиферации соединительной ткани.

В очагах массивного межмышечного фиброза значительная часть мышечных волокон находилась в состоянии некробиоза, в их цитоплазме присутствовали массивные отложения липофусцина, что также является характерным признаком ишемического повреждения клеток (рис. 2, г).
В подавляющем большинстве наблюдений (9 из 10) снижение плотности сосудов микроциркуляторного русла варьировалось от умеренной до тяжелой степени.
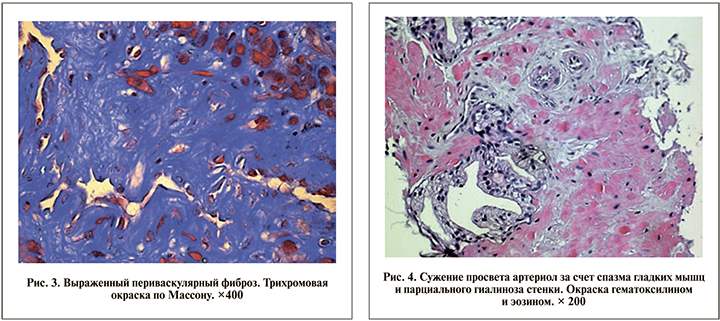
Просветы капилляров в зонах фиброза плохо визуализировались (рис. 3).
Стенки артериол были утолщены за счет гипертрофии медии, просвет стенозирован, в стенках отдельных артериол отмечено массивное накопление гиалина. Просвет артерий был стенозирован, в их стенках также определялись массивные отложения гиалина, визуализировался набухший эндотелий (рис. 4). В 8 случаях из 10 широкие поля периваскулярного фиброза содержали единичные спавшиеся сосуды.
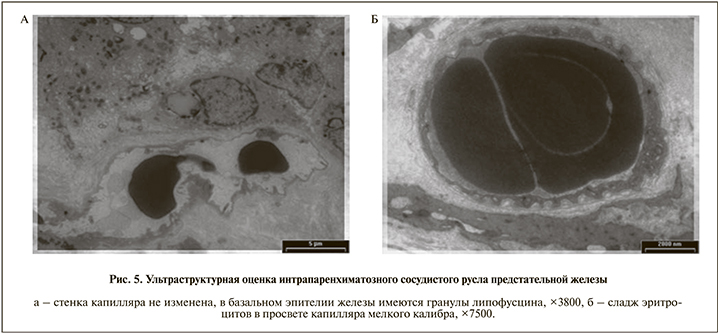
При электронно-микроскопическом исследовании сосудистого русла строение более крупных капилляров, расположенных рядом с железами, соответствовало норме, обращало внимание наличие отложений липофусцина в эпителии желез (рис. 5, а). В мелких межмышечных капиллярах нередко выявлялся сладж эритроцитов (рис. 5, б).
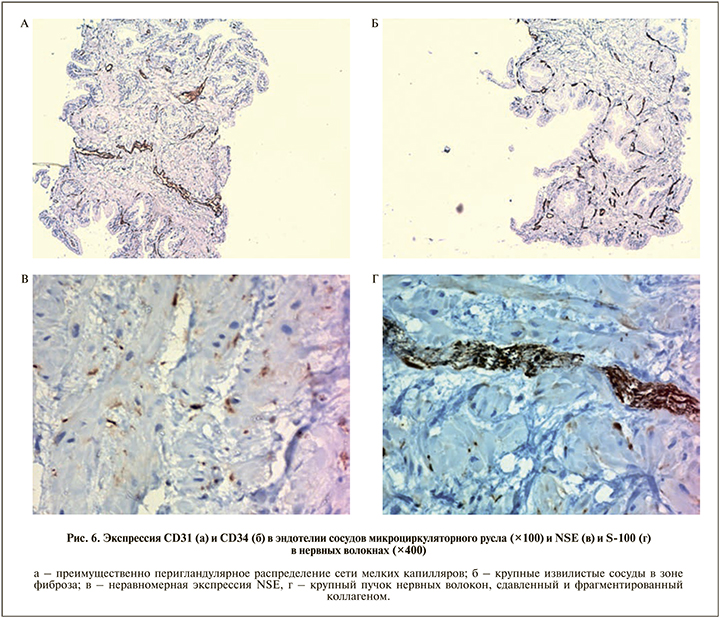
Судя по экспрессии сосудистых маркеров CD34 и CD31, полученной в ходе иммуногистохимического исследования, больше всего мелких капилляров было сохранено в перигландулярных участках ПЖ (рис. 6, а). Число сосудов в зонах фиброза было резко снижено, мелкие капилляры практически отсутствовали, а сохранившиеся сосуды крупного калибра имели извилистые контуры и неравномерный просвет (рис. 6, б).
Исследование экспрессии нейроспецифичных белков S-100 и NSE показало, что во всех исследованных биоптатах имело место снижение количества нервных волокон, они были сдавлены и деформированы массивами фиброзной ткани. Мелкие нервные волокна характеризовались различным уровнем экспрессии NSE, что может свидетельствовать о дистрофических и дегенеративных процессах (рис. 6, в). Крупные пучки нервных волокон, экспрессирующие S-100, имели рыхлую структуру, нередко были деформированы и фрагментированы разросшейся коллагеновой стромой (рис. 6, г).
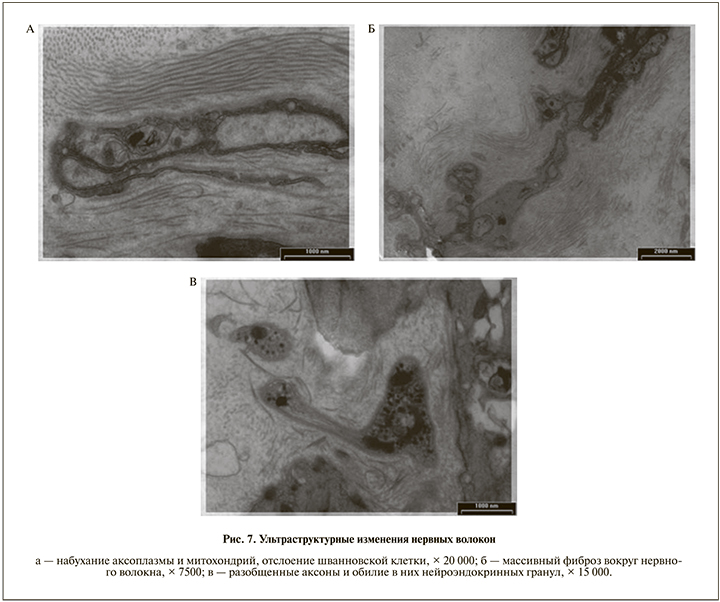
Ультраструктурное исследование выявило в аксонах мелких немиелинизированных нервных волокон признаки набухания аксоплазмы, а также содержавшихся в них митохондрий с разобщением и дезориентацией крист (рис. 7, а).
Отмечены отслоение, фрагментация участков цитоплазмы шванновских клеток. Пучки нервных волокон были окружены массивами коллагеновых волокон, отдельные аксоны разобщены, деформированы (рис. 7, б).
Нередко наблюдалось избыточное накопление нейроэндокринных гранул в аксоплазме (рис. 7, в).
Обсуждение. Настоящее исследование биоптатов ПЖ показало, что у мужчин молодого возраста с типичными клинико-лабораторными признаками СХТБ/ХП IIIБ основные изменения представлены на микроскопическом и ультраструктурном уровнях в виде дистрофии и атрофии гладкомышечных волокон, а также выраженного от умеренной до тяжелой степени фиброза, причина которых видится в повреждениях сосудистого русла органа (артериолы, артериальные и венозные капилляры). Поражения сосудов в виде гипертрофии и гиалиноза стенок сопровождаются существенными сужениями их просвета, что определяет сниженную микроциркуляцию в органе и как следствие – дегенеративные изменения нервных волокон и клеток, особенно выраженные в очагах фиброза, проявляющегося обширными межмышечными полями с массой коллагеновых фибрилл и аморфных белковых масс. Полученные морфологические данные согласуются с результатами протеомных исследований секрета простаты, цветного допплеровского картирования и МРТ-оценкой ПЖ, подтвердив сосудистый генез поражения ПЖ [8, 13, 14].
Результаты настоящего исследования коррелируют как с экспериментальными моделями хронической ишемии ПЖ [19–21], так и с уже опубликованными клиническими исследованиями [22–26], показавшими, что хроническая ишемия тазовых структур приводит к значительным изменениям простатической ткани в виде фиброза, утолщения капсулы, развития и прогрессирования атрофии желез, снижения чувствительности к нейрогенным релаксирующим воздействиям. Обнаружена также связь между выраженностью простатического ишемического фиброза и наличием СНМП, но корреляции размеров ПЖ с признаками ишемии не выявлено [7, 10].
Кроме того, чрезвычайно важно отметить, что ни в одном случае нашей серии не было выявлено признаков воспалительной реакции в тканях ПЖ, т.е. фибротические изменения в данном исследовании не ассоциировались с воспалением.
Механизмы ишемического повреждения ПЖ реализуются через реакции гипоксии и окислительного стресса [27], приводящие к набуханию митохондрий с дезориентацией крист в мышечных клетках, дезориентации миофибрилл, деградации нервных волокон и к разрыву межклеточных взаимодействий. Подобные структурные изменения, связанные с ишемией и оксидативным стрессом, могут обусловливать простатическую ригидность, объясняющую развитие и прогрессирование СНМП.
Поскольку фиброз ПЖ как патологический феномен поддерживает дисфункцию нижних мочевыводящих путей [18], совершенно очевидной представляется необходимость изучения терапевтических подходов к фибротическому процессу.
В обзоре [28], основанном на анализе 63 публикаций за 1976–2016 гг., приводятся результаты клинического использования антифибротических агентов при ряде урологических заболеваний (болезнь Пейрони, контрактура шейки мочевого пузыря, стриктура уретры). В своем заключении авторы подчеркивают, что после подтверждения эффективности и безопасности в широких, хорошо контролируемых клинических исследованиях антифибротические препараты могут стать частью лечебной парадигмы при различных заболеваниях и, как мы полагаем, в этом перечне состояний изучение лекарственной терапии фиброза ПЖ является перспективным проектом.
Заключение. Фиброз ПЖ – патобиологический феномен, и есть все основания постулировать хронический тазовый ишемический процесс как одну из его причин. Отсутствие воспалительных инфильтративных изменений в ПЖ при наличии фиброзирования на фоне поврежденного микроциркуляторного русла у больных СХТБ/ХП IIIБ позволяет не рассматривать данное состояние простатитом. В связи с этим хронический ишемический фиброз ПЖ следует исключить из классификации простатита и отнести его к осложнению постстенотического поражения тазового артериального русла.



