Уротелиальная карцинома (УК) – наиболее часто выявляемая гистологическая форма среди всех злокачественных опухолей мочевыделительной системы (МВС). Большинство (70–80%) УК МВС на момент диагностики поверхностное. К поверхностным формам рака принято относить неинвазивную папиллярную карциному (рТа), карциному in situ (рTis) и опухоли, характеризующиеся глубиной инфильтрации в пределах субэпителиальной соединительной ткани (рТ1). Остальные 20–30% новообразований характеризуются мышечно-инвазивным ростом уже на стадии выявления заболевания [1].
На сегодняшний день «золотым» стандартом диагностики УК органов МВС остается цистоскопия или уретероскопия с биопсией и последующим гистологическим исследованием материала [2, 3]. Известно, что определение риска развития и прогрессирования УК основывается на клинических и морфологических параметрах опухоли, таких как степень клеточной атипии, глубина инвазии, гистологический вариант опухоли, размер новообразования и мультифокальный характер роста. К недостаткам этого метода можно отнести следующие: 1) оценка степени клеточной анаплазии опухолевых клеток субъективна и осложнена малым объемом материала; 2) в биопсийном материале часто отсутствует мышечный слой, что не позволяет адекватно интерпретировать глубину инвазии опухоли; 3) в биопсийном материале может отсутствовать участок опухоли с наибольшей глубиной инвазии; 4) цистоскопическая картина часто не позволяет визуализировать наличие карциномы in situ. Из-за вышеперечисленных проблем частота ошибок в диагностике УК достигает 30–50% [4, 5].
 Прогресс в диагностике УК органов МВС произошел благодаря молекулярной биологии. Было установлено, что УК органов МВС, как и другие онкологические заболевания, имеет генетическую и эпигенетическую основу инициации и прогрессирования опухолевого процесса. Очевидно, что значительные различия в клиническом течении поверхностной и мышечно-инвазивной УК обусловлены различиями в генотипе опухолей.
Прогресс в диагностике УК органов МВС произошел благодаря молекулярной биологии. Было установлено, что УК органов МВС, как и другие онкологические заболевания, имеет генетическую и эпигенетическую основу инициации и прогрессирования опухолевого процесса. Очевидно, что значительные различия в клиническом течении поверхностной и мышечно-инвазивной УК обусловлены различиями в генотипе опухолей.
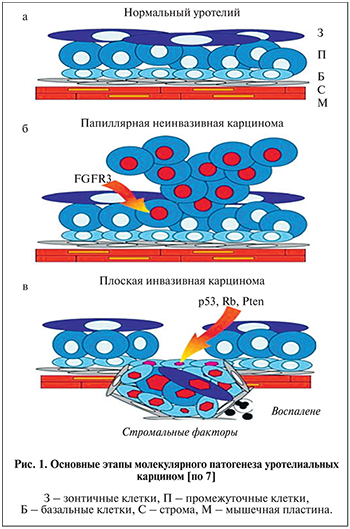
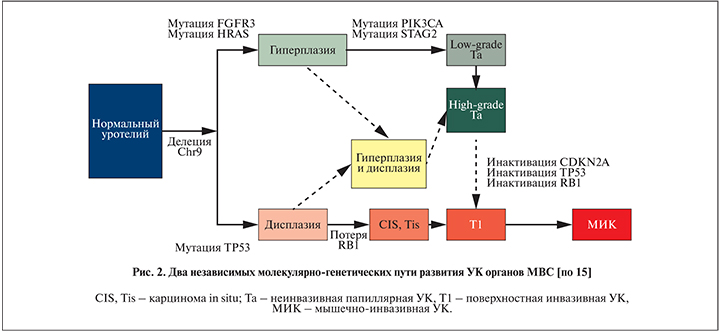
В настоящее время известны две области хромосомы 9, преимущественно теряющиеся при УК МВС, – 9р21 и 9q, что может рассматриваться как ключевое событие для развития опухоли [6]. Дальнейшие два независимых молекулярно-генетических пути развития рака определяются наличием мутации в генах FGFR3 и HRAS или инактивации пути p53/Rb/PTEN (рис. 1) [7–10].
Первый путь обусловлен мутациями в генах FGFR3 и HRAS, признанных основными молекулярно-генетическими маркерами поверхностного типа УК с исключением карциномы in situ. Механизм развития поверхностной УК заключается в гиперэкспрессии мутантного белка FGFR3, который, в свою очередь принимая участие в клеточной трансформации, усиливает экспрессию митогенактивированной протеинкиназы (МАРК). Похожий механизм реализуется и при стимуляции HRAS. При активизации каскадов МАРК происходит усиленная экспрессия транскрипционных факторов, что стимулирует клеточное деление, приводя к злокачественной трансформации [11–13]. В дополнение к непосредственной активации RAS-сигнального пути мутантный FGFR3 стимулирует фосфатидилинозитол-3-киназу (PI3K), активаторы сигнальной трансдукции и транскрипции. Активация сигнального пути «рецепторы тирозинкиназ–RAS–МАРК» играет одну из главных ролей в обновлении и пролиферации эпителиальных клеток посредством митогенного сигнала, который передается с клеточной поверхности к ядру. Следует отметить, что помимо FGFR3 в поверхностной УК гиперэкспрессируются и другие рецепторные тирозинкиназы, например рецептор EGFR и ERBB2 (HER2). Полученные результаты дают основание предполагать, что для развития поверхностной УК необходимо преимущественное повреждение системы протоонкогенов [14]. Второй путь характеризуется повреждением ТР53, RB1 и PTEN на фоне делеции генов-супрессоров опухолевого роста – р14(ARF), р15, р16, расположенных в области 9р21. В условиях нарушения регуляторных путей RB1-p16-cyclinD и ARFMDM2-р53 нарушается стабильность генома, в результате чего на фоне накопления молекулярно-генетических аберраций клетка приобретает антиапоптотический фенотип. Эти изменения достоверно чаще определяются в мышечно-инвазивных УК и являются маркерами неблагоприятного прогноза. Установлено, что для развития карциномы in situ необходима инактивация р53, в случае синхронной полной инактивации р53 и RB1 происходит дальнейшее прогрессирование с развитием инвазивного УК (рис. 2) [15]. Синхронное ингибирование экспрессии р53 и PTEN также может приводить к развитию карциномы in situ с последующим прогрессированием в мышечно-инвазивную УК. В канцерогенезе инвазивных УК альтернативой является активация пути PTEN/PI3K/AKT/mTOR [16–19]. При сравнительном анализе поверхностного и мышечно-инвазивного рака мочевого пузыря показано, что снижение экспрессии PTEN и гиперактивация AKT-сигнального пути характерны для группы инвазивных опухолей.
Поверхностные УК, склонные к прогрессированию, также характеризуются выраженной хромосомной нестабильностью, нарушением контроля клеточного цикла и апоптоза за счет мутаций и делеций генов, кодирующих белки p53, Rb1, и других участников их каскадов. В таких случаях среди других маркеров, достоверно отрицательно влияющих на прогноз поверхностной УК, определяются следующие: потеря экспрессии p21WAF1/CIP1 (ингибитор циклинзависимых киназ, эффектор р53), экспрессия VEGF – маркера пролиферации Ki-67, экспрессия матриксных металлопротеиназ, участвующих в процессе инвазии опухоли и др. (см. таблицу) [20, 21].
 Наличие различных путей развития поверхностной и мышечно-инвазивной УК кроме научного имеет и большое практическое значение. Существование молекулярных маркеров, обозначающих различное клиническое поведение УК органов МВС, открывает возможности для исследования этих маркеров в биопсийном материале. Определение мутаций в генах FGFR3 и р53 в операционном материале позволяет оптимизировать послеоперационное наблюдение и терапию пациентов с различными типами УК МВС [11, 12].
Наличие различных путей развития поверхностной и мышечно-инвазивной УК кроме научного имеет и большое практическое значение. Существование молекулярных маркеров, обозначающих различное клиническое поведение УК органов МВС, открывает возможности для исследования этих маркеров в биопсийном материале. Определение мутаций в генах FGFR3 и р53 в операционном материале позволяет оптимизировать послеоперационное наблюдение и терапию пациентов с различными типами УК МВС [11, 12].
Несмотря на значительный прогресс в изучении путей развития УК органов МВС, до сих пор отсутствует единое мнение о существовании общей клетки-предшественницы для поверхностного и мышечно-инвазивного типов УК. Еще в XIX в. была сформулирована гипотеза о существовании малодифференцированных клеток эмбрионального типа, обладавших потенциалом трансформации в раковые клетки. Открытие и разработки экспериментальных методов клонирования нормальных стволовых клеток (СК), прежде всего гемопоэтических, привели к фактическому подтверждению теории о возникновении опухолей из СК [22]. Первые раковые СК были обнаружены при изучении патогенеза лимфобластом в ходе использования метода серийных трансплантаций, разработанного в процессе доказательства существования гемопоэтических СК [23, 24]. В результате интенсивных исследований за последние 10 лет были созданы мутационные карты массы различных типов рака человека. Факт интратуморозной гетерогенности, выявленной при изучении генетического разнообразия и антигенного состава первичных опухолей, позволил выдвинуть предположение о наличии высокого уровня генетической гетерогенности и разветвленной клональной эволюции [25–27]. Между тем из смеси генетически различных субклонов клеток первичной гетерогенной опухоли только один или, возможно, несколько типов клеток могут дать развитие продолженному или рецидивному росту опухоли, что служит подтверждением их связи с СК. Аналогично тканевым СК стволовые клетки опухоли чувствительны к сигналам микроокружения и стромальным взаимодействиям [28–31].
Особо важную роль играют сигналы интегриновых взаимодействий с межклеточным матриксом, а также сигнальные пути, которые в норме активируются только в процессе эмбрионального развития (Notch, Wnt, Hedgehog, BMPs/TGFв) [32]. Экспериментальным путем доказано, что раковые СК обладают способностью к асимметричному делению, в результате которого возникает клетка-реплика исходной клетки и вторая клетка, утрачивающая способность делиться асимметрично, обладающая потенциалом неконтролируемой пролиферации и высокой инвазивности. Как раковые СК, так и их потомство характеризуются генетическими аберрациями.
Нормальная слизистая оболочка органов МВС гистологически представлена уротелием, состоящим из 3–7 рядов клеток, организованных по степени дифференцировки. Менее дифференцированные клетки базального слоя лежат на базальной мембране и покрыты несколькими рядами промежуточных клеток. Поверхностный слой формируют наиболее дифференцированные «зонтичные» клетки. Из-за вертикального увеличения степени зрелости клеток изменяется и профиль экспрессии цитокератинов, клеточных рецепторов и цепей ламинина. В норме базальные клетки экспрессируют цитокератины СК34вE12, СК5 и СК17, составные цепи молекулы ламинина, в интегрины и гиалуроновую кислоту (CD44). В промежуточных клетках на фоне ограниченного пролиферативного потенциала выявляется экспрессия СК5 и СК18. Зонтичные клетки поверхностного слоя уротелия являются высокодифференцированными клетками; они не способны к делению, но экспрессируют уроплакины и СК20. Недавно двум группам ученых удалось выделить и охарактеризовать СК рака мочевого пузыря, которые имеют сходство с базальными клетками уротелия по профилю экспрессии СК34вE12, СК5, СК17, CD44 и цепей ламинина [33– 35]. Большинство изолированных клеток демонстрировало экспрессию Gli1, являющегося мишенью сигнального пути Hedgehog, действующего в ходе эмбрионального развития. Следует отметить, что когорта белков для идентификации СК в УК расширяется за счет новых маркеров. В настоящее время изучается возможность использования перспективных стволовых маркеров – ALDH1A, CD24, CD82, CD105, CD133, CXCR4, NANOG, OCT4 и SOX-2 в диагностике УК [36, 37]. Дальнейшие исследования в этой области, безусловно, послужат дополнительным импульсом к усовершенствованию диагностики и лечения УК.
Высокая частота рецидивирования УК органов МВС остается одной из нерешенных проблем в урологической практике. Поверхностные УК рецидивируют в 30–85% случаев после проведенного лечения, причем 10–30% опухолей прогрессируют в инвазивные и метастатические карциномы. До недавнего времени предполагалось, что причиной этого феномена служат не обнаруженные на момент операции опухолевые узлы, а также имплантационная диссеминация опухолевых клеток в процессе резекции. По современным представлениям развитие рецидивов УК обусловлено комплексным повреждением слизистой оболочки органов МВС. Это предположение выдвинуто на основании сравнительной характеристики спектра молекулярных нарушений в рецидивных и первичных опухолях органов МВС. Установлено, что рецидивные, а также мультицентрические формы УК, встречающиеся в органах МВС, могут иметь как сходные, так и различные клинико-биологические и молекулярно-генетические характеристики. В связи с этим пусковой механизм развития синхронных, метахронных и мультифокальных УК базируется на двух основных теориях [38].
Согласно теории моноклонального происхождения, предшественники трансформированной клетки в процессе пролиферации приобретают способность к миграции по уротелию и дают начало рецидивным и множественным опухолям. Следовательно, потомком клеточной популяции мультифокальной и рецидивной поверхностной УК является одна злокачественная клетка, а высокая частота рецидивирования опухоли после резекции обусловлена наличием невыявленных опухолевых клеток. D. Sidransky et al. впервые упомянули о моноклональном происхождении УК с последующим интраэпителиальным или интралюминальным распространением опухолевых клеток [39]. В последующих работах ряд авторов определил для всех исследуемых рТа опухолей со степенью дифференцировки G1 и G2 только моноклональное происхождение [40]. Наряду с этим в литературе стали появляться результаты отдельных исследователей, показавших, что мультифокальные опухоли мочевого пузыря в стадии рТа и при степени клеточной анаплазии G1 только в 90% случаев имеют моноклональное происхождение. В исследованиях T. Paiss et al. [41] отмечена возможность существования более одного опухолевого клона среди множественных опухолей мочевого пузыря, особенно на ранних стадиях развития УК. Полученные результаты послужили основным толчком к выдвижению альтернативной олигоклональной теории происхождения множественных и рецидивирующих опухолей.
Суть олигоклональной теории заключается в наличии в уротелии полей, о возможном существовании которых впервые заговорил D. P. Slaughter. Он предположил, что малигнизация – это синхронный анапластический процесс множества клеток, а не изолированный клеточный феномен [42].
Некоторые исследователи интерпретируют поля как феномен, свойственный только карциномам, которые обладают защитной барьерной функцией за счет эпителиальных клеток [43, 44]. Предполагается, что в результате воздействия канцерогенных веществ на пласт эпителиальных клеток образуются протяженные участки с генетически измененными клетками. В процессе самообновления эпителиальных клеток происходят аномальные пролиферации с последующим возникновением гиперпластических, а также диспластических нарушений. В конечном итоге вышеуказанные патологические состояния в сочетании с генетическими повреждениями обусловливают появление злокачественного клона [45].
В настоящее время существование полей подтверждено для различных типов рака пищеварительной системы, молочной железы, кожи и др. Более того, в зависимости от топографии и гистологического типа опухоли определены размеры поля с целью минимизации объема хирургического лечения. Например, установлено, что эффект поля в плоскоклеточном раке головы и шеи соответствует области диаметром 7 см. D. J. Wong et al. при исследовании статуса гена P16 в пищеводе Барретта определили, что экспрессия клона с поврежденным геном обнаруживается на расстоянии 17 см от опухолевого очага [46, 47].
Исследование полей при УК связано с клиническими характеристиками этого типа опухолей. В пользу теории поля также выступают обнаружение у пациентов генетической нестабильности в морфологически нормальной слизистой оболочке мочевого пузыря, расположенной на границе с опухолевой тканью, и определение изменений типа дисплазии и CIS на значительном расстоянии от очага опухоли.
Таким образом, анализ литературы показывает, что в патогенезе опухоли оба феномена не взаимоисключающи и, следовательно, у одного пациента УК может развиваться как по одному, так и по обоим механизмам. Установлено, что инвазивные УК с высокой клеточной анаплазией (G2–3) преимущественно моноклонального генеза, тогда как на ранних стадиях УК характеризуются олигоклональностью.
Решение вопроса о клональном происхождении синхронных и метахронных опухолей в первую очередь имеет прикладное значение [48–50]. Так, в случае моноклонального характера развития опухоли значительное снижение частоты рецидивов может быть достигнуто за счет усовершенствования хирургических технологий и методов таргетной терапии, что позволит свести к минимуму возможность диссеминации и имплантации отдельных опухолевых клеток, а также повысит эффективность обнаружения малых опухолевых узлов. При олигоклональном развитии рецидивных опухолей тактика постоперационного профилактического лечения должна основываться на комплексном лечебном и иммуномодулирующем воздействии на всю слизистую [40, 51–53].
Заключение. Достижения молекулярной онкоурологии последних лет позволяют определить генетические и эпигенетические изменения генома, составляющие основу внутриопухолевой гетерогенности УК. Внедрение новых молекулярно-диагностических методов в клиническую практику будет способствовать ранней диагностике УК МВС, окажет существенную помощь при мониторинге заболевания, значительно повысит эффективность выявления рецидивов.



