Введение. На первый взгляд новая коронавирусная инфекция потеснила все прочие, в том числе лидера по смертности от инфекционных заболеваний, которым в течение многих лет оставался туберкулез. Однако уже сейчас ВОЗ предсказывает существенное ухудшение эпидемической ситуации по туберкулезу [1]. Эта инфекция высококонтагиозна (в том числе передается половым путем); даже после окончания терапии и излечения от собственно туберкулеза пациенты продолжают жаловаться на плохое состояние здоровья и низкое качество жизни [2–4].
Микробиом человека является неотъемлемой частью механизмов поддержания гомеостаза у здорового человека. Существует целый спектр взаимодействий микро- и макроорганизма [5]. Лечение туберкулеза предполагает длительный прием комплекса антимикробных препаратов, в том числе широкого спектра действия, что не может не сказаться на состоянии микрофлоры в целом и микробиома мочевыводящих путей в частности.
Цель исследования: определить влияние длительной многокомпонентной антибактериальной терапии на микробиом уретры мужчин.
Материалы и методы. В открытое проспективное несравнительное исследование включили 75 мужчин, из них 63 составили основную группу, 12 – группу сравнения.
Критерии включения пациентов в основную группу: мужской пол; диагноз «туберкулез органов дыхания»; прием противотуберкулезных препаратов в течение не менее 3 и не более 5 мес., отсутствие инфекционно-воспалительных урологических заболеваний (нет жалоб на дизурию, выделений из уретры, нормальный общий анализ мочи).
В группу сравнения вошли пациенты с неинфекционными урологическими заболеваниями (мочекаменная болезнь, аденома простаты), с нормальными анализами мочи.
Всем больным проводили соскоб слизистой уретры стерильным тампоном после туалета наружных половых органов. Идентификацию патогенных микроорганизмов и количественную оценку видового состава микробиоты в полученных образцах биоматериала выполняли методом полимеразной цепной реакции в реальном времени (ПЦР-РВ) с помощью набора реагентов «Андрофлор» (регистрационное удостоверение на медицинское изделие NРЗН 2016/4490 от 25.07.2016, производитель ООО «ДНК-Технология ТС», Россия). При проведении ПЦР-РВ использовали детектирующий амплификатор ДТ-96 (ООО «НПО ДНК-Технология», Россия). Количественные результаты исследования представлены в числе геномного эквивалента в 1 мл (ГЭ/мл), значения которых пропорциональны микробной обсемененности урогенитального биотопа.
Полученные в ходе исследования данные статистически обработаны с помощью пакета прикладных программ Microsoft Office 2007, Biostat 2009. Различия между группами определялись с использованием критерия χ2. Гипотеза об отсутствии статистически значимого влияния фактора отвергалась при р>0,05.
Результаты. «Классическая» патогенная микрофлора в соскобе уретры была выявлена у каждого третьего-четвертого больного туберкулезом. Enterobacteriaceae spp./Enterococcus spp. в титре 103–104 ГЭ/мл идентифицирована у 16 (25,4%) пациентов, Staphylococcus spp. в титре 103–106 ГЭ/мл – у 20 (31,7%) Спектр микрофлоры по убыванию представлен на рис. 1.
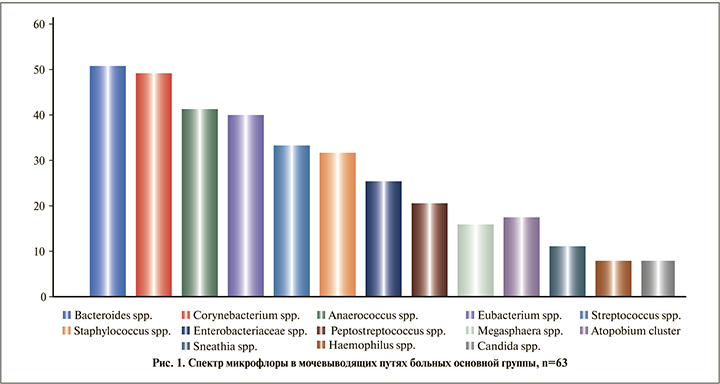
В группе сравнения у лиц, не принимавших антибактериальных препаратов, Staphylococcus spp. присутствовал в половине (6 [50%] пациентов) случаев, Enterobacteriaceae spp./Enterococcus spp. – у каждого третьего (4 [33,3%]) пациента в титре 103–105 ГЭ/мл. Детально структура микрофлоры показана на рис. 2.
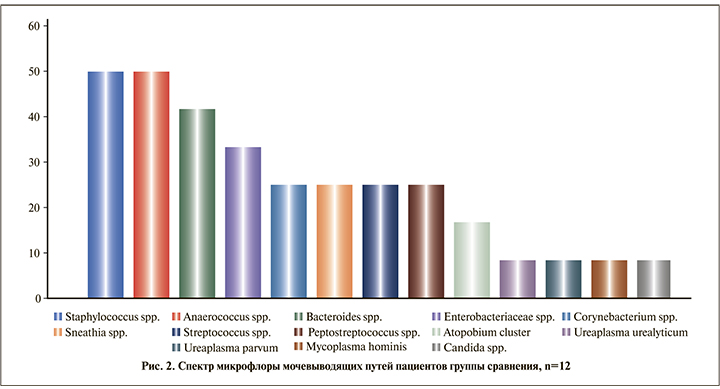
У больных туберкулезом наиболее часто обнаруживали Corynebacterium spp. (31 [49,2%] пациент), в то время как в контроле этот микроорганизм был выявлен у 3 (25,0%) пациентов. Мы ожидали развития кандидоза на фоне многомесячной антибактериальной терапии, однако частота обнаружения Candida spp. в соскобе уретры в основной группе и в группе сравнения не различалась (соответственно 7,9 и 8,3%).
Сравнение пропорций всех выделенных микроорганизмов, идентифицированных методом молекулярно-генетической диагностики, в соскобе мужской уретры представлено в таблице.
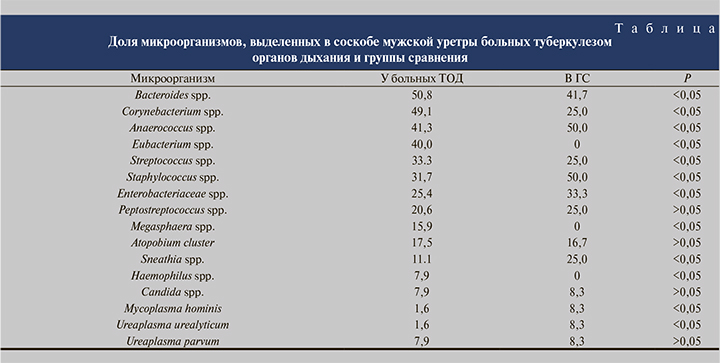
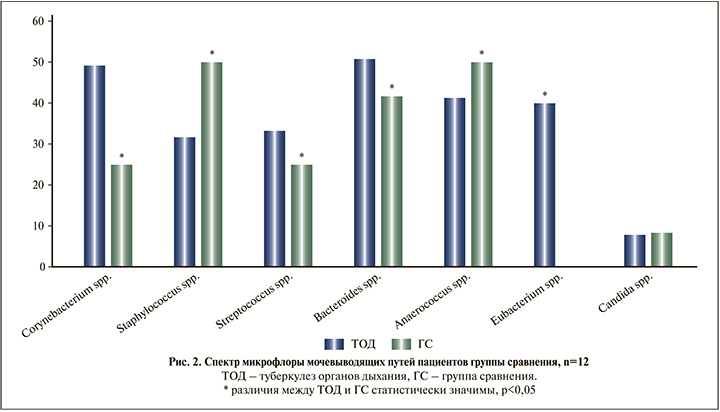
По ряду позиций выявлены статистически значимые различия, другие микроорганизмы встречались одинаково часто у пациентов, как получавших длительную антибактериальную терапию, так и не принимавших антибиотиков. Выявлены статистически значимые различия по Corynebacterium spp., Staphylococcus spp., Eubacterium spp. (последняя вообще отсутствовала в соскобе слизистой уретры в группе сравнения, но была идентифицирована у 25 [40,0%] больных туберкулезом).
Сравнение пропорций наиболее часто встречающейся микрофлоры у пациентов, длительно получавших антимикробную терапию, и в группе сравнения демонстрирует рис. 3.
Обсуждение. Микробиом человека – это сумма всей геномной информации, принадлежащей резидентной микробиоте, которая колонизирует тело [6]. Возможность измерения и характеристики микробиома мочи возникла благодаря секвенированию, которое позволяет обнаруживать резидентную микробную ДНК [6]. В мочевыводящих путях человека обитает постоянное микробное сообщество, но по сравнению со многими другими микробными нишами ее микробиом имеет относительно низкую биомассу. Эти относительно новые данные, характеризующие микробиоту мочевыводящих путей человека, противоречат многолетним представлениям о стерильности мочевыводящих путей [7–9]. Сегодня установлено, что более 100 видов более чем из 50 родов обитают в мочевыводящих путях человека [7, 10, 11]. Однако консенсуса в этой области относительно состава микробиоты мочи пока не достигнуто. Более того, роль этого микробного сообщества в здоровье и заболеваниях мочеполовой системы, таких как инфекции мочевыводящих путей (ИМП), до конца не изучена. Спектр резидентной микробиоты мочевыводящих путей зависит от здоровья хозяина и может нарушаться не только при их дисфункции, но и при воспалительных заболеваниях кишечника, бактериальном вагинозе, раке, метаболических заболеваниях и пр. [6, 12–14]. Факторы, влияющие на колонизацию микробов, включают pH, напряжение кислорода, осмолярность, доступность питательных веществ, места адгезии и иммунное взаимодействие [15]. Поскольку многие бактерии обладают строго аэробным или анаэробным метаболизмом, доступность кислорода в урогенитальном тракте может играть роль в формировании экологии и пространственной организации микробиоты этой ниши [16].
Используя секвенирование ампликона гена 16S рРНК и неприцельную полногеномную метагеномику, выявили резидентную микробиоту в 18 различных участках тела более 250 здоровых молодых людей [17, 18]. Развитие метагеномики коренным образом изменило наши возможности характеризовать таксономическую и геномную экологию микробных экосистем [19]. Появилось понимание не только того, какие микробы обитают в конкретной экосистеме, но и того, какие гены, метаболические пути и физиологические адаптации необходимы для выживания и процветания в конкретной экосистеме [17, 20]. С поиска основных таксонов в конкретной микробной экосистеме фокус исследований переключается на идентификацию основных наборов генов и метаболических путей, необходимых микробному сообществу для функционирования в нише [6]. Длительная антимикробная терапия может уничтожать полезные защитные микробные популяции. Без полезной микробиоты флора урогенитального тракта может перейти в дисбиотическое, сенсибилизированное состояние с риском колонизации уропатогенами.
Современная парадигма патогенеза ИМП учитывает контаминацию периуретрального пространства специфическими уропатогенами, проживающими в кишечнике, за которой следует колонизация уретры и проникновение патогенов в мочевой пузырь [21]. Открытие многогранного симбиотического микробиома в здоровом урогенитальном тракте заставило изменить точку зрения на стерильность мочи [22], а ведь именно на этом постулате, например, базировался подход к диагностике урогенитального туберкулеза [4].
Более высокая частота ИМП у женщин, чем у мужчин, заставила задуматься о том, что источником колонизации мочевого пузыря является влагалище, учитывая к тому же особенности женской уретры [14, 21] Это легло в основу гипотезы, согласно которой микробиота мочевого пузыря имеет вагинальное происхождение (кроме ИМП). При этом фактом наличия у мужчин ИМП и микробиотой мочи у них же пренебрегли [23].
Традиционно лишь малый спектр микроорганизмов рассматривался в качестве уропатогенов, однако молекулярно-генетические исследования существенно его расширили, хотя роль иной микрофлоры, в том числе анаэробной, не всегда ясна [24].
В перечне микроорганизмов у половины больных туберкулезом приходилось на Bacteroides spp. и Corynebacterium spp. Bacteroides spp. является обычным анаэробом, обитающим в кишечнике человека. Вместе с тем преимущественно посредством бактериальной транслокации он может попасть в кровеносное русло и стать этиологическим фактором перитонита, язвы кожи стопы и даже сепсиса [25–28]. Corynebacterium spp. являются грамположительными бактериями, которых рассматривают как нормальную флору кожи, дыхательных путей и слизистых оболочек. Имеются единичные сообщения о Corynebacterium spp. как о патогене: сообщалось, что они служат причиной пневмонии и заболеваний урогенитального тракта [29–31]. Коринебактерии – очень гетерогенная группа грамположительных палочек, в которую входит более 110 видов. Их патогенный потенциал зависит от вида: некоторые из них, например Corynebacterium glutamicum или Cladosporium halotolerans, никогда не были описаны как этиологические факторы заболеваний человека, тогда как другие были вовлечены в различные инфекционные процессы: от инфекции мочевыводящих путей до инфекционного эндокардита [31–32]. У этого рода хорошо охарактеризованы два типа факторов вирулентности. Во-первых, производство экзотоксина описано у Corynebacterium diphteriae, Corynebacterium ulcerans и Corynebacterium pseudotuberculosis. Эти три патогенных штамма могут продуцировать токсин дифтерии и/или фосфолипазу B, следовательно, вызывать дифтерию, наиболее известное заболевание, связанную с коринебактериями [32]. Даже нетоксиногенные штаммы C. diphteriae могут вызывать инвазивные инфекции, такие как эндокардит, абсцесс мозга или остеомиелит [32]. Также было показано, что некоторые виды продуцируют различные молекулы адгезии, позволяющие взаимодействовать с клетками эукариот. Коринебактерии наряду с золотистым стафилококком могут вызывать посттравматическую и/или послеоперационную инфекцию костей и суставов, формировать биопленки и проникать в остеобласты [32]. По нашим данным, Corynebacterium spp. статистически значимо преобладала у больных туберкулезом.
Streptococcus anginosus – часто упускаемый из виду и малоизученный новый патоген, обитающий во многих областях человеческого тела. S. anginosus, S. intermediateus и S. constellatus в первую очередь являются комменсальными бактериями ротовой полости, горла, желудочно-кишечного тракта и влагалища, однако могут обнаруживаться и в мочевом пузыре [29, 33]. Есть доказательства, что S. anginosus может быть этиологическим фактором инфекций дыхательных путей, абсцесса головного мозга и печени, инфекций кожи и мягких тканей; кроме того, S. anginosus может вызывать инфекции мочеполовых путей [33].
В нашем исследовании Streptococcus spp. была найдена в соскобе уретры у каждого третьего больного туберкулезом, что значительно чаще, чем в группе сравнения.
Выводы. Выявлены статистически значимые различия в спектре микрофлоры уретры у больных туберкулезом, получающих полихимиотерапию в течение минимум 3 мес., и у лиц без признаков инфекционно-воспалительного процесса в мочевыводящих путях. Роль дисбаланса микрофлоры, возникающего на фоне длительной противотуберкулезной терапии, еще предстоит изучить.



