Введение. Мочекаменная болезнь (МКБ, нефро- и уролитиаз) наряду с прочими заболеваниями современной цивилизации является одним из наиболее часто встречающихся патологических состояний. Результаты эпидемио-логических исследований подтверждают ее повсеместное распространение с выявлением в отдельных странах мира у 10–15% населения [1–5]. В России за последние десятилетия также наблюдается тенденция к увеличению числа пациентов с МКБ [6–8]. Так, в период с 2007 по 2010 г. число больных выросло на 33 919 человек (до 750 539), прирост общей заболеваемости составил 4,9%. Количество новых случаев выросло на 5269, при этом прирост первичной заболеваемости составил 2,8%. О. И. Аполихин и соавт. отметили прирост числа пациентов с МКБ в Российской Федерации с 2002 по 2014 г. на 34,5% (с 629 453 до 846 570) [8]. Показатель числа зарегистрированных больных в 2014 г. составил 578,8 на 100 тыс. населения. Доля заболевания среди всех урологических недугов достигла около 40% [9]. Рост заболеваемости уролитиазом наблюдается независимо от возраста, пола и расового происхождения [3].
Одним из отягощающих факторов течения нефролитиаза, из-за которого его по праву относят к хроническим заболеваниям, является частое рецидивирование.
В течение первых пяти–десяти лет после первого эпизода болезни частота повторного камнеобразования достигает 50–75% [10, 11]. Согласно номограмме риска рецидивного камнеобразования ROKS (Recurrence оf Kidney Stone), данный показатель составляет 11% в течение 2 лет, 20% – в течение 5, 31% – в течение 10 и 39% – в течение 15 лет [12]. В свою очередь активная метафилактика МКБ достаточно эффективна и способна снизить риск рецидива примерно на 50% [13]. Проведение профилактических мероприятий позволяет сокращать количество обращений за экстренной и хирургической помощью на 40 и 20% соответственно [14].
Современный всеобъемлющий арсенал аппаратных и инструментальных возможностей, расходных медицинских принадлежностей и лекарственных препаратов вывел диагностику и лечение уролитиаза на принципиально инновационный уровень оказания медицинской помощи. Доля пациентов, избавившихся от камня за одну плановую госпитализацию, достигает 90%, а клинически значимые осложнения встречаются не чаще 15–20% наблюдений [6, 9]. В то же время на протяжении последних десятилетий каких-либо существенных фундаментальных и прикладных изысканий в области теории камнеобразования и нового патогенетического лечения МКБ получено не было. Появление уролита как конечного звена нарушенного обмена веществ, вероятно, связано с абсолютным множеством разных внешних и внутренних причин, каждую из которых крайне сложно определить в качестве ключевой у конкретного индивида. Полиэтиологичность и частое сочетание с сердечно-сосудистыми, эндокринными и желудочно-кишечными заболеваниями позволили многим исследователям соотнести мочевое камнеобразование с метаболическим синдромом, принимая во внимание общность механизмов возникновения патологических состояний [15, 16]. Более того, ряд работ предлагает рассматривать нефролитиаз в качестве одного из компонентов синдрома нарушения обмена веществ [17, 18].
Наиболее доказанная патогенетическая связь прослеживается между метаболическим синдромом и уратной формой МКБ [19]. Пациенты с индексом массы тела (ИМТ) более 33,1 кг/м2 имеют очень высокий риск формирования мочекислых камней ([OR] 6,5; р<0,001), по сравнению с общей популяцией (15–20%) частота их выявления возрастает до 63% [20]. Инсулинорезистентность, гипергликемиия, сахарный диабет 2 типа и гипертриглицеридемия приводят к эффекту «липотоксичности» и повреждению почечного канальцевого эпителия. Ацидификация мочи вследствие снижения секреции ионов аммония и повышение общей экскреции кислот способствуют кристаллизации мочевой кислоты. Медикаментозное подщелачивание мочи является хорошо доказанным и широко применяемым подходом к профилактике и литолизу существующих камней [21, 22]. Однако возможности патогенетической лекарственной коррекции нарушений пуринового обмена, приводящих к гиперурикемии, гиперурикурии, снижению рН мочи и как следствие – к мочекислому уролитиазу, у больных метаболическим синдромом остаются малоизученными.
Недостаточная освещенность изложенных вопросов послужила поводом к проведению проспективного исследования, целью которого стала оценка эффективности и безопасности селективного ингибитора ксантиноксидазы производного 2-арилтиазола-фебуксостата (80 мг/сут.) в комплексной терапии больных уратной формой нефролитиаза, сопровождающегося хронической гиперурикемией и метаболическим синдромом.
Цель исследования: оценить клиническую эффективность и безопасность препарата Фебуксостат-СЗ, сформулировать рекомендации по его назначению больным мочекислым нефролитиазом.
Материалы и методы. Основу исследования составил анализ клинических наблюдений 525 пациентов, которые находились на обследовании, лечении и динамическом наблюдении по поводу уролитиаза. В протоколе обследования было задействовано 330 мужчин, средний возраст которых составил 41,7±20,3 года (от 20 до 74 лет), и 195 женщин, средний возраст которых составил 45,4±23,7 года (от 23 до 80 лет).
Для установления диагноза, определения тактики лечения и медикаментозной терапии все пациенты подвергались клиническим, лабораторным и инструментальным методам исследования. Данные обследования включали выяснение жалоб больных, сбор анамнеза заболевания и жизни, результаты физикального обследования. Подробно изучались предрасполагающие факторы МКБ и факторы риска повторного камнеобразования. При объективном обследовании помимо традиционных методов диагностики, включивших определение роста, веса и индекса массы тела, всем пациентам измерялся объем талии. Лабораторные методы исследования включали клинический анализ крови и мочи, биохимический анализ крови с определением мочевины, креатинина, электролитов, а также бактериологическое исследование мочи с определением чувствительности микроорганизмов к антибактериальным препаратам.
Ультразвуковое сканирование органов мочевыделительной системы производилось на аппаратах «TOSHIBA» (Япония) и «Siemens Sienna» (Германия). Рентгенологическое исследование выполнялось на аппарате «Siemens Uroscop» (Германия) и включало обзорный снимок мочевыводящих путей, а также экскреторную урографию. Компьютерная томография выполнялась на аппарате «TOSHIBA» «AQUILION 128» (Япония). Функциональное состояние почек оценивали по данным клиренса креатинина либо радиоизотопной ренографии на аппарате Siemens Е. Саm (Германия).
Пациентам вначале проводилась комплексная литокинетическая терапия с целью стимуляции самостоятельного отхождения мочевого камня из мочеточника, пероральный хемолиз или по показаниям один из методов активного удаления камня – дистанционная литотрипсия, контактная литотрипсия, перкутанная нефролитотрипсия, лапароскопическая или открытая операция либо их комбинации.
У пациентов с ранее подтвержденными при анализе минерального состава уролита мочекислыми камнями проводилась пероральная литолитическая терапия цитратными смесями с поддержанием кислотности мочи в пределах 6,5–7,1 в течение 1–3 мес.
Диагностика метаболического синдрома основывалась на обнаружении у больных мочекаменной болезнью центрального типа ожирения (объем талии у мужчин более 94 см и более 80 см у женщин) и любых двух дополнительных критериев: повышение уровня триглицеридов крови (ТГ), снижение уровня липопротеидов высокой плотности (ЛПВП), артериальная гипертензия (АГ), повышение уровня глюкозы плазмы натощак или ранее диагностированный сахарный диабет (СД) 2 типа.
Концентрация мочевой кислоты в сыворотке крови выше 420 мкмоль/л для мужчин и 370 мкмоль/л для женщин расценивалась как гиперурикемия.
Риск повторного камнеобразования оценивался согласно рекомендациям Европейской Ассоциации урологов по диагностике метаболических нарушений [15, 16].
Для оценки минерального состава камня в исследовании использовались рентгенофазовый анализ (рентгеновский дифрактометр «ДРОН-2», Россия) или инфракрасная спектрометрия (ИК-спектрометр Вrukег Vertex, Германия). После анализа камня, проведения базисного обследования и выявления в анамнезе факторов риска определялась вероятность рецидива заболевания.
Больным с высоким риском повторного камнеобразования проводилась углубленная лабораторная диагностика, направленная на определение типа литогенных расстройств. В дополнение к общеклиническому обследованию при углубленной диагностике определялся уровень кальция, фосфора, магния, мочевой кислоты и паратгормона в сыворотке крови, суточная рН-метрия мочи, биохимический анализ суточной мочи на камнеобразующие соединения (кальций, мочевая кислота, оксалат, фосфат) и ингибиторы камнеобразования (цитрат, магний, сульфат). Исследование биохимического состава суточной мочи выполняли на системе капиллярного электрофореза «Капель-105М» (НПФ «Люмекс», Россия).
После обследования пациенты были распределены на две группы. К первой отнесены больные (n=231), страдавшие мочекаменной болезнью и метаболическим синдромом, вторую группу (n=294) составили пациенты с уролитиазом без абдоминального ожирения и других проявлений си-стемных обменных нарушений. I группа была разделена на три подгруппы (А, В и С), а пациенты с уролитиазом без метаболического синдрома (II группа) – на две (А и В). В подгруппу А включены больные, которым в зависимости от риска повторного камнеобразования проводилась общая или специфическая метафилактика. Подгруппу В составили пациенты, которым по причинам, не зависящим от клинической ситуации, противорецидивная терапия не выполнялась. Помимо этого больным мочекаменной болезнью и метаболическим синдромом в подгруппе С (n=64) с участием врачей смежных специальностей (терапевт, кардиолог, эндокринолог и диетолог) производилось лечение артериальной гипертензии, СД 2 типа, дислипидемии и абдоминального ожирения (табл. 1).

71 пациент с мочекислым уролитиазом и метаболическим синдромом I группы также был распределен на 3 подгруппы. Подгруппу А составил 31 (30,5%) человек, подгруппу В – 20 (30,8%) и подгруппу С – тоже 20 (31,2%) больных. На протяжении исследования количество пациентов по причинам, не связанным с побочными эффектами лекарственных препаратов, в группах уменьшилось и в конце исследования составило 19 (61,3%), 11 (55,0%) и 13 (65,0%) человек соответственно.
Пациенты, у которых в процессе отбора не были обнаружены уратные, инфекционные, брушитные и цистиновые камни, а также не было выявлено ни одного предрасполагающего фактора, формировали группу низкого риска по повторному камнеобразованию. Этой категории больных выполнялись мероприятия общей метафилактики, включившие оптимизацию питьевого режима, сбалансированную диету и устранение неспецифических факторов риска.
Помимо назначения общих мероприятий специфическая метафилактика при мочекислых уролитах включала соблюдение строгого диетического режима, основанного на ограничении мясных и субпродуктов. Коррекция кислотности мочи и гипоцитратурии осуществлялась препаратами блемарен или уралит-У в дозе 9–12 г, разделенной на 3 приема в день с поддержанием кислотности мочи от 6,2 до 6,7. Для устранения гипеурикемии использовали ингибитор ксантиноксидазы Фебуксостат-СЗ (НАО «Северная звезда») 80 мг/сут. Он назначался только при выявлении гиперурикемии и гиперурикурии.
При кальций-оксалатных камнях метафилактика включала рекомендации по ограничению оксалатсодержащих продуктов и коррекцию метаболических нарушений. Больным абсорбтивной гиперкальциурией назначали диету, богатую пищевой клетчаткой, тиазидные диуретики (гипотиазид в дозе 25–50 мг/сут.) и/или нейтральный ортофосфат калия по 1 г 3 раза в сутки. При кишечной гипероксалурии применялись диета и минеральная вода, богатая кальцием или солями кальция, и препараты кальция (кальция цитрат) в дозе 500 мг/сут. или более под контролем кальция в моче. При гипоцитратурии использовались алкализирующие нитратные смеси. Пациентам с гипомагниурией рекомендовали препараты цитрата или лактата магния по 200 мг 2 раза в день.
Пациентам с неинфекционными фосфатными камнями при истинной гиперфосфатурии рекомендовали употребление клетчатки и низкокалорийной пищи небольшими порциями несколько раз в день. В случае неэффективности коррекции фосфатов в моче с помощью диеты применялся гидроксид алюминия (Маалокс) до 3,5 г/день на 2–3 приема. Назначение гипотиазида по 25–50 мг в сутки было показано пациентам с брушитными камнями при экскреции кальция более 5 ммоль/сут.
Специфическая метафилактика инфекционных уролитов заключалась в полном освобождении мочевыводящих путей от камней, ликвидации нарушений уродинамики и инфекции. Антибактериальная терапия проводилась с учетом результата бактериологического исследования и антибиотикограммы с обязательным контрольным исследованием стерильности мочи. При щелочной моче (рН>7,0) проводилась ее ацидификация. Достигалось это назначением метионина в зависимости от рН мочи по 500 мг 3–6 раз в день или аммония хлорида 200–500 мг в сутки.
Противорецидивная терапия проводилась непрерывно в течение полугода. Контрольное обследование обменных нарушений, уровня мочевой кислоты крови, кислотности мочи и УЗИ почек осуществлялось через 1, 3 и 6 мес. от начала лечения. Критерием эффективности считались данные о нормализации клинических, лабораторных и метаболических показателей.
Статистическая обработка результатов исследования проводилась на персональном компьютере с использованием пакета прикладных программ Statistica (Гржибовский А, 2016) [23].
Результаты исследования. По результатам минерального анализа мочевых камней у 525 участвовавших в исследовании больных чаще всего встречались оксалатные камни (вевеллит, ведделлит и их комбинации с другими минералами). У пациентов с мочекаменной болезнью и метаболическим синдромом уратные камни определялись более чем в 2 раза чаще, чем у больных изолированным уролитиазом. В обеих группах фосфатные камни обнаруживались с одинаковой частотой (рис. 1).
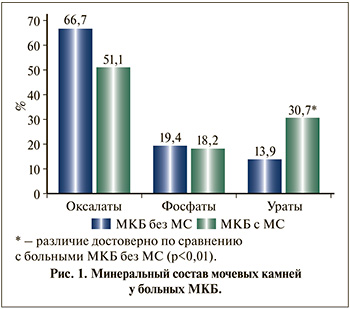
Исследование метаболических нарушений у больных мочекаменной болезнью
Выяснено, что для кальций-оксалатных камней отличительными видами метаболических нарушений стали увеличение экскреции кальция и щавелевой кислоты, гипоцитратурия и гипомагниурия, повышение концентрации в крови ионизированного кальция и снижение магния (табл. 2).
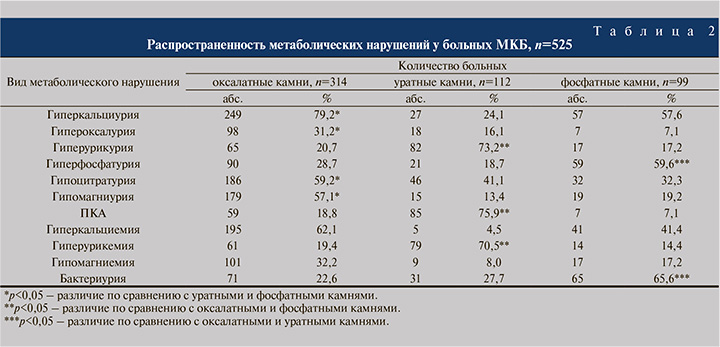
Уратный уролитиаз в 73,2% наблюдений сопровождался гиперурикурией, в 41,1% – гипоцитратурией. Низкие значения кислотности мочи наблюдались у 85 (75,9%) пациентов, повышение уровня мочевой кислоты в сыворотке крови у 79 (70,5%) человек.
Диагностика метаболических расстройств у пациентов с уратной формой МКБ
Мочевая кислота как основной источник камнеобразования при уратных уролитах, а именно ее повышенная экскреция, выявлена у 82 (73,2%) человек. Гипоцитратурия и низкие показатели кислотности мочи (рН<5,8) наблюдались в 46 (41,1%) и 85 (75,9%) случаях соответственно.
Гиперэкскреция мочевой кислоты и снижение экскреции цитрата определялись у 63 (88,7%) и 33 (46,5%) пациентов I группы и 19 (46,3%) и 13 (31,7%) II группы, а различия этих показателей оказались достоверно значимыми (р<0,05). ПКА выявлялся примерно одинаково и существенно не различался в обеих группах больных, что, возможно, свидетельствовало о том, что ацидификация мочи являлась одним из ведущих механизмов образования уратных камней (табл. 3).
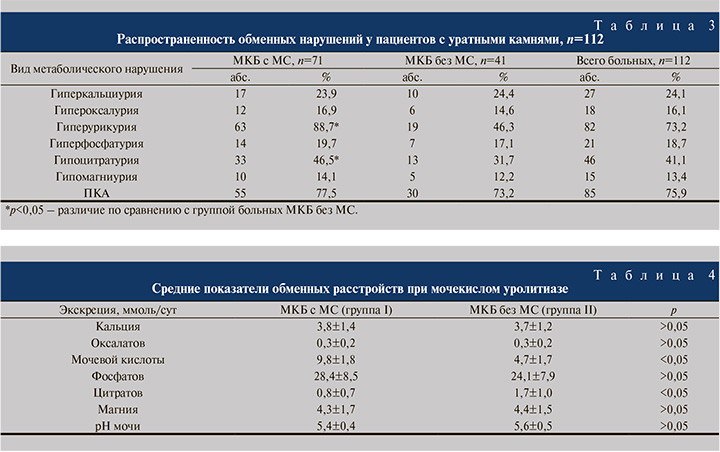
Повышение концентрации мочевой кислоты в крови больных I группы встречалось в 52 (73,2%), у пациентов с МКБ без МС – в 27 (65,8%) наблюдениях. Распространенность гиперурикемии в обеих группах не имела достоверных различий.
При анализе литогенных нарушений среди пациентов с мочекислым уролитиазом и метаболическим синдромом установлено, что указанные выше расстройства чаще всего встречались при наличии СД 2 типа или нарушении толерантности к глюкозе.
Так, гиперурикурия, гипоцитратурия и ПКА у этой категории больных выявлены в 51,8%; 49,8 и 71,3% наблюдений соответственно. Низкие показатели рН мочи и увеличение экскреции мочевой кислоты, вероятно, связаны с диабетической нефропатией у пациентов с МКБ и МС. В нашем исследовании у больных СД 2 типа чаще, чем у других, определялось нарушение аммониогенеза, проявлявшееся низкими значениями выделения NH4+. Наряду с гиперэкскрецией водородного иона гипоаммониурия может являться одним из значимых факторов ацидификации мочи.
Изменения лабораторных показателей обменных нарушений у больных уратной формой МКБ с МС носили более выраженный характер по сравнению таковыми у пациентов второй группы. Так, на этапе включения в исследование суточная экскреция мочевой кислоты у больных мочекислым уролитиазом и метаболическим синдромом была почти в 2 раза больше, чем у пациентов второй группы, и составляла 9,8±1,8 и 4,7±1,7 ммоль/л соответственно (р<0,05) (табл. 4).
Выделение с мочой за сутки цитратов у больных первой группы составило 0,8±0,7 ммоль/л и достоверно отличалось от аналогичных показателей пациентов с изолированным уролитиазом − 1,7±1,0 ммоль/л. Значения остальных обменных нарушений при сравнении больных двух разных категорий не имели существенных различий.
Противорецидивное лечение больных уратным уролитиазом с метаболическим синдромом
Один из основных литогенных показателей при мочекислом уролитиазе – уратурия, на фоне проведенной противорецидивной терапии нормализовалась и существенно снизилась только через полгода. Так, экскреция мочевой кислоты через 6 мес. уменьшилась с 9,8±1,8 до 3,9±1,1 ммоль/л (р<0,05) и далее оставалась в пределах нормальных значений. Достоверное увеличение экскреции цитратов и рН мочи также произошло к полугоду метафилактики. Выделение с мочой цитратов и кислотность мочи через 6 мес. возросли с 0,8±0,6 до 2,5±0,8 ммоль/л и с 5,4±0,5 до 6,3±0,5 соответственно и остались на значимом уровне в течение всего периода наблюдения (р<0,05) (табл. 5).
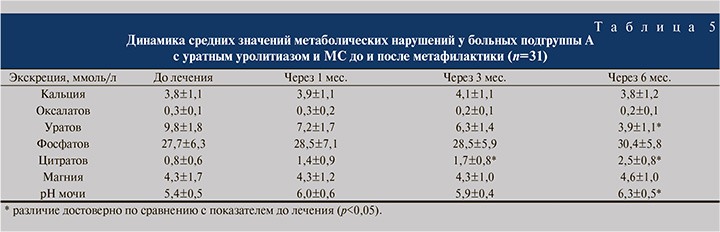
Гиперурикемия обнаружена у 25 (80,6%) пациентов подгруппы А с мочекислыми камнями и МС и на фоне только метафилактики уролитиаза нормализовалась спустя полгода лечения. Через 6 мес. противорецидивной терапии концентрация мочевой кислоты в сыворотке крови снизилась с 451,4±15,1 до 385,2±16,2 ммоль/л (р<0,05). Другие метаболические нарушения были не характерны для уратного уролитиаза, и на протяжении наблюдения и метафилактики динамика их значений оказалась несущественной. Компоненты метаболического синдрома (абдоминальное ожирение, артериальная гипертензия, дислипидемия, гипергликемия) у пациентов подгруппы А с уратным уролитиазом ввиду отсутствия специфического лечения имели тенденцию к увеличению.
У 20 пациентов с мочекислыми камнями и МС, которым не проводилось лечение (подгруппа В), выявлены похожие значения показателей обменных расстройств. Однако, ввиду отсутствия лечения изменения экскреции литогенных соединений и ингибиторов кристаллизации, кислотности мочи, биохимических показателей крови и компонентов метаболического синдрома в течение всего периода наблюдения оказались недостоверными. Более того, определялась прогрессия указанных состояний.
При уратном уролитиазе литогенные нарушения в моче пациентов, которым помимо метафилактики производилось лечение метаболического синдрома (подгруппа С), существенно уменьшились. Так, экскреция мочевой кислоты через 3 мес. снизилась в 2 раза: с 9,7±1,9 до 5,0±1,2 ммоль/л (р<0,05), и оставалась в пределах нормальных значений на протяжении всего срока наблюдения. Увеличение кислотности мочи и выделение с мочой цитратов произошли также к третьему месяцу и связаны с проведением нитратной терапии и лечением такого компонента МС, как СД 2 типа, приводящего к значительной ацидификации мочи. рН мочи и экскреция цитратов возросли с 5,4±0,4 до 6,3±0,5 и с 0,8±0,5 до 2,3±1,0 ммоль/л и остались на значимом уровне в течение последующего наблюдения (р<0,05) (табл. 6).
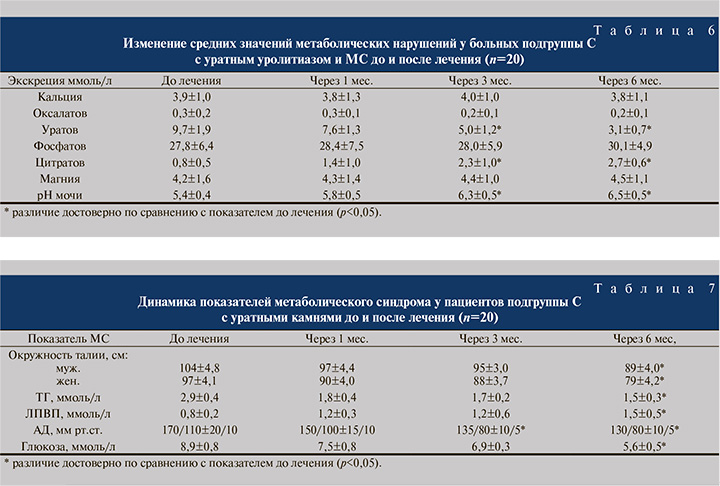
Свойственное уратному уролитиазу повышение мочевой кислоты в крови выявлено у 16 (80,0%) больных подгруппы С с мочекислыми камнями и МС. Через 6 мес. лечения гиперурикемия уменьшилась с 459,5±17,7 до 370,9±15,1 ммоль/л (р<0,05). Остальные лабораторные показатели метаболических нарушений в суточной моче были не характерны для мочекислого уролитиаза, и на протяжении всего срока лечения динамика их значений оказалась несущественной.
В целом положительные результаты в лечении метаболического синдрома у пациентов с уратной формой МКБ в подгруппе С были достигнуты 13 (65,0%) больными. Показатели углеводного и липидного обменов нормализовались через полгода лечения. Так, через 6 мес. концентрация глюкозы и ТГ в крови уменьшилась с 8,9±0,8 до 5,6±0,5 и с 2,9±0,4 до 1,5±0,3 ммоль/л соответственно, а ЛПВП увеличилась с 0,8±0,2 до 1,5±0,5 ммоль/л (р<0,05). Значения других компонентов метаболического синдрома снизились также через полгода. Окружность талии у мужчин с уратным уролитиазом в подгруппе С через 6 мес. уменьшилась с 104±4,8 до 89±4,0 см, у женщин − с 97±4,1 до 79±4,2 см (р<0,05). Показатели артериального давления уменьшились до нормальных значений и в течение 5 лет не имели тенденции к увеличению (табл. 7).
Рецидивное камнеобразование у больных первой группы с мочекислыми уролитами значительно уменьшилось при проведении метафилактики уролитиаза и коррекции метаболического синдрома. Повторное образование камней у пациентов с уратным уролитиазом на фоне метафилактики через полгода составило 12,9% (рис. 2).
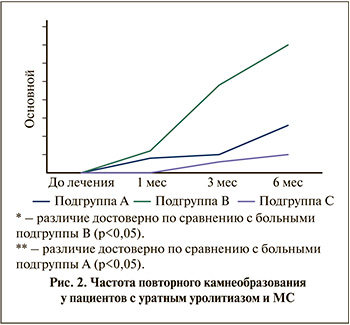
Дополнительное проведение коррекции компонентов метаболического синдрома позволило снизить частоту рецидива мочекислого уролитиаза еще на 8% (р<0,05). Течение уратного вида МКБ в совокупности с МС характеризовалось скорым образованием и отхождением мелких (до 4 мм) камней от 1–2 до 2–3 за полгода либо формированием крупных уролитов. Лишь у 1 (5%) больного в подгруппе С через полгода определился рецидив болезни. У всех остальных пациентов этой категории отмечалась стабилизация заболевания, проявившаяся в отсутствии формирования новых камней и уменьшении клинических проявлений (почечные колики, обострение пиелонефрита и т.д.). Таким образом, положительный результат от проведения метафилактики МКБ и коррекции МС при завершении исследования наблюдался у 19 (95%) из 20 человек. Повторное камнеобразование у больных уратной формой МКБ и МС в подгруппе В 6 мес. выявлено в 35%.
На протяжении исследования у пациентов, которым проводилась медикаментозная коррекция гиперурикемии, гиперурикурии, были отмечены побочные эффекты легкой степени. Головная боль зафиксирована в 3 (0,57%) случаях, сыпь – в 3 (0,57%), отеки – в 2 (0,38%), обострение подагрического артрита – в 1 (0,19%).
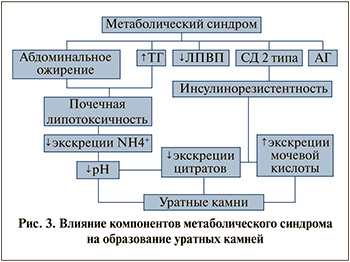
Обсуждение. По нашему мнению, патогенез мочекислого уролитиаза при метаболическом синдроме можно представить следующим образом. Формирование уратного камня происходит в результате снижения кислотности мочи, гиперуратурии и гипоцитратурии. Вышеназванные патологические состояния в свою очередь слкжат следствием нарушения почечного аммониогенеза и инсулинорезистентности (рис. 3).
Заключение. Среди больных МКБ метаболический синдром был выявлен у 44%. Ураты встречались в 2 раза чаще (30,7 против 13,9%) у пациентов с обменными нарушениями, частота обнаружения оксалатов и фосфатов не зависела от этого состояния. Частота (88,7%) гиперурикемии и суточной экскреции мочевой кислоты (9,8±1,8 ммоль/л) у больных уратной формой уролитиаза и метаболическим синдромом была в 2 раза выше.
Применение Фебуксостата-СЗ в комплексной терапии на протяжении полугода показало высокую клинико-лабораторную эффективность в отношении нормализации кислотности мочи, уровня суточной экскреции и сывороточной концентрации мочевой кислоты у пациентов с мочекислой формой нефролитиаза как с метаболическим синдромом, так и без него. Удовлетворительная переносимость и минимальный профиль побочных явлений позволили провести 6-месячный курс лечения 85% наблюдаемых. Показанием к назначению Фебуксостата-СЗ могут служить уратная и кальций-оксалатная формы МКБ, сопровождающиеся метаболическим синдромом и гиперурикемией. Лечение указанной категории пациентов целесообразно проводить с врачами-специалистами терапевтического профиля (кардиолог, диетолог, нефролог и эндокринолог).



